G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
Neurochirurgie xxx (2014) xxx–xxx
Disponible en ligne sur
ScienceDirect www.sciencedirect.com
Rapport 2013 : Les chordomes
Les chordomes Chordoma B. George a,∗ , D. Bresson a , S. Bouazza a , S. Froelich a , E. Mandonnet a , S. Hamdi a , M. Orabi a , M. Polivka b , A. Cazorla b , H. Adle-Biassette b , J.-P. Guichard c , M. Duet d , E. Gayat e , F. Vallée e , C.-H. Canova f , F. Riet f , S. Bolle f , V. Calugaru f , R. Dendale f , J.-J. Mazeron f , L. Feuvret f , E. Boissier f , S. Vignot f , S. Puget g , C. Sainte-Rose g , K. Beccaria g a
Service de neurochirurgie, hôpital Lariboisière, 2, rue Ambroise-Paré, 75010 Paris, France Service d’anatomopathologie, hôpital Lariboisière, 2, rue Ambroise-Paré, 75010 Paris, France c Service de neuroradiologie, hôpital Lariboisière, 2, rue Ambroise-Paré, 75010 Paris, France d Service de médecine nucléaire, hôpital Lariboisière, 2, rue Ambroise-Paré, 75010 Paris, France e Service d’anesthésie-réanimation, hôpital Lariboisière, 2, rue Ambroise-Paré, 75010 Paris, France f Service de radiothérapie et d’oncologie médicale, hôpital de la Salpêtrière, institut Gustave-Roussy, institut Curie, 47-83, boulevard de l’Hôpital, 75013 Paris, France g Service de neurochirurgie, hôpital Necker, 149, rue de Sèvres, 75015 Paris, France b
i n f o
a r t i c l e
Historique de l’article : Rec¸u le 3 juillet 2013 Rec¸u sous la forme révisée ´ 2014 le 14 fevrier Accepté le 11 mars 2014 Disponible sur Internet le xxx Keywords: Chordoma Skull base Mobile spine Diagnosis Prognosis
a b s t r a c t Purposes. – To review in the literature, all the epidemiological, clinical, radiological, histological and therapeutic data regarding chordomas as well as various notochordal entities: ecchordosis physaliphora, intradural and intraparenchymatous chordomas, benign notochordal cell tumors, parachordomas and extra-axial chordomas. To identify different types of chordomas, including familial forms, associations with tuberous sclerosis, Ollier’s disease and Maffucci’s syndrome, forms with metastasis and seeding. To assess the recent data regarding molecular biology and progress in targeted therapy. To compare the different types of radiotherapy, especially protontherapy and their therapeutic effects. To review the largest series of chordomas in their different localizations (skull base, sacrum and mobile spine) from the literature. Materials. – The series of 136 chordomas treated and followed up over 20 years (1972–2012) in the department of neurosurgery at Lariboisière hospital is reviewed. It includes: 58 chordomas of the skull base, 47 of the craniocervical junction, 23 of the cervical spine and 8 from the lombosacral region. Similarly, 31 chordomas in children (less than 18 years of age), observed in the departments of neurosurgery of les Enfants-Malades and Lariboisière hospitals, are presented. They were observed between 1976 and 2010 and were located intracranially (n = 22 including 13 with cervical extension), 4 at the craniocervical junction level and 5 in the cervical spine. Methods. – In the entire Lariboisière series and in the different groups of localization, different parameters were analyzed: the delay of diagnosis, of follow-up, of occurrence of metastasis, recurrence and death, the number of primary patients and patients referred to us after progression or recurrence and the number of deaths, recurrences and metastases. The influence of the quality of resection (total, subtotal and partial) on the prognosis is also presented. Kaplan-Meier actuarial curves of overall survival and disease free survival were performed in the entire series, including the different groups of localization based on the following 4 parameters: age, primary and secondary patients, quality of resection and protontherapy. In the pediatric series, a similar analysis was carried-out but was limited by the small number of patients in the subgroups. Results. – In the Lariboisière series, the mean delay of diagnosis is 10 months and the mean follow-up is 80 months in each group. The delay before recurrence, metastasis and death is always better for the skull base chordomas and worse for those of the craniocervical junction, which have similar results to those of the cervical spine. Similar figures were observed as regards the number of deaths, metastases and recurrences. Quality of resection is the major factor of prognosis with 20.5 % of deaths and 28 % of recurrences after total resection as compared to 52.5 % and 47.5 % after subtotal resection. This is still more
∗ Auteur correspondant. Adresse e-mail : [email protected] (B. George). http://dx.doi.org/10.1016/j.neuchi.2014.02.003 0028-3770/© 2014 Elsevier Masson SAS. Tous droits réservés.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
2
obvious in the group of skull base chordomas. Adding protontherapy to a total resection can still improve the results but there is no change after subtotal resection. The actuarial curve of overall survival shows a clear cut in the slope with some chordomas having a fast evolution towards recurrence and death in less than 4 years and others having a long survival of sometimes more than 20 years. Also, age has no influence on the prognosis. In primary patients, disease free survival is better than in secondary patients but not in overall survival. Protontherapy only improves the overall survival in the entire series and in the skull base group. Total resection improves both the overall and disease free survival in each group. Finally, the adjunct of protontherapy after total resection is clearly demonstrated. In the pediatric series, the median follow-up is 5.7 years. Overall survival and disease free survival are respectively 63 % and 54.3 %. Factors of prognosis are the histological type (atypical forms), localization (worse for the cervical spine and better for the clivus) and again it will depend on the quality of resection. Conclusions. – Many different pathologies derived from the notochord can be observed: some are remnants, some may be precursors of chordomas and some have similar features but are probably not genuine chordomas. To-day, immuno-histological studies should permit to differentiate them from real chordomas. Improving knowledge of molecular biology raises hopes for complementary treatments but to date the quality of surgical resection is still the main factor of prognosis. Complementary protontherapy seems useful, especially in skull base chordomas, which have better overall results than those of the craniocervical junction and of the cervical spine. However, we are still lacking an intrinsic marker of evolution to differentiate the slow growing chordomas with an indolent evolution from aggressive types leading rapidly to recurrence and death on which more aggressive treatments should be applied. © 2014 Elsevier Masson SAS. All rights reserved.
r é s u m é Mots clés : Chordome Base du crâne Rachis Diagnostic Pronostic
Objectifs. – Faire une revue de littérature de toutes les données épidémiologiques, cliniques, radiologiques, anatomopathologiques et thérapeutiques concernant les chordomes et les différentes entités notochordales décrites : ecchordosis physaliphora, chordomes intraduraux et intraparenchymateux, tumeurs bénignes à cellule notochordale, parachordomes et chordomes extra-axiaux. Identifier les différentes formes de chordomes, en particulier les formes familiales, les formes associées à la sclérose tubéreuse de Bourneville, à la maladie d’Ollier et au syndrome de Maffucci, les formes métastatiques, les formes avec essaimage. Analyser les nouvelles données de biologie moléculaire et leurs applications thérapeutiques. Comparer les différentes formes de radiothérapie complémentaire, notamment la protonthérapie et leurs intérêts thérapeutiques. Analyser les grandes séries de chordomes de la littérature selon les différentes localisations de chordomes (base du crâne, sacrum et rachis mobile). Matériel. – La série de 136 chordomes traités et suivis dans le service de neurochirurgie de l’hôpital Lariboisière sur les 20 dernières années (1992–2012) est présentée. Elle comprend 58 patients ayant un chordome localisé à la base du crâne, 47 à la charnière craniocervicale, 23 sur le rachis cervical et 8 au niveau lombosacré. La série de chordomes observés dans la population pédiatrique (moins de 18 ans) des services de neurochirurgie de l’hôpital des Enfants-Malades et Lariboisière sur une période de 34 ans (1976–2010) inclut 31 enfants dont 22 localisations crâniennes dont 13 étendues au rachis cervical, 4 au niveau de la charnière craniocervicale et 5 au niveau cervical. Méthodes. – Pour la série Lariboisière, ont été analysés sur l’ensemble de la série et sur les différents groupes de localisation, les délais moyens de diagnostic, de suivi, de survenue de décès, de récidive et de métastase ainsi que le nombre de patients pris en charge initialement ou secondairement (après récidive ou progression), le nombre de décès, de récidives et de métastases. L’influence sur ces paramètres, de la qualité de l’exérèse, selon qu’elle a été initialement totale, subtotale ou partielle, est présentée. Des courbes actuarielles de Kaplan-Meier de survie globale et sans progression ont été établies sur l’ensemble de la série et les différentes localisations, de fac¸on globale et en fonction de différents paramètres : l’âge, la prise en charge primaire ou secondaire, la qualité de l’exérèse, le traitement par protonthérapie. Pour la série pédiatrique, une analyse similaire a été effectuée, avec cependant des limites liées aux petits effectifs dès que l’on subdivise la série. Résultats. – Pour la série Lariboisière, le délai diagnostic moyen est de 10 mois et le suivi moyen de 80 mois dans les différentes localisations. Le délai sans progression, de survenue de métastase, de récidive et de décès est toujours meilleur pour les chordomes de la base du crâne; ceux de la charnière craniocervicale sont moins bons et se comparent plus volontiers à ceux du rachis cervical. Il en est de même pour le nombre de décès, de métastases et de récidives. La qualité de l’exérèse est un élément majeur du pronostic avec 20,5 % de décès et 28 % de récidive après exérèse totale contre 52,5 % et 47,5 % après exérèse subtotale. Ceci est encore plus net dans le groupe des chordomes de la base du crâne. L’adjonction d’une protonthérapie améliore les résultats après exérèse complète mais ne change rien si l’exérèse a été subtotale. En courbe actuarielle, la survie globale indique deux groupes de patients : certains ayant une évolution rapide avec récidive et décès avant 4 ans et d’autres ayant une survie prolongée, parfois au-delà de 20 ans. L’âge n’a aucune influence sur le pronostic. La prise en charge primaire améliore la survie sans progression mais pas la survie globale. La protonthérapie n’améliore que la survie globale pour l’ensemble de la série et pour les chordomes de la base. La résection complète améliore la survie globale et sans progression dans tous les groupes. Enfin, l’intérêt d’associer résection complète et protonthérapie apparaît clairement. Dans la série pédiatrique, le suivi médian est de 5,7 ans. La survie globale et sans progression à 15 ans est respectivement de 63 et 54,3 %. Les facteurs de mauvais pronostic observés sont le type histologique (formes atypiques), la localisation (meilleure pour le clivus, moins bonne pour le rachis) et là encore la qualité de l’exérèse.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
3
Conclusions. – Il existe de nombreuses entités dérivés de la notochorde ; certaines sont des vestiges ; d’autres possiblement des précurseurs des chordomes ; et d’autres encore des tumeurs apparentées mais probablement différentes des véritables chordomes. Les données immuno-histologiques devraient aujourd’hui permettent de les différencier. Les connaissances en biologie moléculaire font naître des espoirs de traitements complémentaires efficaces mais pour l’instant la qualité de l’exérèse reste le meilleur facteur de pronostic. La protonthérapie complémentaire semble améliorer les résultats en particulier pour les chordomes de la base du crâne dont le pronostic paraît moins sévère que celui des chordomes de la charnière craniocervicale et du rachis cervical. Enfin, il manque toujours un paramètre intrinsèque qui permettrait de différencier les chordomes d’évolution lente de ceux évoluant et récidivant rapidement et pour lesquels une attitude agressive serait particulièrement justifiée. © 2014 Elsevier Masson SAS. Tous droits réservés.
1. Introduction Le chordome est une entité pathologique très particulière. C’est une tumeur plutôt rare, développée à partir de vestiges embryonnaires et qui le plus souvent ne comporte pas de caractéristiques de malignité sur le plan histologique. Et pourtant, son histoire naturelle et son évolution sous traitement s’apparentent beaucoup à celles d’une tumeur à malignité locale. Le chordome a trois localisations principales : le sacrum, le rachis cervical et la base du crâne. Chacune de ces localisations pose des problèmes sur le plan chirurgical ; problème d’accès pour certaines d’entre elles mais surtout problème de résection complète du fait de l’extension tumorale. La chirurgie reste pourtant la modalité thérapeutique essentielle. La résection complète est le seul élément de bon pronostic non controversé. Néanmoins, l’adjonction d’une irradiation à doses élevées, utilisant des techniques particulières préservant les structures fonctionnelles présente un grand intérêt dans la prise en charge des chordomes. Le traitement médical est une modalité en devenir. Les progrès de la biologie moléculaire concernant l’origine et la croissance tumorale permettent d’envisager une efficacité prochaine des thérapies dites « ciblées » sur les chordomes. À ce jour, ont été rapportés que des traitements palliatifs ou des essais thérapeutiques sur de courtes séries sans que rien de vraiment probant n’ait encore été démontré. En liaison avec le développement de la biologie moléculaire, des études génétiques ont commencé à apparaître, rapportant des altérations de gènes impliquant des perturbations biologiques conduisant à la formation et à la croissance de cette tumeur. Le chordome nécessite donc d’ouvrir de nombreuses portes pour en comprendre les différents aspects ; des plus classiques : clinique, radiologique, chirurgical, à d’autres plus étonnants pour une tumeur bénigne : radiothérapie, chimiothérapie et jusqu’à certaines données fondamentales d’embryologie, de biologie moléculaire et de génétique. C’est ce que ce rapport va essayer d’entreprendre, en sachant qu’il correspond aux données acquises à ce jour, sans doute, on l’espère, rapidement dépassées pour certaines dans quelques années. 2. Historique Il semble que ce soit Luschka qui, le premier en 1856, ait découvert de petites protrusions « comme de la gelée » (jelly-like), dans le crâne au niveau du clivus de Blumenbach [1]. Virchow, la même année, en fit une description et les dénomma : « ecchondrosis physaliphora ». En fait, il choisit ce terme car il pensait que ces protrusions étaient d’origine cartilagineuse à partir de la synchondrose sphénooccipitale. En 1858, Muller émit l’idée que ces excroissances pouvaient être non pas d’origine cartilagineuse, mais dérivées de la notochorde. Pour avancer cela, il avait comparé des coupes histologiques de chordomes à celles de notochorde d’embryons humains, en assimilant la synchondrose sphéno-occipitale à un disque intervertébral
que l’on supposait être un vestige notochordal (Fig. 1). En fait, son idée fut ignorée pendant de nombreuses années et c’est l’appellation de Virchow [565] qui resta généralement acceptée jusqu’en 1895, date à laquelle Ribbert établit clairement l’origine notochordale de ces tumeurs auxquelles il donna le nom de chordomes. Ensuite, dans de nombreuses publications, une comparaison entre chordome, entité pathologique tumorale à malignité locale, tumeurs bénignes à cellules notochordales, vestiges notochordaux et nucleus pulposus des disques intervertébraux supposé être le seul résidu de la notochorde primitive a été faite. Parallèlement, des cas cliniques de plus en plus nombreux ont été publiés. Le premier chordome localisé dans la région nasopharyngée a été opéré en 1864 par Klebs [2] ; le premier chordome cervical en 1904 par Linck [3] et le premier chordome sacrococcygien en 1922 par Stewart [4]. À cette date, seulement 22 cas de chordomes, toutes localisations confondues, avaient été publiés. L’un d’entre eux, un chordome nasopharyngien chez un garc¸on de 16 ans, avait nécessité deux interventions pour assurer son exérèse avec un résultat remarquable puisqu’on indique qu’il n’y a eu aucune morbidité postopératoire ni récidive. Néanmoins, le délai de suivi n’a pas été indiqué [5]. En 1935, une revue de littérature fait état de 150 cas publiés (Mabrey [6]) ; Harvey et Dawson [7] en colligent 240 en 1941 ; Faust et al. [8] 250 en 1944 ; enfin Utne et Pugh [9] en rassemblent 505 en 1955. 3. Embryologie Depuis Muller en 1858, les chordomes sont rattachés à leur origine notochordale. Même si initialement, ils ont été considérés comme d’origine cartilagineuse et que la confusion a persisté longtemps entre chondrosarcomes et chordomes, aujourd’hui la différence est clairement établie [10]. La notochorde est un élément en forme de tige qui définit l’axe primitif de l’embryon. Sur le plan phylogénétique, c’est un élément commun retrouvé chez toutes les espèces supérieures du monde animal à partir de l’Amphioxus. Pour cette espèce, la notochorde est le seul élément axial. Chez les autres espèces du groupe des chordés, la notochorde est remplacée par un squelette osseux qui devient la colonne vertébrale et une partie de la base du crâne. Cependant, une partie de la notochorde va pouvoir persister sous forme de vestiges. La notochorde se forme dès la 3e semaine de la vie embryonnaire à partir du nœud de Hensen. Initialement, l’embryon est un disque ovale à grand axe antéropostérieur avec deux couches cellulaires : l’ectoblaste et l’endoblaste. À partir de l’ectoblaste des cellules migrent vers la ligne médiane et s’y regroupent, formant la ligne primitive dont l’épaississement antérieur est le nœud de Hensen. De cette ligne primitive, les cellules s’enfoncent en profondeur puis s’étalent latéralement pour former une troisième couche : le mésoblaste. À partir du nœud de Hensen, donc en avant, des cellules s’invaginent en doigt de gant sur la ligne médiane. Le nœud de
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 4
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 1. Article de 1894 sur l’ecchordosis physaliphora sphéno-occipitalis et la photographie du Pr Virchow. Article published in 1894 on the ecchordosis physaliphora sphenoocipitalis with Pr Virchow’s picture.
Hensen recule alors vers l’extrémité caudale au fur et à mesure que ce prolongement céphalique se forme et devient le canal chordal puis la plaque chordale et enfin la notochorde (au 20e jour). En fait, c’est un cordon continu et plein situé sur la ligne médiane entre les deux parties latérales du mésoblaste (Fig. 2). Le mésoblaste s’organise et se segmente d’avant en arrière devenant les somites avec trois parties (4e semaine, diamètre de 7 mm) ; de dehors en dedans et de la surface vers la profondeur, on distingue les dermatomes, les myotomes et les sclérotomes. C’est à ce stade que les cellules de la notochorde deviennent des cellules volumineuses et vacuolées remplies d’une substance mucoïde comparables aux cellules physaliphores caractéristiques des chordomes.
Fig. 2. Mise place chez l’embryon de la notochorde au milieu du mésoderme et entre ectoderme et endoderme. Scheme of the embryo with the notochord inside the mesoderm and between ectoderm and endoderm.
Au-dessus de la notochorde et du mésoblaste, l’ectoblaste devient le neuroectoderme dont une partie va devenir le tube neural. En dessous, l’entoblaste va s’organiser pour former le tube digestif (Fig. 3). Les sclérotomes de chaque côté de la notochorde vont se rejoindre au-dessus et en dessous de la chorde pour constituer les vertèbres (Fig. 4). Progressivement, la chorde va présenter des renflements correspondant aux disques et des rétrécissements au niveau des corps vertébraux. On observe une énorme dilatation au niveau de la région lombosacrée (Fig. 5). La chorde s’étend alors depuis l’ébauche du sacrococcyx jusqu’à la poche de Rathke sous l’hypophyse. Elle passe donc à travers les corps vertébraux jusqu’à la pointe de l’odontoïde, le corps de l’atlas et enfin la partie inférieure du clivus ; puis elle traverse d’arrière en avant le basi-occiput pour se retrouver derrière le pharynx primitif ; elle entre à nouveau dans le basi-occiput pour finir dans la paroi osseuse derrière la posthypophyse. À partir de la 15e semaine, les îlots de notochorde dégénèrent pour disparaître au fur et à mesure de l’ossification des corps vertébraux. Cette involution des cellules chordales, commencée à la 6e semaine, va se poursuivre longtemps puisqu’on peut retrouver des cellules chordales jusque pendant la deuxième décennie de la vie. On en trouve à la base du crâne et dans les corps vertébraux. Selon les données autopsiques, il persisterait même des vestiges notochordaux chez 2 à 5 % des individus, essentiellement au niveau du renflement sacrococcygien (60 % des cas environ) et dans la région sphéno-occipitale (30 à 35 % des cas). On a retrouvé également, mais très rarement, sur des radiographies (tomographies) un canal radio transparent traversant une vertèbre verticalement comme le faisait la notochorde embryonnaire [11–14]. Schmorl [15] a observé aussi 8 fois (7 thoraciques et 1 lombaire) sur 5000 autopsies, un vestige de petit volume dans un corps vertébral.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
5
Fig. 3. A. Différenciation de l’ectoderme en plaque neurale. B. Formation du tube neural et différentiation des crêtes neurales. C. Séparation des crêtes neurales du neuroectoderme de part et d’autre du tube neural. La notochorde se situe en arrière du tube neural. A. Differentiation of the ectoderm to the neural plaque. B. Formation of the neural tube and separation of neural crests. C. Neural crests appear on both sides of the neural tube. The notochord is located behind the neural tube.
La persistance de vestiges aux deux extrémités de la notochorde embryonnaire a pu être expliquée par les remaniements importants qui s’y produisent ; notamment la disparition de plusieurs segments entiers du renflement de l’extrémité caudale. On peut mettre en parallèle les nombreuses anomalies et tumeurs tératoïdes observées à ce niveau. À l’extrémité céphalique, les 3 premiers myotomes donnent les muscles de la langue, et les
sclérotomes la lame basilaire (basi- occiput et basi-sphénoïde) ; de nombreux remaniements s’opèrent avec la plicature du tube neural expliquant la possibilité de fragments résiduels détachés de la notochorde désintégrée. On ne retrouve pas la même intensité de modifications sur le rachis mobile, ce qui pourrait expliquer la moindre fréquence des vestiges notochordaux et donc la rareté des chordomes à ce niveau.
Fig. 4. Différentiation des somites en dermatomes, myotomes, sclérotomes (de la superficie vers la profondeur) de chaque côté du tube neural. Le sclérotomes s’organisent autour du tube neural pour former les vertèbres. Differentiation of the somites into dermatomes, myotomes and sclerotomes (from surface to depth) on both sides of the neural tube. Sclerotomes are going to move around the neural tube to form the vertebrae. D’après Buckingham et al. [567] ; publié avec l’autorisation de Wiley Blackwell.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 6
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 5. La notochorde involue en ne formant plus qu’un fin cordon au niveau des vertèbres mais avec un épaississement persistant au niveau des disques (B). Il persiste parfois après la naissance le stigmate de ce cordon dans les vertèbres (A). The notochord disappears and finally is made only of a string, small inside the vertebrae and thicker at the level of the discs (B). This string is sometimes persisting inside the vertebrae after birth (A). D’après Taylor [12] (A) ; (A) et (B) publiés avec l’autorisation de Wiley Blackwell.
Il faut aborder la question controversée du nucleus pulposus. Il est considéré par beaucoup comme étant le seul reste de la notochorde après la naissance, et pourtant il ne serait pas le point d’origine des chordomes rachidiens. En effet, les chordomes se développent à partir des corps vertébraux et non des disques. Le plus souvent, une seule vertèbre est envahie par le chordome ; lorsque plusieurs le sont, les disques intermédiaires sont en général respectés. Cela avait déjà été remarqué par Horowitz en 1941 [16]. Pourtant, on retrouve beaucoup de similarités sur le plan histologique, y compris en microscopie électronique [17] entre la structure du nucleus pulposus et celle du chordome. Il existerait toutefois des différences au niveau de la biologie moléculaire. Par ailleurs, une étude ancienne réalisée par Ribbert [18] en 1895 est fort troublante. Le nucleus pulposus de lapins a été ponctionné et le produit de ponction déposé à la surface antérieure du disque ; ceci a donné lieu quelques semaines plus tard à une formation d’allure tumorale dont la structure histologique était celle d’un chordome. Cette étude a, de plus, été confirmée par Congdon [19] en 1952. Le « chordome » obtenu était plutôt du type « tumeur bénigne à cellules notochordales » car sa croissance s’arrêtait rapidement puis la tumeur involuait. En fait, depuis 1857, des opinions contradictoires ont été avancées avec des partisans affirmant que le nucleus pulposus était le seul reste de la notochorde et inversement d’autres supportant l’idée que la notochorde disparaissait entièrement, le nucleus pulposus provenant du cartilage embryonnaire périchordal. Finalement, des études plus récentes montrent que la notochorde serait progressivement remplacée au niveau des disques par du fibrocartilage jusque dans les premières années de la vie [20–23]. Les deux types cellulaires observés au niveau du nucleus pulposus de l’adulte [24] seraient néanmoins dérivés de la notochorde si on se base sur l’immuno-histochimie et les études cytogénétiques. Enfin, si l’origine des chordomes se situe au niveau des disques, comment expliquer les chordomes sacrés et surtout ceux de la base du crâne ?
À l’inverse, il paraît beaucoup plus probable que les chordomes se développent à partir des vestiges notochordaux. La distribution topographique et même la fréquence de ces vestiges correspondent clairement avec celles des chordomes. Il a même été rapporté deux cas de chordomes sacrococcygiens et un du clivus [25] situés à proximité de vestiges notochordaux. Ces vestiges s’observent dans le clivus [18], la couche sous-muqueuse du nasopharynx [26], les corps vertébraux [27] et la région sacrococcygienne [28]. Des îlots de cellules notochordales ont aussi été retrouvés sur la face antérieure cartilagineuse des corps vertébraux [25]. Les chordomes trouveraient donc leur origine à partir des vestiges de la notochorde et non pas de son seul résidu en fin d’évolution au niveau du nucleus pulposus. Reste encore à expliquer les exceptionnels mais bien réels chordomes strictement intraduraux, voire intracérébraux ou encore d’autres comme ceux développés en extra-axial tel celui rapporté par Leroux-Robert et De Brux [29] au niveau de l’écaille occipitale et beaucoup d’autres ensuite y compris dans les tissus mous. Le facteur inducteur de la croissance tumorale à partir des vestiges notochordaux a aussi été discuté. Un traumatisme a été suggéré notamment rachidien en s’appuyant sur l’expérimentation de Ribbert rapportée plus haut ; il a été avancé que la survenue d’une hernie discale post-traumatique pourrait mobiliser le nucleus pulposus et induire un chordome. Difficile à accepter, compte tenu des réserves sur le nucléus énoncées auparavant. Actuellement, c’est essentiellement du côté de la génétique et de la biologie moléculaire que sont recherchés les facteurs inducteurs des chordomes. 4. Les entités pathologiques notochordales De nombreuses entités pathologiques sont dénommées à l’aide de termes comprenant un mot dérivé de la notochorde. Cela témoigne des difficultés à établir le diagnostic de chordome. En fait, la confusion est apparue dès les premières descriptions. Les vestiges notochordaux ont d’abord été rattachés au cartilage de la
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
synchondrose sphéno-occipitale : l’ecchondrosis physaliphora qui est devenue plus tard l’ecchordosis physaliphora (EP). Puis a été décrit le chordome intradural (CH ID), masse tumorale prépontique le plus souvent et histologiquement très proches du chordome classique (CH). Plus récemment, ont été observés et décrites les tumeurs bénignes à cellules notochordales (en anglais benign notochordal cell tumor [BNCT]). À ces entités, il faut ajouter ce qui a été appelé parachordome ou chordome extra-axial ou encore chordoma periphericum. Trois termes qui pourraient désigner des entités similaires ou très différentes. Ces parachordomes peuvent être localisés un peu partout dans les os mais en dehors des vertèbres, d’où l’appellation parfois utilisée, de chordomes extra-axiaux ; ils ont également été décrits dans les tissus mous comme le poumon. Des cas de chordomes parapharyngés, extraosseux ont également été rapportés. Si on considère qu’ils correspondent au développement de tumeurs à partir de l’extrémité de la notochorde située sous le basi-occiput, il faut les classer parmi les chordomes véritables sinon il faut les inclure dans les parachordomes. Il faut rappeler la confusion entre chordomes et chondrosarcomes ou plus globalement entre tumeurs d’origine notochordale et tumeurs d’origine cartilagineuse. Cette confusion a duré depuis la découverte des vestiges notochordaux jusqu’à l’utilisation en routine de l’immuno-histochmie. C’est cette technique qui a permis de différencier les chordomes chondroïdes des chondrosarcomes. Les chordomes chondroïdes ont été décrits avant l’immunohistochimie par Heiffelfinger comme une variante de chordomes à matrice chondroïde, mais il est plus que vraisemblable que certains d’entre eux étaient en fait des chondrosarcomes de bas grade et vice versa. Néanmoins, le problème de la distinction entre tumeurs cartilagineuses et notochordales n’est pas entièrement réglé. En effet, il persiste des formes intermédiaires qui posent problème. C’est le cas pour certains qui pensent que les parachordomes seraient à classer dans ce qui est dénommé chondrosarcomes myxoïdes extrasquelettaux ; pour d’autres, ils correspondent à des sarcomes chordoïdes. On peut y ajouter les chordomes avec composante à cellules malignes en fuseau (chordomas with malignant spindle cell component). Au sujet de cette entité, trois hypothèses ont été avancées ; l’une est une simple coïncidence de survenue simultanée de chordomes et de tumeurs malignes à cellules en fuseau. Les deux autres évoquent soit une forme de chordomes à croissance très rapide, soit un autre phénotype du chordome où les cellules moins différenciées prendraient le dessus sur les cellules conventionnelles. Et pour que la confusion soit totale, il faut souligner que dans les parachordomes sont souvent retrouvées des cellules en fuseau. Enfin, il ne faut pas oublier de mentionner certains types de tumeurs à composante chordoïde. À noter aussi les méningiomes et les gliomes chordoïdes. Pour les méningiomes, cette composante les fait classer parmi les méningiomes atypiques (type II). 4.1. Vestiges notochordaux ou ecchordosis physaliphora (EP) Ils ont été découverts par Luschka en 1856 [1] mais n’ont été rattachés à la notochorde que près de 40 ans plus tard par Ribbert et Steiner [30] en 1894. Ils les retrouvent dans 2 % des autopsies, localisés au niveau du clivus en regard de la jonction sphéno-occipitale. Ils ont été confirmés mais avec une fréquence différente par Steward et Burrow [31] (1,5 % de 200 autopsies) en 1923 puis par Wyatt et al. [32], 0,36 % (6 sur 1600 autopsies) en 1971. L’EP est une formation intradurale, prépontique, de petite taille (inférieure à 2 cm) et rattachée au clivus par un petit pédicule. Il est parfois identifié en IRM. Mehnert et al. [33] en 2004 en a ainsi retrouvé 5 cas sur 300 IRM (1,7 %). L’aspect est celui d’une masse homogène en hyposignal en T1, hypersignal en T2 et ne prenant
7
pas le contraste. Le pédicule rattachant la masse au clivus est visible trois fois sur cinq. Des anomalies osseuses avec un signal similaire à la masse principale sont parfois visibles au niveau du clivus, là où s’insère le pédicule. À noter qu’un des cinq cas a pu être contrôlé deux ans plus tard en IRM avec une image inchangée. Ces masses sont en principe de petit volume, inférieur à 2 cm de diamètre, et donc généralement asymptomatiques mais on retrouve dans la littérature au moins 12 cas révélés par des symptômes. Le plus souvent il s’agit de symptômes non spécifiques : céphalées, étourdissement, vertiges. . ., mais ont aussi été rapportés d’autres cas révélés par une diplopie, une hémiparésie et même une hémorragie intratumorale entraînant le décès [34]. D’autres cas ont été découverts devant une rhinorrhée par fuite de LCR au niveau du clivus [35–37] (Tableau 1).
4.2. Les chordomes intraduraux (CH ID) Autre entité : le chordome intradural (CH ID), qui serait donc plus une tumeur qu’un vestige non prolifératif. En fait, la distinction entre EP et plus ou moins gros chordomes intraduraux (CH ID) est difficile à faire. Des cas similaires à ceux rapportés plus haut et révélés par une hémorragie ou une fuite de LCR ont été décrits avec le diagnostic de CH ID et non d’EP. Tashiro et al. [47], en 1994, publient le cas d’une femme de 56 ans dont le CH ID prépontique a été découvert devant une atteinte de plusieurs nerfs crâniens (le V, le VII et le XII) ; de plus ils colligent 10 cas dans la littérature dont 7 prépontiques, un de l’angle pontocérébelleux, un suprasellaire et un du foramen magnum ; il s’agissait de 6 hommes et 3 femmes (pour l’un, le sexe n’est pas mentionné), âgés de 26 à 75 ans. La lésion mesurait de 2 à 6 cm. Deux ont été révélés par des hémorragies entraînant le décès [48] et leur diagnostic a été fait à l’autopsie. Plus récemment, ont été rapportés plusieurs cas traités soit par chirurgie soit par radiothérapie. Bergmann et al. [49] ont présenté 3 cas, 2 femmes et un homme, âgés de 38 à 44 ans ; deux de ces tumeurs étaient localisés dans la région cervicale haute et l’autre en prépontique. Les trois ont été opérés plus ou moins complètement, avec un recul de 1 à 7 ans sans récidive. Jiagang et al. [50,51] décrivent un CH ID suprasellaire chez un homme de 51 ans révélé par des céphalées et une baisse d’acuité visuelle, et opéré par voie ptérionale (Fig. 6). Ito et al. [52] présentent deux femmes porteuses de CH ID ; la première, âgée de 59 ans, avait un CH ID adhérant au tronc cérébral et traité par radiochirurgie ; l’autre, âgée de 75 ans, a présenté plusieurs récidives et a été opérée à plusieurs reprises avant d’être traitée par Gammaknife. Ce cas est l’un des rares ayant présenté des récidives ce qui est à l’encontre du bon pronostic habituel, même après chirurgie partielle, de ces CH ID. Feng et al. [37] rapportent un très petit CH ID du clivus révélé par une rhinorrhée et traité par endoscopie endonasale ; sa petite taille le ferait plutôt classer dans les EP. Ils retrouvent 3 autres cas dans la littérature ayant aussi présenté une fuite de LCR mais tous étaient de plus gros volume avec un diamètre supérieur à 10 mm. Feng et al. considèrent que son cas est une EP et les autres des CH ID. Plusieurs revues de littérature ont été publiées après celle de Tashiro et al. [47] en 1994 : celle de Nishigawa, en 1998, portant sur 14 cas, et la dernière par Ciarpaglini et al. [53] en 2009 colligeant 22 cas de CH ID intracrâniens et 9 d’EP symptomatiques. Depuis lors, on peut ajouter 5 cas de CH ID rachidiens [49,54–56] dont 4 cervicaux et un thoracique, et 9 cas intracrâniens [50,51,57–63] dont 6 prépontiques, 1 suprasellaire et 1 latéro-bulbaire au niveau du foramen magnum associé à une sclérose tubéreuse de Bourneville et 1 du cavum de Meckel (Tableau 2). Parmi les CH ID, il faut mettre à part les chordomes intraparenchymateux (Tableau 3). Au moins 4 cas ont été rapportés [78–81].
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
8 Tableau 1 Ecchordrosis physaliphora symptomatiques. Symptomatics of ecchordrosis physaliphora. Référence
Âge/sexe
Siège
Signes
Chirurgie
RxTT
Récidive
Suivi
Évolution
Stam et Kamphorst [34] Macdonald et al. [35] Akimoto et al. [38] Toda et al. [39] Ng et al. [40] Cha et al. [41] Takeyama et al. [42] Ling et al. [43] Fracasso et al. [44] Rotondo et al. [45] Alkan et al. [46]
75/M 66/F 51/F 56/F 84/M 49/M 12/M 45/F 48/F 47/F 12/M
Prépontine Prépontine Prépontine Prépontine Prébulbaire Prépontine Prépontine Prépontine Prépontine Prépontine Prépontine
HM Fuite LCR Diplopie Céphalée− Hémiparésie + trouble sensitif Trouble équilibre Hémiparésie + diplopie Surdité HM Céphalée Hémo VII Dysarthrie Hémiparésie Fuite LCR
Non Total Total Total Total Total SubT Total Non Total Non
Non Non Non Non Non Non Non Non Non Non Non
Non Non Non Non Non Non Non Non Non Non Non
? 4M ? 2A 6M 18 M 6M 4S ? 12 M 4S
DcD RAS ? RAS RAS RAS RAS ? DcD RAS RAS
Total
Non
Non
Feng et al. [37]
Prépontine
RAS
RAS : rien à signaler ; RxTT : radiothérapie ; DcD : décédé ; SubT : exérèse subtotale. RAS: free of progression; RxTT: radiotherapy; DcD: death; SubT: subtotal.
Le premier chez un homme de 58 ans était localisé au niveau de la tente avec une extension intraparenchymateuse sus et sous tentorielle. La lésion découverte en 1981 devant des céphalées, mesurait 1,8 cm de diamètre. Le patient a refusé tout traitement pendant près
de 8 ans mais revint en urgence, léthargique, confus, dysarthrique avec des troubles visuels et un Parinaud. Il s’améliora après dérivation de son hydrocéphalie puis devint comateux quelques jours plus tard. Il fut opéré en deux temps, sur la fosse postérieure puis
Tableau 2 Chordomes intraduraux. Intradural chordomas. Références
Âge/sexe
Siège
Symptômes
Chirurgie
RxTT
Récidive
Suivi
Évolution
Dahlin et Maccarty [64] Bartolini [65] Mathews et Wilson [66] Mapstone et al. [48] Vaquero et al. [67] Yuhi et al. [68] Ramiro et al. [54] Wolfe et Scheithauer [69]
? 57/M 41/M 26/M 39/F 28/M 33/F 44/M
Pont Pont Selle Pont Supraselle Pont T6 Pont
Non Non SubT SubT Total ? Total SubT
Non Non Oui ? ? Non ? Non
Non Non ? ? ? Non Non Non
? ? 4S ? ? 18 M 12 M ?
DcD DcD HM RAS ? DcD RAS RAS DcD
Katayama et al. [70]
70/F 30/F
Supraselle FM
SubT Total
Non Non
Non Non
? 11 M
Amélioration Amélioration
Hardie [71]
28/F
Pont
?
?
?
?
RAS
Tashiro et al. [47] Wanibuchi et al. [72] Vaz et al. [55] Nishigaya et al. [73]
56/F 54/M 37/F 56/M
Pont Supraselle C5-T2 Pont
? Total SubT SubT
? Non Non Non
? Non Non Non
? 5M 18 M 5 ans
? RAS Def main Surdité
Korinth et al. [74]
48/F
APC
SubT
Oui
Oui
?
Métastases rachis
Gelabert-González et al. [56] Danilewicz et al. [75] Masui et al. [76]
65/M 19/F 63/M
C6-C7 Pont Pont
Total Total Total
Non Non Non
Non Non Non
2 ans 12 ans ?
RAS Diplopie CN VI
Roberti et al. [77]
58/M ? ? 9/M 60/M 30/M 59/F 75/F 51/M 38/M 44/F 76/M 38/M
Pont Pont Selle Pont Pont Pont Pont Pont Supraselle Cervical Cervical Pont FM lat Pont Meckel
Asymptomatique CN HLH endocrine CN hémiparésie Confus CN équilibre Paraparésie Diplopie Confus Dysarthrie Troubles visuels Coma Paraparésie Diplopie VIII Paraparésie CN HLH Paresthésies Syndrome cérébelleux CN Trouble équilibre Troubles visuels Paraparésie CN multiples CN équilibre, tetraparésie Équilibre ? ? Céphalées Trouble mémoire CN V ? ? Troubles visuels Douleur Douleur Diplopie équilibre HIC + TSC Hémo Vent CN V
Total Total Total Total SubT Total SubT Total Total Total Total SubT SubT
Non Non Non Non Non Non Oui Oui ? Non Non Non Oui
Non Non Non Non Non Non ? Multiples ? Non Non Non Non
12 M ? ? 1 an 4M 1 an ? ? ? 7 ans 1 an 5 ans ?
RAS CN IV RAS RAS RAS RAS ? ? ? RAS RAS RAS CN IX, X
Chang et al. [57] Ciarpaglini et al. [53] Bhat et al. [59] Ito et al. [60] Jiagang et al. [50,51] Bergmann et al. [49]
Kimmell et al. [58] Kim et al. [62] Barresi et al. [63]
RAS : rien à signaler ; RxTT : radiothérapie ; DcD : décédé ; SubT : exérèse subtotale. RAS: free of progression; RxTT: radiotherapy; DcD: death; SubT: subtotal.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
9
Tableau 3 Chordomes intraduraux intraparenchymateux. Intradural intraparenchymatal chordomas. References
Âge/sexe
Site
Clinique
Chirurgie
RxTT
Récidive
Suivi
Évolution
Warnick et al. [78]
58/M
Tente
SubT
?
?
?
HLH
Commins et al. [79]
51/F
Hypothal
Total
Non
Non
Non
DcD
Dow et al. [80] Figueiredo et al. [81]
9/F 18/M
Cervelet Pineal
Dysarthrie Troubles visuels Confus HIC HIC Parinaud
SubT SubT
Non Oui
Non Oui
14 M 16 A
MéningiteRAS DcD
RAS : rien à signaler ; RxTT : radiothérapie ; DcD : décédé ; SubT : exérèse subtotale. RAS: free of progression; RxTT: radiotherapy; Dcd: death; SubT: subtotal.
sur le lobe occipital. Il récupéra et ne conserva qu’une hémianopsie latérale homonyme avec au scanner un petit résidu le long du sinus droit. Le deuxième fut observé chez une femme de 51 ans, hospitalisée pour des céphalées et un état confusionnel. Elle présentait une hypertension intracrânienne avec œdème papillaire et hydrocéphalie. Le scanner et l’IRM ont découvert un chordome de la région hypothalamique, remontant dans le V3, d’environ 2 cm de diamètre. La patiente s’améliora après ventriculo-cisternostomie mais décéda 3 jours après l’exérèse de la lésion par voie transcorticale transventriculaire. À l’autopsie, on mit en évidence un hématome de l’hypothalamus antérieur. Le troisième patient était une fille de 9 ans présentant un chordome du cervelet, révélé par une hypertension intracrânienne et réséqué de fac¸on subtotale, et dont le résidu était stable en IRM 14 mois après. Enfin, le dernier patient, un garc¸on de 18 ans, présentait un chordome de la pinéale ; il fut hospitalisé pour douleurs et ballonnements abdominaux. Il avait été opéré 16 ans auparavant d’une masse pinéale étiquetée germinome, intervention complétée par une dérivation ventriculo-péritonéale et une radiothérapie. À l’examen, on retrouvait un syndrome de Parinaud et une paralysie du III. L’IRM mit en évidence une tumeur pinéale prenant le
contraste, et l’échographie, une masse abdominale autour du cathéter de dérivation. La biopsie de cette masse, réalisée sous scanner révéla un chordome. La tumeur pinéale ne fut pas réopérée mais le diagnostic initial fut révisé pour conclure à un chordome avec métastase le long de la dérivation. Le patient décéda rapidement de complications systémiques (sic) (Tableau 3). On peut y ajouter le cas rapporté en communication affichée par une équipe lyonnaise (DA Guerra Sierra) lors du congrès de Vienne (Autriche) en 2011 ; il s’agissait d’une femme de 65 ans opérée d’un cancer du sein en 2007 et présentant une masse occipitale considérée initialement comme une métastase et qui s’est révélée être un chordome. Ces tumeurs intraparenchymateuses posent le problème de leur origine car il est difficile d’imaginer un résidu de la notochorde aussi à distance. On est obligé d’évoquer une migration ectopique de résidus notochordaux ou la transformation de cellules pluripotentes vers des cellules chordales sous l’influence de facteurs encore inconnus. Par ailleurs, on ne peut pas négliger le fait qu’ils ne s’agissent pas de véritables chordomes car la plupart n’ont pas eu d’étude immuno-histochimique complète en particulier de recherche de positivité pour les cytokératines et la brachyurie. Les critères qui sont maintenant retenus en faveur d’une EP et qui la différencient des CH ID sont : la petite taille (inférieure à 2 cm), le caractère asymptomatique, l’absence de prise de contraste en IRM, l’existence d’un tractus la reliant au clivus visible en scanner ou à l’intervention, l’absence de matrice myxoïde extracellulaire en histologie et un coefficient de prolifération (Ki 67) nul ou très faible. Sur le plan évolutif, les EP restent stables et asymptomatiques alors que les CH ID augmentent de volume au cours du temps. Néanmoins, l’exérèse totale ou subtotale des CH ID est le plus souvent possible du fait de l’absence d’envahissement osseux et de limites bien définies dans les espaces sous-arachnoïdiens ; leur pronostic est donc généralement bon même en cas d’exérèse incomplète. La plupart des cas rapportés n’ont pas récidivé bien qu’aucun traitement complémentaire (radiothérapie) n’a le plus souvent été réalisé. Il faut cependant souligner que la durée de suivi postopératoire est souvent courte. 4.3. Les tumeurs bénignes à cellules notochordales (BNCT)
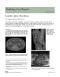
Fig. 6. CH intradural. A. Dans la citerne opto-chiasmatique. B. Latéro-médullaire. Intradural chordoma. A. In the opto-chiasmatic cistern. B. In the latero-medullary cistern. D’après Jiagang et al. [50,51] ; publié avec l’autorisation d’Elsevier (A) ; d’après Kimmell et al. [58] (B).
La tumeur bénigne à cellule notochordale, en anglais benign notochordal cell tumor (BNCT), est une autre entité chordale qui a pu être décrite sous d’autres dénominations : résidu notochordal géant intravertébral [82], hamartome notochordal géant d’origine intraosseuse, chordome bénin [82,83]. Le terme de BNCT semble, à juste titre, devoir s’imposer. Il s’agit d’une lésion intravertébrale évoquant un chordome, contenant des cellules physaliphores avec des caractéristiques immunohistochimiques similaires à celles du chordome. Néanmoins, cette entité pathologique ne comporte aucune destruction osseuse ni aucune invasion des tissus mous. L’aspect en IRM est celui d’un chordome, hormis la prise de contraste qui est absente dans les BNCT (tout comme dans les EP). Ces BNCT seraient donc plus
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 10
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 7. Benign notochordal cell tumor (BNCT). Aspect en IRM coupes axiales et sagittales en T1 et T2. Benign notochordal cell tumor (BNCT). MRI features in axial and sagittal T1 and T2 views. D’après Lalam et al. [568] ; publié avec l’autorisation de Springer-Verlag Berlin, Heidelberg.
proches de vestiges que de tumeurs évolutives. Cette question n’est en fait pas tranchée. La première description qu’en a faite Ulich et Mirra [84] en 1982 évoque un résidu notochordal intravertébral. D’autres publications ont suivi, dans lesquelles la BNCT fut découverte lors d’autopsie [85,86] ou par hasard lors d’interventions chirurgicales (Mirra, Yamaguchi, Ulich). Il s’agissait de lésions infracentimétriques, non visibles sur les examens radiologiques. Des lésions plus volumineuses et parfois symptomatiques, souvent visibles en imagerie ont été publiées ultérieurement. Darby et al. [87] en 1999 soulèvent la question : vestige ou véritable tumeur ? Mirra et Brien [88] en 2001 évoquent la possibilité d’un hamartome car les BNCT ne grossiraient que pendant l’enfance et seraient stables ensuite, en tout cas pendant plus de 10 ans. Haasper et al. [89] renforcent cette idée en affirmant que les BNCT opérés ne présentent aucune récidive et ce pendant plus de 10 ans. Néanmoins, le terme d’hamartome est récusé par Yamaguchi et al. [90] en 2008, car contrairement aux hamartomes, les BNCT contiennent du tissu immature. Pour certains, la BNCT serait un précurseur du chordome qui aurait, avant sa transformation, une croissance réduite, voire nulle. Cette hypothèse est supportée par la découverte de BNCT au voisinage d’authentiques chordomes. Deshpande et al. [91], en 2007, en retrouvent 6 au voisinage des 82 (3 %) chordomes qu’ils ont opérés ; Yamaguchi et al. [83] présentent un homme de 57 ans dont le chordome du coccyx était accolé à une BNCT et associé à 2 autres dans le sacrum ; le même auteur, en 2005, rapporte 2 cas de BNCT intra-osseuse, associée à un chordome extraosseux [92]. Nishiguchi et al. [93] décrivent une lésion comportant un mélange de chordome et de BNCT. Cette lésion prenait faiblement le contraste en IRM mais était positive en TEP-FDG (Fig. 7). Elle a été traitée après biopsie par Carbone 11 entraînant une régression importante sans récidive à 24 mois. Les BNCT sont le plus souvent de découverte incidentelle. Yamaguchi et al. [85,86], en 2004, trouvent 20 BNCT sur une série de
100 autopsies. Lorsqu’elles sont symptomatiques, il s’agit le plus souvent de douleurs locales spontanées ou provoquées à la pression. Plus rarement sont décrites des sensations de raideur ou d’engourdissement. Dans la série autopsique de Yamaguchi, l’âge varie de 7 à 82 ans (63 ans en moyenne) avec une distribution de sexe M/F à 3/1. Ils ont été retrouvés chez 11,5 % des clivus étudiés, 5 % des cervicaux, 2 % des lombaires et 12 % des sacrums. Sur le plan radiologique, la BNCT peut être invisible en scanner mais peut aussi se révéler par un aspect condensé, sclérotique de l’os. En IRM, elle est presque toujours apparente sous la forme d’un hypersignal homogène en T2 et un hyposignal homogène en T1 mais sans prise de contraste ; la lésion est bien circonscrite sans destruction ni extension au-delà de la vertèbre. L’image radiologique peut occuper jusqu’à 50 % du corps vertébral. L’os autour de la lésion est normal ou montre un discret épaississement des travées osseuses. Une telle image radiologique peut faire évoquer une tumeur comme un hémangiome, un myélome, un lipome ou une lésion inflammatoire. L’attitude raisonnable semble être une surveillance radiologique rapprochée, au moins initialement. Certains préconisent une biopsie à l’aiguille mais elle comporte un nombre de faux positifs et de faux négatifs non négligeable qui rend son intérêt discutable. Sur le plan histologique, l’os trabéculaire en périphérie est normal, parfois plus dense. Parfois, entre les travées osseuses, on observe des cellules claires évoquant plus ou moins du tissu graisseux. Ces cellules forment parfois des ensembles microkystiques éosinophiles. La lésion centrale a les mêmes caractéristiques que les vestiges notochordaux (EP) ou même les chordomes avec en particulier des cellules physaliphores. Mais, à l’inverse des chordomes, il n’y a, d’une part, aucune matrice myxoïde intercellulaire, d’autre part, aucune anomalie évoquant une agressivité tumorale, encore moins une malignité : pas de mitose, pas de nécrose, pas de
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Tableau 4 Les principales caractéristiques des benign notochordal cell tumor (BNCT). The principal characteristics of benign notochordal cell tumor (BNCT). Radios standards
Sclérose ou rien
Scanner
Sclérose avec densification Pas de destruction osseuse ni de rupture corticale Hyposignal en T1, hypersignal en T2 Pas de prise de contraste, pas d’extension vers les tissus mous Cellules vacuolées et éosinophiles Pas de lobule ; pas de matrice myxoide ; pas de figures de mitoses Parfois éléments de moelle osseuse incluse Positivité : S100, vimentine, cytokératine, EMA, brachyurie
IRM
Histologie
pleïomorphisme. Les champs sont uniformes sans variation d’un secteur à l’autre. En immuno-histochimie, les BNCT sont positives pour les cytokératines, la brachyurie le CAM, l’EMA le S100 et la vimentine comme le sont les chordomes classiques. Ces différences histopathologiques et immuno-histochimiques ont été précisées notamment par Yamaguchi et al. [90]. Certaines publications contestent néanmoins ces données, en particulier la positivité aux cytokératines de haut poids moléculaire, 18 et 19 [94,95]. Finalement, entre la notochorde et le chordome, existent plusieurs formes intermédiaires : les vestiges notochordaux (EP) résidus a priori inactifs et non évolutifs, les chordomes intraduraux (CH ID) et les tumeurs bénignes à cellules notochordales (BNCT), éléments pathologiques plus ou moins évolutifs, d’allure bénigne mais qui pourraient être des formes précurseurs du véritable chordome. Les principales caractéristiques des BNCT sont résumées dans le Tableau 4. 4.4. Chordomes extra-axiaux, parachordomes, chordoma periphericum Des tumeurs ayant des caractéristiques proches du chordome, mais localisées en dehors de l’axe de la notochorde (du coccyx à la base du crâne), ont été rapportées sous différentes dénominations depuis 1955. À cette date, Laskowski [96] décrit 5 cas auxquels il donne le nom de chordoma periphericum. Dabska [97] en 1977 rapporte 10 cas, incluant ceux de Laskowski et utilise le terme de parachordome qui sera ensuite le terme le plus souvent utilisé. En 1993, Ishida et al. [98] publient un cas localisé au mollet chez une femme de 19 ans et colligent 11 cas dans la littérature. Van Akkooi et al. [99] décrivent un cas de la paroi thoracique chez une femme de 56 ans qu’ils ajoutent aux 36 cas déjà publiés. Enfin la dernière revue de littérature, effectuée par Clabeaux et al. [100] en 2008, colligeaient 45 cas (20 femmes, 25 hommes âgés de 4 à 86 ans–moyenne 35 ans). Les localisations les plus fréquemment observées étaient les membres inférieurs (51 %) suivis par les membres supérieurs (27 %) et le tronc, c’est-à-dire le thorax, l’abdomen et le pelvis (19,5 %). La plupart des localisations étaient osseuses mais les localisations aux parties molles et aux organes sont loin d’être rares. On peut ainsi mentionner : le poumon [101–104] ; le médiastin postérieur [105–107], la séreuse gastrique [108] ou les tissus pelviens au contact du pubis [109]. Sebag et al. [110] rapportent un cas chez un garc¸on de 6 ans, localisé aux foramens intervertébraux L2-L3 et L3-L4 se présentant comme une masse en sablier avec élargissement des foramens mais sans envahissement ni lyse osseuse. Un chordome localisé à l’intérieur d’un tératome cystique mature de l’ovaire a également été rapporté [111]. Un autre cas de tératome de l’ovaire contenant un segment de colonne vertébrale incluant des résidus notochordaux avait été publié en 1940 par Riopelle [112]. Pour les membres, à côté des localisations osseuses ont été décrits
11
des parachordomes du mollet [98,113,114], du muscle fessier [115], des muscles péri-scapulaires [116], et du poignet [117]. Un autre de ces parachordomes extraosseux est très particulier. Il s’agissait d’une femme de 67 ans présentant une masse développée le long du nerf médian, depuis le poignet jusqu’au-dessus du coude, ayant rapidement grossi pendant les 6 derniers mois, et étant associée à des métastases ganglionnaires axillaires. La patiente a accepté une désarticulation du bras après une chimiothérapie mal tolérée et inefficace. Le suivi à 20 mois est sans nouvel élément [551]. Ces parachordomes sont réputés pour avoir une évolution bénigne, en particulier après exérèse complète. La plupart des auteurs ne recommandent d’ailleurs pas de radiothérapie complémentaire lorsque l’exérèse est estimée complète. Néanmoins, d’une part, le suivi des patients est souvent court ; d’autre part, sur les 45 cas répertoriés par Clabeaux et al., on observe 9 récidives dans un délai variant de 3 mois à 12 ans, et 5 cas compliqués de métastases : parachordome de la jambe avec métastase pulmonaire [118] ; lésion de la fesse avec métastase sur le muscle fessier à distance de la lésion initiale [115] ; parachordome de la paroi thoracique avec métastase ganglionnaire [119] ; parachordome du mollet avec métastases multiples [113] et parachordome du mollet avec métastase pulmonaire et cérébrale [114]. Tirabosco et al. [120] reprennent une série de 12 cas qu’ils considèrent comme étant d’authentiques chordomes extra-axiaux car positifs à la brachyurie, et parmi lesquels on observe 3 récidives qui, toutes, correspondent à des exérèses par morcellement et incomplètes (Fig. 8). L’aspect macroscopique, tel qu’il est décrit dans les articles précédemment cités est très similaire à celui des chordomes. Il s’agit de masses plurilobées, généralement bien circonscrites mais pas encapsulées, plus ou moins grisâtres et dont le contenu est plutôt mou voire gélatineux. En imagerie, l’aspect est là encore voisin de celui du chordome avec souvent une prise de contraste. Lorsque le parachordome est développé à partir de l’os, il est invasif avec effraction de la corticale et extension vers les parties molles. Sur le plan histologique, sont le plus souvent décrits deux types de cellules : des cellules à cytoplasme éosinophile et des cellules en fuseau. Elles présentent toutes deux des vacuoles souvent volumineuses, très similaires aux cellules physaliphores. Une matrice myxoide est souvent présente. En revanche, on observe rarement de nécrose ou d’anomalies cytonucléaires. Sur le plan immunohistochimique, les disparités entre les différents cas sont très importantes. Certains sont positifs pour les cytokératines, d’autres ne le sont pas, si bien que pour certains, les parachordomes se rapprocheraient plus des tumeurs chondroides (chondrosarcomes myxoïdes) et pour d’autres des tumeurs chordoïdes (chordoïd sarcomas). Certains auteurs considèrent qu’il s’agit d’authentiques chordomes extra-axiaux, voire de tumeurs bénignes à cellules notochordales (BNCT). Kikuchi et al. [104] rapportent deux cas de tumeurs asymptomatiques localisées au niveau du poumon et stables dans le temps, dont l’une sur une période de plus de 8 ans, qui seraient des BNCT. Le problème selon lui est qu’une BNCT de siège osseux a des critères radiologiques qu’on ne peut bien sûr pas retrouver sur une tumeur des parties molles ; dans ce cas, seul l’aspect histologique comme l’absence de matrice myxoide permettrait ce diagnostic. Néanmoins la positivité en immuno-histochimie à la brachyurie, découverte récemment, semble être un argument majeur sinon définitif en faveur d’une lésion d’origine chordale : chordome ou BNCT (cf le chapitre sur la brachyurie). Les deux cas de Kikuchi et al. sont positifs pour la brachyurie. Sur ce critère, Tirabosco et al. [120] ne recensent en 2008 que 10 cas de parachordomes positifs à la brachyurie dont 8 osseux et 2 des parties molles. En définitive, il existe un certain nombre de tumeurs des os ou des parties molles similaires aux chordomes sur le plan macroscopique
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 12
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 8. CH extra-axial intramusculaire. Extra-axial chordomas: intramuscular. D’après Clabeaux et al. [100] ; publié avec l’autorisation de Springer.
et microscopique. Certaines sont positives à la brachyurie et en général aussi à la cytokératine 19, et seraient donc d’authentiques chordomes (ou BNCT) ; les autres seraient à classer avec les parachordomes, entité reconnue par l’OMS, et regroupées avec les tumeurs mixtes ou les myoépithéliomes des tissus mous depuis 2002 [121]. Ce type de tumeur est proche des tumeurs des glandes salivaires (pleiomorphic adenoma). Il s’agit d’un groupe hétérogène présentant des aspects variés, positif aux cytokératines de petit poids moléculaire et au S100 mais négatif aux cytokératines 18,19 et 20. Bien entendu, il faut aussi avoir éliminé la possibilité d’une métastase d’un chordome en localisation axiale ou celle d’un carcinome (cancer du rein ou mélanome par exemple) par un bilan radiologique et un PET scan (Tableau 5). 5. Meningiome et gliome chordoïdes 5.1. Les meningiomes chordoïdes Ils correspondent à une forme rare de méningiomes dans laquelle on retrouve une infiltration lympho-plasmocytaire avec des contingents plus ou moins importants très proches du chordome. C’est une variété qui semble avoir été décrite en 1977 par Eimoto et Hashimoto [122] sous le terme de méningiome vacuolé puis, par Dahmen [123] sous le terme de méningiome myxoïde. Mais c’est Connors [124], en 1980, qui a attiré l’attention sur ce type de méningiome. Le cas qu’il a rapporté a été discuté entre les pathologistes de l’université de Californie, favorables au diagnostic de chordome, et ceux de l’Armed Forces Institute, favorables au diagnostic de méningiome angioblastique. C’est Kepes et al. [125] en 1988 qui introduisit le terme de méningiome chordoïde en décrivant 7 cas (incluant d’ailleurs celui de Connors). L’OMS a introduit en 1993 cette variété dans sa classification des méningiomes en lui attribuant un grade II, donc intermédiaire, du fait non pas tant d’aspects atypiques cytonucléaires, que de la prédisposition supposée à récidiver. Cette variété est rare. Seuls 19 cas sur une série de 1663 méningiomes (1,1 %) ont été observés à Lariboisière sur une période de 20 ans (1991–2011). Elle représente de 0,5 à 1 % de
tous les méningiomes des trois grandes séries publiées [125–127]. Le premier rapporte la série de la Mayo Clinic avec 42 cas, Epari et al. celle de New Dehli avec 12 cas. La troisième série, la première à avoir été publiée, est celle de Kepes avec 7 cas. Dans cette série, essentiellement pédiatrique, le méningiome est dans tous les cas associé à un syndrome de Castleman ou au moins à un syndrome inflammatoire avec une anémie. Le syndrome de Castleman est un syndrome inflammatoire avec prolifération lymphoïde associant fièvre, anémie microcytaire hypochrome, hépatosplénomégalie, dysgammaglobulinémie et retard de développement somatique et sexuel. Civit et al. [128] en publient un cas similaire en 1998, et insiste sur l’association du méningiome à ce syndrome inflammatoire, et à un œdème important et même à un infiltrat inflammatoire péritumoral. Il souligne sa disparition après l’exérèse du méningiome. Dans un des cas de Kepes, ce syndrome inflammatoire a pu réapparaître lors d’une récidive. Cette notion d’association à un syndrome inflammatoire ne semble être fréquente que dans la population pédiatrique. Les séries ultérieures composées surtout d’adultes ne comportent quasiment jamais de signes inflammatoires associés. Kozler et al. [129] reprennent 92 cas dans la littérature qui comptent 90 % d’adultes ; 7 autres cas pédiatriques ont été publiés après ceux de Kepes et seulement 2 cas sur les 85 publiés après Kepes présentent un syndrome de Castleman. Ces méningiomes chordoïdes (Fig. 9) sont dans 81,5 % supratentoriels, et plutôt de la convexité proche de la ligne médiane. Mais ont été publiés pratiquement toutes les localisations possibles : ventricule latéral [130], troisième et quatrième ventricule [131], foramen magnum, foramen jugulaire, orbite [132], tente, angle pontocérébelleux, cervical et même intraparenchymateux [133,134] et un cas au niveau du poumon [135]. Ce type de méningiome s’observe dans une population plus jeune que celle des méningiomes classiques : 47,4 ans (12 à 77 ans) pour Couce et al. et 32,4 ans (12 à 67 ans) pour Epari et al. Kozler et al. indiquent une proportion d’enfants de moins de 18 ans de 8,2 %. Le sexe est à peu près également réparti sauf en pédiatrie où le taux est de 2 pour 1 en faveur des filles. Sur les 9 cas rassemblés par Civit et al., la moyenne d’âge est de 13,8 ans avec 6 filles et 3 garc¸ons.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
13
Tableau 5 Chordomes et entités notochordales. Chordomas and notochordal entities. Entité
Localisation
Symptomatologie la plus fréquente
Taille
IRM TDM
Histologie
Évolutivité
EP
Intradurale Prépontique
Aucune
< 2 cm
Prépontique (56 %) Suprasellaire : 19 % Pré-médullaire : 19 % Latéraux : 6 % Intra-osseux
F (localisation)
> 2 cm
Matrice myxoïde = 0 Ki 67 : nul Brachyurie = + Matrice myxoïde + Ki 67 : faible Brachyurie = +
Nulle (?)
CH ID
Prise de contraste = 0 Tractus le rattachant au clivus (3/5) Prise de contraste +
Aucune
Petite
Prise de contraste = 0 Lyse osseuse = 0
Faible ou nulle
CH extra-axial Parachordome
Os et tissus mous
Masse + douleur
Variable
Prise de contraste = +
Os et tissus mous
Masse + douleur
Variable
Prise de contraste = +
Chordome
Os et extension extraosseuse
F (localisation)
> 5 cm
Prise de contraste = + Lyse osseuse = +
Matrice myxoïde = 0 CytoK 18–19 = + Brachyurie = + CytoK 18–19 = + Brachyurie = + CytoK 18–19 = 0 Brachyurie = 0 Matrice myxoïde = + CytoK 18–19 = + Brachyurie = + Atypies cytonucléaires
BNCT
Le pronostic de ce type de méningiome serait donc plus mauvais que celui des formes classiques. Dans la série pédiatrique, 2 récidives à 2 ans ont été observées sur les 9 cas, dont une après exérèse totale. Dans la série de Couce et al. (n = 42), 2 patients sont décédés en postopératoire ; un autre après récidive et sur les 36 restants ayant un suivi connu, 14 soit 39 % ont récidivé entre 1,8 et 16 ans après exérèse. Toutes les exérèses incomplètes et une seule exérèse totale ont récidivé. L’index de prolifération dans cette série variait de 0,4 à 11,4 %. À l’inverse dans la série d’Epari et al. (n = 12) aucune récidive n’a été notée pour un suivi de 3 à 24 mois. L’index de prolifération est très variable selon les publications, de moins de 1 % [132] à 9 % [136]. Epari et al. [127] indiquent que tous ses patients ont un index inférieur à 2 % sauf 2 ayant un index à 6 et 8 %. En définitive, il est difficile d’affirmer que ce type de méningiomes a vraiment un plus fort taux de récidives que les méningiomes classiques. Comme pour ces derniers, une exérèse incomplète justifie une surveillance particulière. Enfin la différenciation de ce type de méningiomes par rapport aux autres types tumoraux ne devrait pas poser de problème. En immuno-histochimie, ils ne sont pas positifs ni pour la brachyurie,
Faible
Faible Faible Récidives Métastases
ni pour les cytokératines, et en général peu pour le S100, ce qui les séparent clairement des chordomes. En revanche, ils sont positifs pour la vimentine et l’EMA et négatifs pour la GFAP, ce qui les distingue des gliomes chordoïdes.
5.2. Le gliome chordoïde C’est une entité encore plus rare puisque, en 2012, on n’en trouve que 45 cas décrits dans la littérature. La première description a été faite par Wanschitz et al. [137] en 1995, et développée par Brat et al. [138] en 1998 qui introduit le terme de gliome chordoïde. Cette entité n’a été incorporée dans la classification de l’OMS qu’en 2000, et classée comme un gliome de grade II. Le gliome chordoïde s’observe le plus souvent chez une femme, d’âge moyen 45,2 ans [139,140]. Il est pratiquement toujours localisé au niveau du troisième ventricule et de l’hypothalamus, et se révèle donc en général par des signes liés à une hydrocéphalie, un diabète insipide, des troubles visuels, une léthargie et une ataxie. Son origine serait en fait l’épendyme de la lame terminale [141,142,566].
Fig. 9. Méningiome chordoïde de la région du foramen magnum (Lariboisière). Foramen magnum chordoid meningioma.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 14
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
En immuno-histochimie, on note une positivité pour l’EMA et le D2-40, une négativité des cytokératines et ce qui le caractérise le plus, une GFAP positive. Le coefficient de prolifération est généralement faible, autour de 1 %. Il est considéré comme une lésion de bas grade dont le pronostic n’est pas tant lié à son agressivité naturelle qu’à celle du traitement, en particulier chirurgical. Le traitement est en effet chirurgical pour la quasi-totalité des cas rapportés, mais avec une exérèse le plus souvent partielle justifiant parfois une radiochirurgie complémentaire.
6. Brachyurie La brachyurie est une protéine liée à un gène via un domaine spécifique appelé T box et correspondant au locus 6q27. Elle contrôle la production de protéines inconnues mais qui interfèrent dans les étapes précoces du développement embryonnaire et notamment de la notochorde. Une modification minime de sa structure peut induire une croissance de la queue de certains animaux, insuffisante (brachourie = queue courte, d’où son nom) ou absente (anourie). D’une fac¸on plus générale, c’est un facteur de transcription intranucléaire indispensable pour un développement correct, et la persistance de la notochorde et secondairement des somites. Une anomalie, par mutation par exemple, de la brachyurie entraîne donc des perturbations dans la formation de l’axe vertébral et du mésoderme postérieur dont les hémangioblastes. La brachyurie est aussi un promoteur de la transition épithélial-mésothélial observée dans la progression, et notamment l’apparition de métastases, de nombreux cancers. La brachyurie semble très spécifique des chordomes et apporte un élément décisif à l’hypothèse de l’origine notochordale des chordomes puisqu’elle est exprimée dans la notochorde normale. Une duplication du gène T dans la région 6q27 à l’origine de la brachyurie, a été retrouvée chez tous les membres porteurs de chordomes de quatre familles différentes [143,144]. La région 6q27 contient presque exclusivement le gène de la brachyurie. La brachyurie a été mise en évidence de fac¸on quasi constante dans tous les chordomes des quelques séries étudiées. Elle est très sensitive (au moins dans 90 % des cas) et de plus quasi spécifique (près de 100 % pour tous les auteurs) car elle n’est observée dans aucun autre type tumoral et notamment les tumeurs cartilagineuses. La seule exception notable et parfaitement compréhensible est représentée par l’hémangioblastome du système nerveux central. Vujovic et al. [145] ont testé 54 chordomes et 323 néoplasmes de divers types dont 163 tumeurs cartilagineuses et de plus 33 tissus normaux. La brachyurie était exprimée dans tous les chordomes sauf un qui n’exprimait pas non plus les cytokératines et fut donc reclassé chondrosarcome. Il est intéressant de noter que la brachyurie était détectée de fac¸on diffuse et homogène, ce qui fait penser qu’une biopsie, même de petit volume, permet de retrouver la brachyurie et de faire le diagnostic. De plus, la brachyurie (comme les cytokératines) était retrouvée dans tous les contingents quel qu’en soit le type. Ainsi, elle est positive dans les secteurs chondroides des chordomes chondroides et dans les secteurs différenciés des chordomes dédifférenciés. En revanche, les secteurs dédifférenciés (sarcomateux) n’expriment pas la brachyurie (ni les cytokératines). Les formes récidivantes (n = 4) et les métastases (n = 5) la fixent également. Inversement, aucune des autres tumeurs, y compris cartilagineuses, n’exprime la brachyurie. Elle n’est également pas détectée dans une grande variété de tissus normaux : cerveau, sein, articulation, cartilage, utérus, ovaire, vessie, rein, foie, poumon, ganglion lymphatique, nerf sciatique, peau, amygdale, thyroïde et glande salivaire. Enfin il est remarquable qu’elle ne soit pas présente dans le nucleus pulposus. En revanche, elle est retrouvée (avec les cytokératines) mais uniquement dans la notochorde chez un embryon de 6 à 8 semaines de gestation testé dans sa totalité.
Dans toutes les cellules où elle est trouvée positive, la fixation est intranucléaire comme il se doit pour un facteur de transcription. Le même auteur souligne l’intérêt d’autres marqueurs dont le CD 24 qui serait tout aussi spécifique du chordome. Inversement, le collagène X n’est pas détecté dans les chordomes, mais est trouvé présent dans toutes les tumeurs cartilagineuses. Ce gène est impliqué dans la calcification de la matrice cartilagineuse ce qui expliquerait la quasi-absence de calcifications dans les chordomes et leur grande fréquence dans les chondrosarcomes. De fac¸on plutôt curieuse, le collagène X est aussi retrouvé dans le nucleus pulposus bien connu lui aussi pour se calcifier. Le nucleus pulposus exprime également le CD 24, ce qui soulève à nouveau l’ambiguïté de son origine notochordale ou cartilagineuse. L’hypothèse serait donc que la brachyurie et la cytokératine s’exprimeraient dans la notochorde puis disparaîtraient au fur et à mesure de sa dégénérescence et de sa transformation cartilagineuse, y compris dans la structure ultime dérivée d’elle, le nucleus pulposus. Jambhekar et al. [146] ont étudié l’expression de la brachyurie dans 51 chordomes et 58 tumeurs diverses. Sa population tumorale provenait de quatre sources différentes, et a été observée sur une période de 10 ans. Tous les chordomes, sauf 5, étaient positifs. La négativité de ces 5 cas était expliquée par le fait qu’il s’agissait de matériel histologique ancien et sans doute mal conservé. Dans cette étude, la fixation était uniforme quel que soit le type de chordome. Inversement, aucune des 58 autres tumeurs n’exprimait la brachyurie. En parallèle, les cytokératines et l’EMA étaient positives pour tous les chordomes et le S100 pour 86 % d’entre eux. Oakley et al. [147] publient la seule étude dans laquelle la sensibilité de la brachyurie pour la détection des chordomes est légèrement prise en défaut. Ils analysent 79 chordomes dont 45 chondroides et 24 chondrosarcomes observés sur 38 ans (1969–2007). Pour eux, les cytokératines sont plus performantes que la brachyurie avec 97 % de sensibilité et 100 % de spécificité ; la brachyurie est aussi spécifique (100 %) mais un peu moins sensible (90 %). CD 24 est également très spécifique (100 %) mais très peu sensible (47 %). La combinaison la plus efficace est l’association cytokératine–brachyurie avec respectivement 98 et 100 % de sensibilité et de spécificité. Tirabosco et al. [120] s’intéressent aux chordomes extra-axiaux et ne trouvent ainsi que 10 parachordomes extra-axiaux (8 osseux et 2 des parties molles) positifs pour la brachyurie sur les 12 cas étudiés. Ils testent également 83 tissus normaux provenant de 11 organes différents et 340 tissus tumoraux dont 14 hémangioblastomes du système nerveux et 14 tumeurs testiculaires à cellules germinales. La brachyurie a été retrouvée positive dans tous les cas d’hémangioblastomes, dans 2 tumeurs testiculaires et dans 2 des 13 tissus testiculaires normaux. Aucun des autres tissus ni aucune autre tumeur n’exprimait la brachyurie. Ils en concluent que parmi les tumeurs extra-axiales macroet microscopiquement similaires au chordome, seuls doivent être dénommés chordomes extra-axiaux ceux qui fixent pour la brachyurie ; les autres font partie des parachordomes selon la définition de l’OMS. La publication de Kikuchi et al. [104] à propos de 2 chordomes extra-axiaux du poumon va dans le même sens. Les deux lésions rapportées sont asymptomatiques et sans progression ; l’un est resté stable pendant 8 ans avant d’être opéré. Les deux tumeurs fixent la brachyurie. Ils pensent qu’il s’agit dans les deux cas d’une tumeur bénigne à cellules notochordales (BNCT). En parallèle, ils testent 5 autres BNCT prises au hasard parmi les 34 cas publiés précédemment par la même équipe [85] qui se révèlent également positives. Confirmant ces données, Kyriakos [148] observe une réaction positive à la brachyurie dans un cas d’ecchordosis physaliphora (EP) et dans deux cas de BNCT. L’intérêt de la brachyurie pour l‘authentification de la notochorde et des lésions qui en sont dérivées (BNCT, chordomes axiaux et extra-axiaux) paraît donc évident.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
En revanche, Shen et al. [149] rapportent 6 cas de chordomes (sur une série de 46) associés à des résidus notochordaux (BNCT) avec brachyurie positive pour les chordomes et pas pour les BNCT. Pour expliquer la possibilité du développement d’authentiques chordomes extra-axiaux osseux ou des parties molles, Kikuchi et al. s’appuient sur une étude de Palena et al. [150] mettant en évidence non pas la brachyurie protéine, mais à l’état d’ARN messager, dans une variété de tissus adultes normaux. Théoriquement, un événement simple tel qu’une mutation suffirait donc pour que des cellules ayant une expression aberrante des gènes de la brachyurie se transforment en cellules de chordomes. Toutes ces données sur la brachyurie étayent l’hypothèse de l’origine des chordomes à partir de la notochorde et des BNCT. Pour Kikuchi et al., le diagnostic de BNCT dans l’os peut se faire sur des données radiologiques et histologiques, mais pas au niveau des tissus mous où la brachyurie est indispensable. Enfin une autre étude [151] a recherché l’expression de la brachyurie dans un des diagnostics différentiels du chordome : le cancer du rein à cellules claires ; 184 carcinomes du rein, 111 tumeurs germinales et 30 tissus testiculaires normaux ou néoplasiques ont été analysés. Aucune de ces différentes tumeurs n’était positive alors que les 12 chordomes testés l’étaient. La brachyurie serait donc le marqueur idéal pour authentifier la lignée notochordale jusqu’à sa disparition chez l’embryon ; elle ne s’exprimerait après la naissance que dans les vestiges (EP), les BNCT et les chordomes. La disparition in utero des cellules notochordales, avec transformation cartilagineuse aboutissant au nucleus pulposus, expliquerait ainsi celle de la brachyurie. Sa sensibilité, encore accrue si elle est couplée à la cytokératine, et sa spécificité sont pratiquement de 100 % si on excepte les hémangioblastomes et quelques tumeurs germinales. Outre son utilité diagnostique, la brachyurie pourrait avoir un intérêt thérapeutique car elle aurait un rôle dans la prolifération et la croissance tumorale des chordomes. Deux études [152,153] ont montré qu’à l’aide d’inhibiteurs de la brachyurie, on pouvait induire un arrêt de la croissance de chordomes sur des lignées cellulaires (JHC7 et U-CH1) chez la souris, les cellules prenant un aspect de sénescence. On conc¸oit les possibilités qu’aurait un inhibiteur de la brachyurie utilisable en clinique humaine. 7. Anatomopathologie (M. Polivka, A. Cazorla, H. Adle-Biassette)
15
Fig. 10. Sur le plan macroscopique, les chordomes sont en général lobulé, gélatineux avec parfois des secteurs plus fermes d’aspect cartilagineux. On macroscopic examination, chrodoma are multilobulated gelatinous and soft mass. The regions that contain cartilage are more firm.
Fig. 11. Tumeur d’architecture lobulée, comportant des septa. Lobular arrangement of tumor cells containing fibrous septa.
Définition selon l’OMS : « les chordomes sont des tumeurs malignes présentant une différenciation notochordale ». Macroscopie : tumeur généralement lobulée, de consistance molle gélatineuse avec parfois des secteurs plus fermes de consistance cartilagineuse, de couleur grisâtre ou blanc-bleuté mais il peut y avoir des remaniements hémorragiques, récents ou anciens d’aspect ocre (Fig. 10). Les lobules tumoraux peuvent être bien délimités quand la tumeur envahit les tissus mous, les limites sont souvent plus indistinctes dans l’os lui-même. En cas de rupture corticale, la tumeur reste souvent recouverte par le périoste. Ceci vaut surtout pour les tumeurs sacrées qui sont enlevées en bloc, les localisations cervicales et de la base sont le plus souvent très morcelées. Histologie : classification OMS, 2013. 7.1. Chordome classique La tumeur est d’architecture lobulée, les lobules tumoraux sont séparés par des septas fibrovasculaires (Fig. 11). Les cellules tumorales sont de grande taille, à cytoplasme bien délimité, éosinophile homogène (Fig. 12) ou clarifiées (Fig. 13), contenant une ou plusieurs vacuoles optiquement vides refoulant le noyau, déformant
Fig. 12. Les cellules tumorales de grande taille, bien délimité, au cytoplasme éosinophile homogène, disposées en travées parfois anastomosés sur un fond myxoïde. Neoplastic eosinophilic large cells disposed in solid sheets or irregular intersecting cord in a stroma containing myxoid matrix.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 16
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 13. Cellules tumorales clarifiées, contenant une ou plusieurs vacuoles optiquement vides refoulant le noyau. Noter la présence d’un infiltrat inflammatoire localisé au niveau du septa. Large tumoral cells, with vaculolated cytoplasm containing mucin, called physaliphorous cells.
Fig. 14. Cellules physaliphore caractéristique comportant des vacuoles intracytoplasmiques multiples. Higher magnification of physaliphorous cells.
Fig. 15. Matrice myxoïde mise en évidence par la coloration de bleu alcian. Mucinous matrix stained by alcian blue.
Fig. 16. Anisocaryose marquée avec présence de cellules de grande taille aux noyaux monstrueux et hyperchromatiques. Noter la présence d’une mitose (flèche), et des poussières nucléaires témoignant de l’aopoptose. Anaplastic features may be present, such as hyperchromatic and atypical nuclei and mitosis (arrow). Note the presence of nuclear dust suggestive of apoptosis.
parfois le cytoplasme réalisant l’aspect de cellule physaliphore (Fig. 14) (« portant des bulles ») ou de cellule araignée (le cytoplasme entre les vacuoles étant étiré comme les pattes de ce charmant animal). Ces cellules sont groupées en amas cohésifs de taille variable (Fig. 10 et 11), ou forment des travées monocellulaires, ou des cellules isolées, sur une matrice myxoïde (Fig. 12, 13 et 15) d’abondance très variable d’un lobule tumoral à l’autre au sein de la même tumeur. Les noyaux ont une taille et un contour variable, là aussi au sein d’une même tumeur, voire d’un même lobule : petits et grossièrement arrondis, souvent de contour un peu irrégulier, parfois de grande taille polylobés, voire monstrueux et hyperchromatiques (Fig. 16). Des nucléoles sont parfois présents. Des mitoses (Fig. 16), et des remaniements inflammatoires (Fig. 10 et 17), hémorragiques ou nécrotiques (Fig. 18 et 19), parfois extensifs, et de l’aopoptose (Fig. 16–19) peuvent être observés. 7.2. Chordome chondroïde La matrice a un aspect chondroïde (Fig. 20), soit de fac¸on focale associée à des secteurs myxoïdes, soit très rarement dans l’ensemble de
Fig. 17. Remaniements inflammatoires lymphohistiocytaires massifs infiltrant la tumeur, surtout au niveau des septas. Lymphohistiocytic infiltrates of the tumor.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 18. Chordome comportant des foyers de nécrose (N) et des noyaux apoptotiques. Necrosis (N) and nuclear dust.
17
Fig. 21. Contingent cellulaire indifférencié, fusiforme d’aspect sarcomateux. Malignant chordoma showing sarcomatous features.
Fig. 22. Même plage que la Fig. 12 marquée avec l’anticorps anti-KL1 Parallel section of Fig. 12 showing KL1 immunopositivity. Fig. 19. Chordome comportant des foyers de nécrose (N) et des noyaux apoptotiques. Necrosis (N) and nuclear dust.
la tumeur. Cette forme à été considérée comme de meilleur pronostic, mais ceci ne semble pas confirmé actuellement : il semble bien que cette différence pronostique soit en fait liée à une confusion avec le chondrosarcome avant l’ère de l’immuno-histochimie. Le diagnostic différentiel est en effet très difficile sur la seule morphologie s’il n’y a pas de cellule physaliphore dans la lésion, ce qui peut arriver.
7.3. Chordome dédifférencié
Fig. 20. Chordome comportant une matrice purement chondroïde Chondroid chordoma containg cartilaginous matrix.
Par définition, c’est une tumeur biphasique comportant des secteurs de chordome bien reconnaissable et des secteurs de haut grade, soit indifférencié à cellules fusiforme soit sarcomateux (Fig. 21 et 22). Les deux composants peuvent être bien démarqués les uns des autres, soit il peut exister une transition progressive entre eux. Ils sont plus fréquents au niveau sacrococcygien ; ils représenteraient jusqu’à 9 % des chordomes. Ils surviennent le plus souvent au cours de l’évolution d’un chordome connu, soit spontanément soit après une irradiation, avec alors un délai assez coût de 3 à 5 ans, les différenciant d’une 2e tumeur radio-induite.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 18
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 23. L’anticorps anti-KL1 marque les cellules tumorale fusiformes et physaliphores. KL1 antibody stains physlipfhorus and spindle cells.
Fig. 24. Immunomarquage anti-Ki67 mettant en évidence un index de prolifération évalué à 40 %. Ki67 proliferative index greater than 40 %.
7.4. Immuno-histochimie Classiquement, le chordome est la seule tumeur qui présente une positivité pour les marqueurs épithéliaux, conjonctifs et par la protéine S100. Les pan-cytokératines (Fig. 22 et 23) et la cytokératine 19, l’EMA (epithelial-membrane antigen) et la vimentine sont quasi constamment exprimés, mais parfois seulement de fac¸on focale, ce qui peut poser problème sur une petite biopsie. Brachyurie [145] est un marqueur plus récent, très spécifique du chordome, bien qu’il soit aussi exprimé par les hémangioblastomes et certaines tumeurs testiculaires. Sa sensibilité est élevée, estimée à 90,2 % dans une étude de 51 chordomes [146], mais l’immunoréactivité peut être perdue après décalcification, comme cela est fréquent dans les marquages nucléaires. Dans les formes dédifférenciées, ces différents marquages sont perdus [145,146] : le diagnostic repose sur la coexistence de secteurs de chordome reconnaissable, ou sur l’histoire clinique. D’autres anticorps peuvent être utiles au diagnostic différentiel, ils seront vus à ce propos. 7.5. Facteurs pronostiques
Fig. 25. Tumeur bénigne à cellules notochordales : les cellules comportent un cytoplasme clair un noyau rond et central, petit sans atypie. Absence de matrice myxoïde. Benign notochordal cell tumor: tumoral cells with clear cytoplasms, small round nuclei, without myxoid matrix.
Les facteurs cliniques semblent les plus importants, déterminant la possibilité d’une exérèse carcinologique [154]. Différents éléments histopronostiques ont été proposés, mais n’ont pas à ce jour donnés de résultat probant, en dehors de l’aspect dédifférencié qui est associé à un pronostic plus péjoratif. Une étude [155] a montré une corrélation entre le temps de doublement tumoral déterminé en imagerie et à la fois l’existence de mitoses et un index de marquage supérieur à 6 % avec le Ki67, protéine nucléaire exprimée par les cellules en cycle de synthèse de l’ADN. Cependant, on constate une très grande hétérogénéité du marquage au sein d’une même tumeur (Fig. 24), et il n’est pas clair s’il faut tenir compte des zones de marquage maximal ou de la moyenne ; et se pose le problème de la représentativité des prélèvements en cas de biopsie. Le marquage est en outre perdu ou fortement diminué après décalcification. 7.6. Diagnostic différentiel 7.6.1. Tumeur bénigne à cellules notochordales Cette entité a aussi été appelée : restes notochordaux, hamartome notochordal, ecchordosis physalyphora. Bien que l’origine en reste controversée, ces entités sont actuellement regroupées ; les
Fig. 26. Tumeur bénigne à cellules notochordales : immunomarquage antiKL1 positif. Benign notochordal cell tumor showing KL1 immunopositivity.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 27. Méningiome chordoïde comportant des travées et des cordons de cellules éosinophiles souvent vacuolisées sur un fond myxoïde. Chordoid meningioma ressembling chordoma.
localisations préférentielles se superposent à celle du chordome. Des observations de TBCN située au contact d’un chordome suggèrent qu’il pourrait s’agir d’une forme bénigne de chordome [93]. Histologiquement, le diagnostic en est difficile sans notion clinique (Fig. 25 et 26). Les cellules ressemblent en effet aux adipocytes de la moelle, avec un cytoplasme clair généralement pourvu d’une seule grosse vacuole optiquement vide ; la position du noyau seule attire l’attention : il n’est pas constamment refoulé en bordure de la cellule comme dans un adipocyte, mais est souvent rond et central, petit sans aucune atypie. Quelques cellules peuvent ne pas avoir de vacuole, le cytoplasme est alors éosinophile. Les éléments forment des plages cellulaires sans aspect lobulé ni matrice myxoïde ; les travées osseuses sont raréfiées dans la lésion, parfois épaissies au pourtour. Des éléments hématopoïétiques peuvent être inclus dans la lésion. Le diagnostic repose sur l’immuno-histochimie : Cytokératine KL1 (Fig. 26), EMA et brachyurie (la S100 étant exprimée par les adipocytes) [86] (OMS, 2013). 7.6.2. Chondrosarcome En situation médiane, le diagnostic peut être difficile, notamment dans le cas des chondrosarcomes de grade 2 qui ont souvent des remaniements myxoïdes : là aussi, c’est l’immuno-histochimie qui tranchera, les chondrosarcomes n’exprimant pas les marqueurs épithéliaux ni brachyurie [147]. 7.6.3. Méningiome chordoïde Le diagnostic différentiel se pose surtout devant des localisations particulières, en effet, des chordomes intraduraux ont été décrits. Le méningiome chordoïde est fait de travées et de cordons de cellules éosinophiles souvent vacuolisées sur un fond myxoïde, dont l’aspect est très proche d’un chordome (Fig. 27 et 28). Cependant, cet aspect est rarement isolé, et le plus souvent ces zones sont dispersées au sein d’un méningiome de morphologie plus typique [156]. Ce type de méningiome est de grade 2 de l’OMS en raison de son risque élevé de récidive. Le diagnostic repose sur la recherche de l’expression de brachyurie, car les méningiomes expriment EMA et vimentine de fac¸on très constante, et fréquemment S100 et cytokératine [136]. 7.6.4. Métastase de carcinome et extension de cancer de voisinage La métastase osseuse d’un cancer rénal à cellules claires peut ressembler à un chordome, cependant le caractère hémorragique
19
Fig. 28. Méningiome chordoïde marqué avec un anti-récepteurs à progestérone. Chordoid meningioma showing progesterone receptor expression.
Fig. 29. Gliome chordoïde comportant des travées de cellules épithélioïdes sur un fond myxoïde. Chordoid glioma composed of cords of epithelioid cells separated by a myxoid background.
alerte généralement le chirurgien dès l’intervention ! Mais, rarement, un chordome peut être richement vascularisé. D’autres cancers peuvent avoir un contingent de cellules claires, notamment des cancers pulmonaires, ovariens, salivaires. En l’absence de notion d’une telle tumeur primitive, le diagnostic morphologique peut être difficile. L’extension d’une tumeur de voisinage peut également poser un problème difficile, surtout en localisation sacrée où le chordome peut envahir largement les structures de voisinage au moment du diagnostic, notamment le rectum. En cas de doute, c’est l’immuno-histochimie qui tranchera, les carcinomes n’exprimant généralement pas la S100 (on se rappellera que les cancers du rein et du poumon expriment la vimentine), et pas brachyurie [151]. 7.6.5. Gliome chordoïde Le problème est un peu théorique, cette tumeur siégeant électivement dans le 3e ventricule. La morphologie de ce gliome de bas grade est cependant trompeuse, réalisant des travées de cellules épithélioïdes, mais non vacuolisées, sur un fond myxoïde, avec souvent une inflammation par des éléments mononucléés (lymphocytes et plasmocytes) au contact.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
20
Fig. 30. Gliome chordoïde marqué avec l’anticorps anti-GFAP. Chordoid glioma immunostained by GFAP.
Fig. 32. Parachordome : cellules isolées, parfois vaculolisées sur un fond myxoïde. Parachordoma: isolated cells, sometime containg vacuoles within an abuundant myxoid extracellular matrix.
myoépithéliales, appelées également tumeurs mixtes ou tumeur chondromyxoïdes ectomésenchymateuses. Elles sont observées surtout dans les membres et les ceintures, plus rarement dans le tronc, la tête et le cou, plus souvent en sous-cutané que dans les tissus mous profonds. Elles sont de morphologie très pléomorphe, comme les tumeurs salivaires dont elles sont le pendant. Certaines ont des cellules épithélioïdes vacuolisées qui leur ont fait donner autrefois le nom de parachordome (Fig. 32). Comme le chordome, ces cellules expriment cytokératines, EMA et S100, mais n’expriment pas brachyurie ; environ 50 % expriment GFAP, comme de nombreuses tumeurs salivaires [161]. 7.7. Travaux en cours
Fig. 31. Épendymome myxopapillaire. Myxopapillary ependymoma.
La positivité de la GFAP fera le diagnostic, cet anticorps étant négatif dans le chordome. Il faut noter que le gliome chordoïde peut exprimer l’EMA [138,157] (Fig. 29 et 30). 7.6.6. Épendymome myxopapillaire Des localisations sous-cutanées de la région sacrococcygienne, présacrées et intra-sacrées peuvent se développer à partir de reliquats ectopiques d’épendyme. L’architecture papillaire, la vascularisation par de nombreux vaisseaux à paroi hyaline, l’aspect des cellules qui présentent des pieds vasculaires fibrillaires permet de penser au diagnostic qui sera confirmé par l’immuno-histochimie : positivité de la GFAP, négativité des cytokératines et de brachyurie [158,159] (Fig. 31). 7.6.7. À part : myoépithéliome/parachordome Il s’agit d’une entité un peu complexe pour des raisons historiques. Des chordomes ectopiques des tissus mous ont été décrits initialement sous le terme de chordoma periphericum en 1951 par Laskowski [96], puis ont été dénommés parachordome en 1977 par Dabska [97]. Les progrès de l’immuno-histochimie les ont ensuite démembrés : s’il existe d’authentiques chordomes des tissus mous, confirmés par le marquage avec brachyurie [160], ces lésions sont exceptionnelles, et la plupart des lésions des tissus mous ayant une morphologie de chordome sont en fait des tumeurs
Les chordomes primitifs et les récidives de 90 patients ont été revus à l’hôpital Lariboisière. Elles ont été classées sur le plan morphologique en tenant compte de l’architecture de la tumeur, de la différenciation y compris la présence d’un contingent peu différencié ou sarcomateux, du type de la matrice (chondroïde, myxoïde, mixte), des atypies cytonucléaires, du nombre de mitose, de la nécrose, d’une hémorragie et de l’inflammation. Les sous-types histologiques de 168 chordomes provenant de 86 patients primaires ou en récidive ont été analysés ; les chordomes récidivants conservaient globalement des formes histologiques comparables aux tumeurs primitives. Les sous-types histologiques étaient composés de 57,1 % de chordomes classiques avec prédominance nette du contingent myxoïde, 6,5 % de chordomes chondroïdes, 29,8 % de type mixte et 6,5 % de formes peu différenciées. Les tumeurs ont par la suite été étudiées par la méthode de TMA (Tissue MicroArray) pour la mise en évidence des facteurs pronostiques et des cascades moléculaires pouvant être la cible de thérapeutiques spécifiques. Nous avons tout d’abord utilisé les méthodes immuno-histochimiques, pour étudier l’index de prolifération (Ki67), l’accumulation de la protéine p53, et l’expression de l’EGFR, du STAT 3p, du VEGF et de la voie mTOR/PI3K. En parallèle, des études moléculaires visant à étudier les mutations d’EGFR et du p53 ont débuté. L’analyse des données ainsi que les corrélations histo-moléculaires avec les données cliniques sont en cours. Les résultats préliminaires montrent que les chordomes non récidivants ont un index de prolifération positif pour la moitié des patients évalué en moyenne de 7,2 %, et des écart-types très élevés. Pour ce qui concerne les tumeurs avec reprise évolutive et/ou les récidives locales et/ou à distance l’index est positif chez 70 % des patients, évalué en moyenne à 11,6 % avec des chiffres très variables.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
21
Fig. 33. Coupe TDM avec injection en axiale (A) et reconstructions sagittale médiane (B). Chordome lytique du clivus et du corps du sphénoïde. Calcifications centrales qui dans ce cas semblent correspondre à des fragments osseux résiduels au sein de la tumeur (flèches). Noter le refoulement de l’hypophyse normale en haut (tête de flèche). CT scanner axial (A) and sagittal (B) reconstruction slices: Osteolytic clival chordoma of the clivus and sphenoidal bone. Calcifications looking more like residual bony fragments inside the tumor (arrows). Notice the upwards shift of the normal pituitary gland (arrow head).
Il existe une expression de l’EGFR très variable d’un patient à un autre, chez plus de la moitié des patients. La recherche de mutation d’EGFR sur 1/3 des patients testés à ce jour selon la technique de pyroséquenc¸age n’a pas mis en évidence de mutation. 8. Radiologie–examens isotopiques 8.1. Imagerie radiologique (J.-P. Guichard) La TDM et l’IRM sont complémentaires au diagnostic et au bilan d’extension préthérapeutique des chordomes. 8.1.1. Chordomes du clivus Ils représentent en fréquence la deuxième localisation des chordomes [56,162]. 8.1.1.1. TDM. La TDM en reconstruction osseuse haute définition est essentielle pour déterminer l’extension intra-osseuse
(Fig. 33 et 34). Grâce aux acquisitions millimétriques il est possible d’obtenir des reconstructions multiplanaires de bonne qualité qui facilitent le bilan d’extension à la base du crâne. La lésion est le plus souvent centrée sur le clivus, médiane, proche de la synchondrose sphéno-occipitale ou sur le tiers supérieur ou inférieur du clivus [163]. La tumeur est expansive et ostéolytique détruisant les travées osseuses et les corticales. Elle est bien limitée, sans condensation osseuse périphérique. Elle est parfois calcifiée mais la nature de ces calcifications n’est pas univoque. Elles correspondent plus souvent à des fragments osseux résiduels au sein du chordome qu’à des calcifications de la matrice du chordome. Ces calcifications dystrophiques intratumorales seraient plus évocatrices de la forme chondroïde. En reconstruction parenchymateuse, la TDM est moins performante que l’IRM pour fixer les limites extraosseuses de la tumeur. Le chordome est globalement hypodense ou isodense par rapport au parenchyme adjacent. La densité est souvent hétérogène avec des zones tissulaires isodenses délimitant des zones
Fig. 34. Coupe axiale d’angio-TDM en reconstruction osseuse (A) et parenchymateuse (B). Lyse du clivus avec extension vers le sphénoïde et le canal carotidien (tête de flèche). La tumeur est au contact de la carotide interne qui est de calibre normal (flèche). AngioCT scanner axial view with bone (A) and parenchymal (B) windows. Osteolysis of the clivus with tumoral extension towards the sphenoidal bone and carotid artery canal (arrow head). Tumor is in contact with the internal carotid artery without stenosis (arrow).
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 22
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 35. Coupe IRM sagittale T1. Chordome du clivus envahissant la citerne prépontique. Zones d’hypersignal spontanées (flèches) au sein d’une masse en isosignal. MRI T1 sagittal view without contrast. Clivus chordoma with extension into the prepontine cistern. Zones of hypersignal into an isosignal tumoral mass.
hypodenses correspondant à une portion kystique contenant du matériel myxoïde ou de la nécrose. Après injection intraveineuse de produit de contraste, les portions tissulaires se rehaussent contrairement aux zones spontanément hypodenses qui ne se rehaussent peu ou pas du tout. L’angio-TDM permet de déterminer la position des vaisseaux par rapport à la tumeur [164] et de juger du développement des anastomoses intracrâniennes avant un éventuel test d’occlusion artérielle. Les données de la TDM sont également utilisées pour la chirurgie assistée par ordinateur isolément ou en fusion avec les données de l’IRM [165,166]. 8.1.1.2. IRM. Par sa meilleure résolution tissulaire, l’IRM (Fig. 35–46) est complémentaire de la TDM pour déterminer l’extension intracrânienne et vers la face. Ainsi, l’IRM avec injection de gadolinium et la TDM en résolution osseuse sont le couple de choix dans l’exploration des chordomes. En IRM, le chordome est bien limité [163,167]. Son signal en T1 est intermédiaire ou en hyposignal et se détache nettement
Fig. 37. Coupe axiale IRM de type myélographique. Chordome intradural. Sur cette séquence, la tumeur est délimitée par l’hypersignal du LCS (A) (têtes de flèche). Insertion osseuse de la tumeur (flèche blanche) par rapport aux nerfs VI (flèches noires) et au tronc basilaire (B). Myelographic MRI axial view. Intradural chordoma. The tumor is delineated by the hypersignal of the CSF (A) (arrow head). Notice (B) the bony attachment (white arrow), the VI cranial nerves (black arrows) and the basilar trunk.
de l’hypersignal spontané de la graisse du spongieux osseux. Des hypersignaux T1 spontanés intratumoraux évoquent la présence d’hémorragie, de matériel mucoïde, de résidus osseux ou de calcifications. La caractéristique essentielle de la tumeur est son hypersignal T2 intense correspondant à sa composition riche en eau. L’hypersignal est globalement intense avec des septums de signal moins intense. Cette forme multilobulée traduit la disposition lobulaire des amas cellulaires séparés par des septums. Il peut également exister des zones d’hyposignal T2 correspondant à des hémorragies, des zones de matériel mucoïde ou des calcifications. Les hémorragies intratumorales sont mieux vues sur les séquences T2 en écho de gradient. Afin de différencier l’hypersignal de la tumeur de celui de la graisse, il convient d’utiliser une séquence T2 avec suppression du signal de la graisse. Sur les séquences T1 après injection de gadolinium, l’aspect multilobulé caractéristique de la tumeur est retrouvé sous forme d’un rehaussement modéré en rayon de miel des septums entourant des zones de faible rehaussement correspond à des zones de nécrose ou de matériel mucoïde. La suppression du signal de la graisse après
Fig. 36. Coupes IRM axiales en T1 (A), T2 (B) et T1 avec injection de gadolinium (C). Chordome du clivus avec extension intradurale. En T1, la lésion est en isosignal avec des zones d’hyposignal (astérisque). En T2, la lésion est en hypersignal intense, polylobée, les nodules sont entourés de septums en hyposignal (tête de flèche. Après injection, les portions les plus charnues se rehaussent délimitant des zones de rehaussement moins intenses correspond à des zones de nécrose ou de matériel mucoïde donnant un aspect en nid d’abeille. MRI axial T1 (A), T2 (B) and T1 with contrast (C) views. Clivus chordoma with intradural extension. In T1, isosignal mass with hyposignal zones (asterisk). In T2, hypersignal mass with lobules separated by hyposignal septa (arrow head). Contrast enhancement with gadolinium with less enhanced parts corresponding to necrosis or mucoïd zones (honeycomb features).
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
23
des problèmes de diagnostic différentiel avec le chondrosarcome [169]. Les formes purement intradurales [49] se développent dans la citerne prépontique. Il n’existe pas toujours de lyse du clivus. Les séquences fortement pondérées en T2 submillimétriques de type myélographique ont deux intérêts, le repérage du segment intracisternal des nerfs crâniens par rapport à la tumeur et la délimitation des contours intraduraux de la tumeur. En effet, sur ces séquences la tumeur est en hyposignal et se détache parfaitement de l’hypersignal du liquide céphalorachidien alors que sur les séquences T2 classiques, l’hypersignal de la tumeur se confond à celui du LCS. Enfin, récemment, l’intérêt des séquences de diffusion a été souligné dans le diagnostic différentiel des chordomes [170]. En effet, en raison de la différence de cellularité, les valeurs de l’ADC sont plus basses dans les chordomes que dans les chondrosarcomes. En angio-IRM, le déplacement des vaisseaux et l’englobement des carotides et du tronc basilaire sont courants. Les sténoses ou occlusions artérielles sont rares, car les chordomes ont une structure molle et sont non agressifs pour les vaisseaux. Enfin, les séquences d’angio-IRM veineuses permettent de déterminer la latéralisation du retour veineux et les éventuels retentissements de la tumeur sur le retour veineux cérébral.
Fig. 38. Coupe IRM axiale T1 en saturation de graisse. Chordome du clivus envahissant le sphénoïde, l’ethmoïde (tête de flèche) et les deux sinus caverneux (flèches). Rehaussement élevé et hétérogène de la tumeur. MRI T1 axial view with fat suppression. Clivus chordoma invading the sphenoid, the ethmoid (arrow head) and both cavernous sinus (arrows). Marked heterogeneous tumoral enhancement.
injection de produit de contraste permet de mieux différencier la composante de signal élevé de la tumeur de celui de la graisse adjacente. Les séquences d’IRM dynamiques [168] montrent une courbe de rehaussement progressif et sans pic. Les formes chondroides sont de signal T1 plus intense et en T2 moins intense en raison du contenu en eau moins important. La prise de contraste est plus marquée. Le point de départ est plus latéral, développé sur la face postérieure de l’apex pétreux, ce qui pose
8.1.1.3. Artériographie conventionnelle. Le chordome est une tumeur avasculaire ou très peu vasculaire. L’artériographie confirme les déplacements vasculaires et le calibre de la lumière artérielle vus en angio-TDM et angio-IRM. Son intérêt est surtout de réaliser un test d’occlusion ou une occlusion définitive afin de faciliter l’exérèse de chordome englobant les vaisseaux. 8.1.1.4. Extension locale. Le chordome se développe à partir des résidus de la notochorde qui sont enchâssés dans le spongieux de l’os. La lésion va progressivement lyser les travées osseuses pour enfin rompre la corticale et s’étendre secondairement aux structures adjacentes [171]. Vers l’avant, la tumeur envahit le sinus sphénoïdal puis les fosses nasales et l’ethmoïde. Plus bas, la lésion se développe dans l’espace prérachidien antérieur et bombe dans le nasopharynx et l’oropharynx.
Fig. 39. Coupe IRM axiale T1 (A) et sagittale T1 avec injection (B). Chordome du clivus envahissant les parties molles prérachidiennes et bombant dans le nasopharynx. On voit la graisse de l’espace rétropharyngé refoulée en avant (flèches blanches). Envahissement de la masse latérale droite de C2. La muqueuse du nasopharynx est normale (tête de flèche). MRI axial T1 and sagittal T1 views with contrast. Clivus chordoma invading the soft tissues of the pharynx. Fat in the retropharyngeal space is pushed forwards (white arrows). The C2 right lateral mass is invaded. The pharyngeal mucosa is intact (arrow).
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 24
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 40. Coupe IRM axiale T1 (A) et T2 (B). Chordome du clivus envahissant les apex pétreux en arrière des portions horizontales des carotides intrapétreuses (astérisques), en intradural l’angle pontocérébelleux droit, le cavum de Meckel droit et gauche et les sinus caverneux englobant la carotide interne droite qui reste de calibre normal (flèche). MRI T1 and T2 axial views. Clivus chordoma invading on both sides the petrous apex behind the horizontal segment of the internal carotid arteries (asterisks). Extension to the right cerebello-pontine angle, the Meckel cave on both sides and both cavernous sinus embedding the internal carotid artery (arrow).
Latéralement, la tumeur envahit l’apex pétreux et le canal carotidien dans leurs portions verticale et horizontale intrapétreuses. La tumeur peut s’étendre après avoir lysé la paroi postérieure de l’os pétreux dans l’angle pontocérébelleux. L’extension inférieure et latérale se fait vers le foramen jugulaire et le canal condylien et plus latéralement vers le condyle occipital. La lésion peut lyser les vertèbres C1 et C2 et envahir le foramen magnum. En arrière, la tumeur refoule dans un premier temps la dure-mère pour ensuite la rompre et se développer en intradural dans la citerne prépontique refoulant le tronc basilaire et le tronc cérébral. La lésion peut entraîner une indentation sur le tronc cérébral. Le 4e ventricule est parfois comprimé entraînant une hydrocéphalie.
Plus bas, la lésion arrive au contact des artères vertébrales dans leur segment V4. Vers le haut, la lésion envahit la selle turcique et refoule la glande hypophysaire en haut et en avant pouvant déborder dans la citerne opto-chiasmatique pour arriver au contact du chiasma optique et du plancher du 3e ventricule. Plus latéralement, elle envahit les sinus caverneux et la fosse temporale intracrânienne. Les coupes sagittales et axiales perpendiculaires au clivus sont les plus intéressantes pour déterminer les limites antérieure et postérieure de la tumeur. Les coupes axiales et coronales sont plus utiles dans l’extension latérale aux sinus caverneux, à la citerne opto-chiasmatique et à la face. Les angles de raccordement de la tumeur par rapport à la dure-mère et la séquence T2 de type myélographique permettent de prédire l’envahissement intradural [172].
Fig. 41. Coupe IRM sagittale T2 (A) et axiale T2 (B). Chordome du clivus envahissant le sphénoïde, la selle turcique et la citerne opto-chiasmatique. Notez la fine ligne correspondant à la dure-mère refoulée mais non rompue (flèches) et l’angle de raccordement obtus (tête de flèche). À l’intervention, la dure-mère était distendue mais non rompue. MRI T2 sagittal (A) and T2 axial (B) views. Clivus chordoma invading the sphenoid, the sella turcica and the opto-chiasmatic cistern. Notice the thin line corresponding to the shifted but intact dura mater (arrows) and its obtuse-angled connection to the bone (arrow head); this was confirmed during the surgery.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
25
Le bilan préthérapeutique doit particulièrement s’attacher à déterminer la proximité de la tumeur des structures nerveuses sensibles pour la radiothérapie comme le chiasma optique et le tronc cérébral. 8.1.1.5. Extension à distance. Bien que le chordome soit essentiellement une tumeur à malignité locale, il peut donner des métastases. Les localisations à distance sont de trois types, soit par dissémination cérébrospinale [76] soit par voie lymphatique vers les ganglions cervicaux soit enfin par voie hématogène [174] dans le foie, le poumon, l’os et la peau. La découverte de ces métastases semble actuellement plus fréquente en raison de l’augmentation de l’espérance de vie apportée par les nouveaux traitements. Le signal IRM des métastases est superposable à celui de la tumeur primitive. 8.1.1.6. Diagnostic différentiel. Les diagnostics différentiels des chordomes du clivus sont multiples, nous ne détaillerons que les plus importants [175].
Fig. 42. Coupe IRM axiale T2. Chordome du clivus avec envahissant intradural. La dure-mère normale n’est pas visible. Le tronc basilaire est englobé dans la tumeur (flèche). Le tronc cérébral est refoulé et déformé (tête de flèche). MRI T2 axial view. Clivus chordoma with intradural extension. The dura cannot be identified. The basilar trunk is encased by the tumor (arrow). The brain stem is severely compressed (arrow head).
En effet, lorsque la tumeur reste extradurale, l’angle de raccordement avec la dure-mère est obtus et la dure-mère est visualisée sous forme d’un fin liseré continu en hyposignal T2. Pour l’extension osseuse ou aux régions profondes de la face, le T1 avec suppression de graisse permet de différencier le rehaussement de la tumeur du signal de la graisse. En cas de récidive post-thérapeutique, les extensions se font parfois dans des sites anatomiques moins classiques avec notamment une dissémination le long de la voie d’abord opératoire [173].
8.1.1.7. Ecchordosis physaliphora (EP). Cette tumeur bénigne dérivée de la notochorde est localisée en arrière du clivus dans l’espace prépontique en intradural. Elle est toujours de petite taille, inférieure à 2 cm, de contours réguliers [33]. Sa détection en TDM est pratiquement impossible en raison de sa taille, des artéfacts nombreux dans la fosse postérieure et de sa densité équivalente à celle du LCS. Un pédicule osseux relie parfois la tumeur au clivus. En IRM, la lésion est un peu plus en hypersignal en T1 et T2 que le LCS. Elle est parfois difficile à différencier en T2 par rapport aux artefacts de flux de LCS des citernes de la base. Le signal est homogène. Les séquences T2 Flair et les séquences CISS ont un meilleur rendement dans le dépistage de ces lésions. L’EP ne se rehausse pas après injection de gadolinium en raison de la pauvreté de son contingent vasculaire. Il n’existe pas de critère formel pour différencier EP et chordome de développement intradural pur [53]. Les arguments diagnostiques en faveur de l’EP sont la découverte fortuite, la petite taille, l’absence de lyse osseuse et l’absence de rehaussement après injection de gadolinium. Le pont osseux n’est pas retrouvé dans les autres lésions rétroclivales et reste typique de l’ecchordosis physaliphora.
Fig. 43. Coupe IRM sagittale T1 (A) et T1 avec injection de gadolinium (B). Chordome du clivus envahissant la selle turcique et la citerne opto-chiasmatique. La glande hypophysaire normale est retrouvée en avant (flèche). Refoulement du tronc cérébral et du plancher du 3e ventricule (tête de flèche). MRI T1 sagittal views with (A) and without contrast (B). Clivus chordoma invading the sella and the opto-chiasmatic cistern. The pituitary gland is normal and displaced forwards (arrow). The brain stem and third ventricle are shifted (arrow head).
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 26
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 44. Coupe IRM axiale T2 sur le clivus (A) et axiale T2 cervicale (B). Chordome du clivus envahissant l’apex pétreux gauche (tête de flèche). Adénopathies cervicales métastatiques de même signale que la tumeur principale (flèches). MRI T2 axial view of the clivus and T2 axial view of the cervical spine. Clivus chordoma invading the left petrous apex (arrow head). Lymphatic nodes metastases in the neck with similar signal as the clival tumor (arrows).
8.1.1.8. Tumeur bénigne à cellule notochordale intra-osseuse (BNCT). Cette lésion est le plus souvent de découverte fortuite, siégeant dans le clivus [176]. À l’examen TDM, la lésion présente une ostéosclérose périphérique sans destruction de la trame osseuse qui présente plutôt des épaississements trabéculaires. En IRM la lésion est en hypersignal homogène T2 et en hyposignal homogène en T1. Il n’existe aucun rehaussement après injection de gadolinium. La lésion est bien limitée sans lyse des corticales et sans extension intradurale.
8.1.1.9. Adénome hypophysaire invasif. En TDM, la tumeur lyse le plancher sellaire et le corps du sphénoïde. En IRM, elle est en isosignal T1 par rapport à la substance grise et se rehausse de fac¸on intense et hétérogène après injection de contraste. L’argument important est que l’hypophyse normale n’est pas individualisable contrairement aux chordomes envahissant la selle turcique pour lesquels l’hypophyse normale est retrouvée refoulée en haut et en avant. L’extension rétroclivale intradurale n’est pas habituelle dans les adénomes. 8.1.1.10. Dysplasie fibreuse. Dans sa forme kystique, la dysplasie fibreuse entraîne un aspect soufflé et élargi du clivus en hypersignal T2 intense. La TDM retrouve cependant en périphérie l’aspect caractéristique des modifications de la trame osseuse en verre dépoli et le respect des corticales osseuses. 8.1.1.11. Chondrosarcome. Le point de départ est plus latéral centrée sur la suture pétro-occipitale et sphénopétreuse [177,178]. La lyse osseuse et le signal en IRM sont proches de ceux du chordome. La prise de contraste est variable en fonction du type histologique parfois intense. Les calcifications de type chondroïde sont courantes. Les séquences de diffusion semblent pouvoir différencier les deux tumeurs. Les chondrosarcomes avec une cellularité supérieure présentent un coefficient de diffusion plus élevée que celui des chordomes [179]. 8.1.1.12. Méningiome clival. Le point de départ est méningé. La TDM montre une hyperostose au niveau de l’insertion et de l’envahissement osseux. En IRM, le signal T1 et T2 sont différents de celui des chordomes. La prise de contraste est intense avec un raccordement et un épaississement de la méninge bien visibles après injection.
Fig. 45. Coupe IRM sagittale T2 de type myélographique. Ecchordosis physalifora, découvert à l’occasion d’un épisode de rhinorrhée compliqué de méningite. Formation rétroclivale intradurale (tête de flèche) associée à une méningocèle sphénoidale (flèche). Myelographic MRI T2 sagittal view. Ecchordosis physaliphora, discovered after a CSF leak and a meningitis presenting as an intradural mass (arrow head). Notice the sphenoidal méningocele (arrow).
8.1.1.13. Plasmocytome. C’est une masse lytique unique mal limitée, sans sclérose marginale. Il n’y a pas de calcifications intratumorales. Le signal T2 n’est pas aussi intense que celui des chordomes et le rehaussement après injection est plus marqué. 8.1.1.14. Métastases du sphénoïde. C’est la cause la plus fréquente de tumeur osseuse. Les lésions primitives sont les cancers du sein, du poumon et de la prostate.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
27
Fig. 46. Coupe IRM sagittale T1 (A) et T2 (B). Chordome des dernières pièces sacrées et du coccyx. En T1, la lésion est en discret hyposignal par rapport aux muscles avec extension dans les espaces sacrés et épiduraux. En T2, la lésion est lobulée en hypersignal intense, contenant des zones d’hyposignal correspondant aux septums. Notez la vertèbre L4 hémangiomateuse. MRI T1 (A) and T2 (B) sagittal views. Chordoma of the caudal part of the sacrum and of the coccyx. In T1, hyposignal as compared to the muscles; in T2, lobulated hypersignal mass with hyposignal zones corresponding to septa. Notice an hemangioma in the L4 vertebra.
La tumeur est mal limitée, infiltrante. Le signal n’est pas aussi intense que celui des chordomes et le rehaussement différent. Les localisations multiples sont courantes et détectées par scintigraphie osseuse. 8.1.1.15. Tumeur du nasopharynx envahissant le sphénoïde. Le point de départ de la tumeur est le nasopharynx, la muqueuse normale n’est pas retrouvée. Les adénopathies cervico-faciales sont courantes, notamment les adénopathies rétropharyngées. 8.1.1.16. Paragangliome. Dans cette localisation, il s’agit d’extension de paragangliomes jugulaire ou tympanique. L’origine de la lésion est latérale centrée sur le foramen jugulaire ou la caisse du tympan. L’atteinte osseuse en TDM est caractéristique avec lyse et infiltration donnant un aspect mité de l’os. L’hypervascularisation de la tumeur est retrouvée sous l’aspect d’hyposignaux en vide de signal au sein de l’hypersignal de la tumeur avec un aspect sel et poivre caractéristique. Sur les angioIRM et les séquences dynamiques, le rehaussement est intense et précoce [180]. 8.1.2. Chordomes de localisation non clivale Les autres localisations crâniennes sont beaucoup plus rares. Il s’agit des sinus de la face et des fosses nasales [181], du nasopharynx [182], du foramen jugulaire [183], du rocher [184] et de la voûte du crâne. Le diagnostic est fait sur la biopsie ou l’examen de la pièce opératoire dans ces localisations atypiques et inattendues. 8.1.3. Chordomes du rachis Dans cette localisation, le couple TDM et IRM est également le couple de choix dans l’exploration. 8.1.3.1. Chordomes du sacrum. Le sacrum est la localisation préférentielle des chordomes. C’est la tumeur primitive du sacrum la plus fréquente [185,186]. 8.1.3.1.1. Radiographies standard. Le chordome touche les dernières pièces sacrées ou le coccyx. Le premier étage sacré est
généralement respecté. Le chordome est responsable d’une ostéolyse médiane ou paramédiane centrée sur un trou sacré. De profil, il existe dans presque tous les cas une opacité des parties molles pré-sacrées, refoulant la clarté rectale. 8.1.3.1.2. TDM. La lyse du sacrum est de forme lobulaire avec extension secondaire dans les espaces pré- et postsacré [187]. La tumeur est hypodense souvent volumineuse au moment du diagnostic. L’hypodensité de la tumeur traduit le contenu myxoïde de la tumeur riche en eau. Il peut exister au sein de la masse des parties molles des calcifications, qui seraient plus fréquentes dans le chordome chondroïde. 8.1.3.1.3. IRM. Le chordome est lobulé, avec extension dans les espaces sacrés et épiduraux [188]. En T1, la lésion est en discrète hyposignal par rapport aux muscles. Il existe des zones d’hypersignal correspondant à des hémorragies ou un contenu mucineux. En T2, la tumeur est en hypersignal T2 intense, hétérogène avec des zones d’hyposignal qui correspondent aux zones d’hypersignal T1. Après injection de produit de contraste, la lésion est modérément rehaussée et hétérogène. 8.1.3.1.4. Diagnostic différentiel. 8.1.3.1.4.1. Tumeur à cellules géantes. C’est par ordre de fréquence la deuxième tumeur du sacrum [189]. La tumeur débute à la portion supérieure du sacrum et peut s’étendre latéralement passant au-delà de l’articulation sacro-iliaque jusque dans l’aile iliaque. Le signal IRM en T2 est beaucoup moins intense que celui des chordomes en raison de la présence de tissus fibreux au sein de la tumeur. Il existe parfois des zones kystiques avec un niveau liquide dû à l’association d’un kyste anévrismal. 8.1.3.1.4.2. Chondrosarcomes. Ils naissent latéralement à partir du cartilage de l’articulation sacro-iliaque. Il présente un hypersignal T2 hétérogène en raison de l’association de leur composante cartilagineuse et minéralisée. Il ne présente pas de composante hémorragique intratumorale ce qui permet de les différencier des chordomes. 8.1.3.1.4.3. Épendymome myxopapillaire. Ils peuvent entraîner une destruction osseuse du sacrum, mais le point de départ est intradural et l’atteinte osseuse est secondaire [190].
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 28
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 47. Coupe TDM axiale avec injection. Chordome cervical C4. Élargissement du foramen de conjugaison et masse intracanalaire pouvant évoquer une tumeur nerveuse (astérisque). La vertébrale est refoulée (flèche). CT scanner axial view with contrast. Cervical chordoma at C4. Enlargement of the intervertebral foramen and intraspinal extension simulating a dumb-bell schwannoma (asterisk). The vertebral artery is shifted (arrow).
Leur rehaussement après injection est beaucoup plus intense que celui des chordomes. 8.1.3.2. Chordome du rachis mobile. La lésion prédomine en cervical, lombaire puis thoracique. La tumeur est en hypersignal par rapport aux disques [191]. 8.1.3.2.1. Radiographies standard. Le chordome réalise typiquement une lyse osseuse polylobée du tiers postérieur du corps vertébral correspondant à la topographie du canal chordal. Il peut s’étendre à plusieurs vertèbres contiguës, en respectant les disques. 8.1.3.2.2. TDM. L’extension de la masse dans les parties molles est souvent importante. En cervical la tumeur peut présenter un développement en sablier dans un trou de conjugaison élargi simulant une tumeur nerveuse. Il présente une sclérose périlésionnelle et des calcifications amorphiques intratumorales. Après injection, le rehaussement est modéré, hétérogène avec des zones sans rehaussement (Fig. 47). 8.1.3.2.3. IRM. L’IRM montre l’aspect de la tumeur et ses extensions intra- et extraosseuses. Les contours de la masse sont réguliers avec parfois un aspect de pseudocapsule en hyposignal sur toutes les séquences. L’extension se fait aux régions paravertébrales et à l’espace épidural avec compression médullaire ou radiculaire. Le chordome est plurilobé, en isosignal ou hyposignal en T1. En T2, il est en hyperintense par rapport au LCS et aux disques intervertébraux avec des septums hypodenses (Fig. 48 et 49). Le rehaussement est variable [192]. La séquence de diffusion [193] est un argument diagnostic important du diagnostic différentiel avec hypersignal en diffusion et un ADC élevé. 8.1.3.2.4. Diagnostic différentiel. Les diagnostics différentiels sont nombreux [194,195]. La biopsie guidée sous TDM aide au diagnostic en raison du manque de spécificité des lésions. Nous décrirons les principales lésions pouvant poser un problème de diagnostic différentiel. 8.1.3.2.4.1. Tumeur bénigne à cellule notochordale intra-osseuse et intravertébrale (BNCT). Elle est le plus souvent de découverte fortuite. Les formes étendues sont parfois découvertes à l’occasion de douleurs. À l’examen TDM, la lésion réalise une ostéosclérose sans destruction de la trame osseuse qui présente plutôt des épaississements trabéculaires. La lésion est bien limitée sans lyse des corticales et
sans extension en dehors de la vertèbre. Elle peut occuper la moitié du corps de la vertèbre. En IRM, la lésion est en hypersignal homogène T2 et en hyposignal homogène en T1. Il n’existe aucun rehaussement après injection de gadolinium. Le diagnostic différentiel avec les chordomes repose sur la destruction osseuse extensive dépassant les corticales avec invasion des parties molles. La lésion ne se rehausse pas après injection de gadolinium [90]. Le développement de chordome à partir de cette tumeur bénigne a été rapportée [93]. 8.1.3.2.4.2. Hémangiome vertébral. En TDM, la vertèbre hémangiomateuse est striée verticalement en raison de l’élargissement des travées osseuses. La localisation des hémangiomes agressifs est plutôt dorsale. Ils présentent des plages lytiques étendues avec atteinte de l’ensemble du corps vertébral et de l’arc postérieur, destruction des corticales et extension épidurale et dans les parties molles. Le contenu est plus tissulaire que graisseux [196]. En IRM lorsqu’elle est tissulaire, la lésion est en hyposignal T1, et en hypersignal T2. La portion charnue se rehausse intensément après injection. 8.1.3.2.4.3. Chondrosarcome. Le chondrosarcome rachidien se développe plus souvent à partir de l’arc postérieur que du corps vertébral. Il peut se développer à partir d’une exostose dégénérée. Il entraîne une lyse osseuse avec extension dans les parties molles associée à des calcifications en motte. En IRM, la lésion est polylobée en hyposignal T1 et hypersignal T2 avec des septums et des contours en hyposignal. Les calcifications sont en hyposignal. La prise de contraste est périphérique et arciforme correspondant à des cloisons fibrovasculaires entourant des lobules cartilagineux. La courbe d’intensité de prise de contraste est exponentielle. 8.1.3.2.4.4. Plasmocytome solitaire. L’image caractéristique est celle d’une lyse du corps vertébral, multikystique, comprenant des cloisons osseuses verticales délimitant des plages d’ostéolyses ovalaires à grand axe vertical respectant longtemps les corticales. Parfois, l’aspect rappelle celui d’un angiome ou d’une métastase. La lésion présente un hyposignal en T1, une prise de contraste modérée et homogène en T1 avec injection de gadolinium et un hypersignal intense et homogène en T2. L’IRM confirme le caractère unique de la lésion et apprécie l’extension tumorale dans le canal rachidien. 8.1.3.2.4.5. Tuberculose rachidienne. L’infection tuberculeuse est à point de départ vertébral sans spondylodoscite. La lésion entraîne une géode centrosomatique plus ou moins entourée de condensation osseuse. L’abcès des parties molles et plus ou moins volumineux et se développe dans les espaces périrachidiens atteignant plusieurs vertèbres. En IRM, la lésion est discrètement en hypersignal en T1, en hypersignal T2 et les collections abcédées se rehaussent en périphérie. La perfusion en TDM [197] aide à différencier la tuberculose des tumeurs malignes en montrant un rBF et un rBV plus élevé dans la pathologie tumorale que dans la pathologie infectieuse et inflammatoire. 8.1.3.2.4.6. Métastase. Elles sont extrêmement fréquentes. La TDM précise l’étendue de la lyse osseuse qui peut s’étendre dans les pédicules. En IRM, le signal n’est pas spécifique. La lésion est en hyposignal T1, hypersignal variable en T2 avec une prise de contraste hétérogène. L’IRM apprécie l’extension épidurale et dans les parties molles ainsi que la présence d’éventuelles localisations multiples. 8.1.3.2.4.7. Lymphome. L’aspect est variable. Il s’agit le plus souvent d’une masse ostéolytique perméative envahissant les parties molles. Des formes condensantes et mixtes sont possibles. Une ostéolyse modérée associée à un envahissement marqué des parties molles sont évocateurs. L’IRM précise l’extension extraosseuse, la lésion est en hyposignal T2.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
29
Fig. 48. Coupe IRM sagittale T2 (A) et coronale T1 avec injection de gadolinium et saturation de graisse (B). Même patient que la Fig. 15. Le chordome est plurilobé, hyperintense en T2 (tête de flèche) par rapport au LCS et aux disques intervertébraux avec des septums hypodenses. Il s’étend aux vertèbres contiguës (flèches). La prise de contraste est nette. MRI T2 sagittal view (A) and T1 coronal view with contrast and fat suppression (B). Same patient as Fig. 15. Hyperintense mass (arrow head) in T2 as compared to the CSF and discs; Multiple lobules separated by hypointense septa. Extension to the adjacent vertebrae (arrows). Notice the marked contrast enhancement.
8.1.4. Surveillance post-thérapeutique La surveillance est basée sur l’IRM, quelle que soit la localisation. Les séquences T2 avec suppression du signal de la graisse détectent l’hypersignal de la récidive tumorale. La comparaison avec l’imagerie initiale et la connaissance du type de traitement réalisé sont fondamentales pour comprendre l’aspect postopératoire. Le site initial de la tumeur doit être exploré ainsi que l’ensemble de la voie d’abord chirurgicale.
L’aspect des chordomes est assez évocateur dans ses localisations classiques, ce qui permet d’évoquer le diagnostic dans la plus grande majorité des cas avant la biopsie. Le chordome entraîne une lyse osseuse régulière sans condensation périphérique avec lyse des corticales. L’IRM est caractéristique avec un aspect polylobé, en hypersignal T2 intense et un rehaussement en rayon de miel après injection de gadolinium. 8.2. Imagerie isotopique (M. Duet)
8.1.5. Conclusion L’exploration des chordomes repose sur le couple complémentaire TDM et IRM.
L’intérêt des examens isotopiques dans la prise en charge des chordomes paraît assez maigre car globalement il s’agit de lésions
Fig. 49. Coupes sagittales T2 parasagittale (A) et sagittale médiane (B). Récidive locale d’un chordome du clivus et par dissémination peropératoire sur la fixation cervicale postérieure (flèche). Récidive cervicale par diffusion intracanalaire avec syringomyélie (têtes de flèche). MRI T2 sagittal paramedian (A) and median (B) slices. Recurrence of a clivus chordoma and intra-operative seeding on the posterior cervical instrumentation (arrow). Intradural seeding with syringomyelia at the cervical level (arrow heads).
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 30
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
ostéolytiques, ne fixant pas ou peu en scintigraphie comme en TEP ; néanmoins, ils peuvent être de quelque utilité dans le diagnostic différentiel, le suivi et parfois le traitement. 8.2.1. Scintigraphie monophotonique D’une fac¸on générale, l’apport de la scintigraphie osseuse classique, réalisée grâce à un biphosphonate marqué au 99 Tc, dans le diagnostic de ces tumeurs ostéolytiques est faible, la fixation y étant presque toujours nulle ou très faible. Seuls quelques cas fixant le traceur ont été rapportés, probablement du fait de calcifications ou d’une ostéocondensation peri-tumorale. Trikha [570] publie un cas de chordome sacré fixant le 99 Tcbiphosphonate. Kendall [198], en 1977, observe 5 cas positifs dans une série de 44 chordomes. Rossleigh [571] examine 16 tumeurs sacrées dont 5 chordomes parmi lesquels un seul fixe modérément le traceur. L’intérêt de ce traceur est donc essentiellement de différencier le chordome de tumeurs osseuses ostéocondensantes primitives ou secondaires, notamment rachidiennes. En revanche, il ne permet pas un diagnostic différentiel avec le plasmocytome, lésion ostéolytique qui fixe peu ou pas le 99 Tc-biphosphonate. Enfin, l’indice de fixation observé dans les ostéosarcomes est variable selon le grade, faible pour les bas grades et souvent élevé pour les hauts grades. D’autres marqueurs utilisés en pathologie tumorale ont été testés : l’111 In-pentétréotide, permettant une scintigraphie des récepteurs de la somatostatine et couramment utilisé dans le bilan des tumeurs neuro-endocrines [572,573], le 201 Tl [574] dont la captation dépend de la pompe Na-K-ATPase et reflète ainsi la charge de tumeur viable. Ce traceur permet de différencier radio-nécrose et récidive, et a été utilisé pour établir le grade de tumeurs cérébrales, le gallium-67 [575] autrefois utilisé dans la définition du stade et de la prise en charge de lymphomes malins (hodgkiniens ou non). Aucun de ces traceurs n’a été d’un quelconque intérêt dans la prise en charge des chordomes. 8.2.2. TEP-scan Le 18 FDG, dont la captation traduit l’existence de cellules métaboliquement actives, a été le plus couramment utilisé. Les résultats de cette imagerie TEP ont été décevants, la captation du traceur étant majoritairement faible voire nulle. Son intérêt là encore réside dans le diagnostic différentiel entre chordome (captation nulle) et métastase (captation intense et parfois lésions multiples). Néanmoins, quelques cas de chordomes se sont révélés positifs au 18 FDG-TEP-scan. Ainsi Miyazawa [576] présente un cas de chordome thoracique chez un patient de 73 ans positif au 18 FDG lors du diagnostic initial, mais aussi lors de la récidive 7 mois plus tard. À cette date l’auteur souligne que, dans la littérature, seul un cas des 12 chordomes explorés par cette technique était positif. Park, en 2008 [577], rapporte également un cas de chordome sacré chez une femme de 52 ans, détecté au 18 FDG-TEP-scan sous la forme d’une fixation hétérogène peu intense. Nishiguchi et al. [93] décrivent un cas de chordome associé à une BNCT fixant le 18 FDG et dont l’intensité a diminué après radiothérapie au 11 C. Ferraresi [578] mentionne que 2 des 10 patients traités par imatinib avaient une fixation initialement élevée, qui avait diminué sous traitement. Casali et al. [199] sont les seuls à présenter une série de 6 chordomes (5 sacrés et un clival) qui tous fixaient le 18 FDG lors du bilan initial. Ces résultats positifs pourraient traduire une agressivité particulière des chordomes explorés dans cette étude. Par ailleurs, tous ont montré une diminution de la fixation sous traitement par imatinib. Ces études soulignent l’intérêt potentiel de la technique, si ce n’est à titre systématique, tout au moins dans le bilan initial de tumeurs présélectionnées, ayant un potentiel agressif. En cas de positivité, elle constituerait un examen de référence pour le suivi thérapeutique ou pour la détection d’éventuelle récidive. En effet, il est parfois difficile, en IRM, de différencier une reprise évolutive d’une
image cicatricielle notamment après abord endoscopique endonasal. Plus intéressant semble être l’utilisation de la 11 C-methionine, acide aminé marqueur de la prolifération cellulaire. Zhang [579] (Chiba Japon) en 2004 rapporte ainsi une série de 15 chordomes (11 sacrés, 1 thoracique et 3 iliaques) dont 12 étaient positifs et dont la fixation a diminué après radiothérapie au 11 C− (CIRT). L’index de fixation T/N (tumeur/zone non tumorale) est passé de 3,3 ± 1,7 à 2,3 ± 1,4 avec un suivi de 20 mois. Debus [330] (Heidelberg Allemagne) a étudié en 11 C-méthionine TEP-scan 45 patients dont 17 chordomes de la base du crâne traités ensuite par CIRT ; il obtient 94 % de contrôle local avec un suivi moyen de 9 mois. Cependant, l’utilisation d’un traceur marqué au 11 C est difficile car elle ne peut être faite que dans des centres de médecine nucléaire situés près d’un cyclotron, compte tenu de la demi-vie très courte (20 min) du traceur. Une autre classe de traceurs, ceux de l’hypoxie, pourrait permettre une évaluation pronostique. Le 18 F-MISO est le plus couramment utilisé. Il diffuse librement dans les cellules, qu’elles soient normoou hypoxiques, mais il est piégé sélectivement dans les cellules hypoxiques. Son taux de fixation dépend alors étroitement de la teneur en oxygène. L’évaluation de l’hypoxie tumorale est particulièrement intéressante puisqu’elle constitue un facteur pronostique majeur de radio- et de chimio-resistance. Une étude particulièrement intéressante vient d’être publiée (2012) par Mammar [580] dans laquelle 7 patients ayant des chordomes ont été imagés par 18 FDG et/ou par 18 F-MISO : le TEP au 18 F-MISO s’est révélé positif dans 7 des 9 lésions imagées tandis que le 18 FDG seulement dans une des 8 tumeurs étudiées. L’intérêt potentiel de ces traceurs serait donc de localiser des zones plus résistantes à la radiothérapie et sur lesquelles un surdosage serait utile. 9. Associations Différentes pathologies associées aux chordomes ont été rapportées. 9.1. Association chordome et sclérose tubéreuse de Bourneville La plus intéressante est l’association chordome et sclérose tubéreuse de Bourneville. La tuberous sclerosis complex (TSC) est une maladie autosomale dominante neuro-cutanée caractérisée par la prolifération anormale de tissu (hamartomes) dans de multiples organes en particulier le cerveau, la peau, le cœur le poumon et les reins. Les manifestations cliniques sont donc variables et notamment avec l’âge ; dans la plupart des cas, les premiers symptômes surviennent dans l’enfance. La TSC est due à une mutation inactivante des gènes suppresseurs appelés TSC1 et TSC2 qui encodent respectivement l’hamartine et la tubérine. La plupart des patients sont cependant des cas sporadiques provenant d’une nouvelle mutation, résultant en général d’une délétion avec perte de l’hétérozygotie. Les gènes TSC1 et TSC2 sont des constituants importants des voies de signalisations du mTOR. La perte ou l’inactivation de la fonction suppressive des gènes TSC induit une phosphorylation du mTOR et d’une cascade de molécules dont le résultat final est l’augmentation de la croissance et de la prolifération cellulaire [200]. L’association d’un tel syndrome génétique et du chordome peut donner des clés pour la compréhension de la pathogenèse du chordome. McMaster et al. [201], en 2011 ont recherché dans 17 registres américains (SEER) du National Cancer Institute tous les cas de chordome confirmés, chez des patients âgés de 18 ans ou moins, sur la période 1973–2007 ; ces registres couvrent environ un quart de la population des États-Unis. Ils ont relevé 65 cas de chordomes et les ont
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
comparés à 10 cas de chordomes associés à une TSC, retrouvés dans une revue de littérature exhaustive. Dans la série de 65 cas, l’âge moyen est de 12 ans (0–18 ans) dont 15 % entre 0 et 5 ans, 29 % de 6 à 11 ans et 56 % de 12 à 18 ans. L’âge moyen des localisations crâniennes est de 9 ans ; elle est de 13 ans pour le rachis et de 16 ans pour le sacrum. Sur l’ensemble de la série 64 % des chordomes sont crâniens, 26,6 % rachidiens et 9,4 % sacrés. Tous les chordomes de moins de 5 ans sont intracrâniens contre 80 % pour la tranche 6–11 ans et 55 % pour la tranche 12–18 ans. Le suivi moyen est de 51 mois avec une mortalité de 33 %. La survie à 5 ans est de 68 % et à 15 ans de 53 %. La mortalité est de 47 % à 15 ans pour les localisations crâniennes et rachidiennes mais de 100 % à 36 mois pour les localisations sacrées. On retrouve ici les caractéristiques des chordomes de l’enfant citées plus haut mais aucune donnée histologique particulière n’est donnée. Dans le groupe de 10 chordomes associés à une TSC publiés, les données sont très différentes. L’âge moyen est de 6,2 mois (0–16 ans). Neuf ont moins de 5 ans, et 7 moins de 2 ans ; un seul a plus de 5 ans (16 ans). On compte 5 localisations crâniennes, 1 rachidienne et 4 sacrées. Les localisations sacrées sont donc plus fréquentes que dans la population globale et de plus surviennent dans la période néonatale (âge moyen 2 jours). La survie est également bien meilleure puisque sur 7 cas dont l’avenir est connu, 4 des 5 patients opérés sont vivants et sans progression tumorale de 1 à 19 ans après intervention, 1 patient opéré et traité par proton l’est également à 5 ans ; enfin 1 patient ayant un chordome métastatique traité par chimiothérapie est aussi sans progression tumorale à 5 ans. Un seul patient opéré sans traitement complémentaire est décédé à 2 ans. Ceci donne une survie de 83 % avec un suivi médian de 5 ans. Il est également précisé que le pronostic des localisations sacrées est connu pour 2 d’entre elles et qu’elles vont bien sans récidive à 8 et 19 ans, ce qui est bien meilleur que pour les 6 cas de la série globale, tous décédés à 36 mois. Pour 3 des 10 patients, une mutation des gènes TSC1 ou TSC2 a été mise en évidence. L’intérêt de cette association réside dans le fait que si ces gènes sont également inactivés dans certains chordomes non associés à une TSC, on peut imaginer que la voie du mTOR est aussi impliquée dans les chordomes et donc que des inhibiteurs de cette voie pourraient être utilisés dans leur traitement. En fait, ce traitement a déjà été essayé et a démontré une certaine efficacité sur les astrocytomes de laTSC [202]. Pour les chordomes, il n’a pour l’instant été rapporté qu’une étude portant sur 50 cas (essentiellement sacrés) montrant l’activation de la voie mTOR dans 65 % mais sans passer par l’inactivation de TSC1 et TSC2. L’étude ne portait que sur des patients adultes et aucune autre étude ne semble avoir été réalisée sur une population pédiatrique. Inversement, il n’existe qu’un seul cas publié de chordome (intradural latéro-médullaire) associé à une TSC chez un adulte. La piste des gènes TSC et de la voie mTOR paraît néanmoins plus qu’intéressante. 9.2. Maladie d’Ollier ou le syndrome de Maffucci Autre association, celle de chordomes avec la maladie d’Ollier ou le syndrome de Maffucci, deux maladies apparentées et très rares qui comportent différentes localisations de chondrodysplasies. Le syndrome de Maffucci se différencie de la maladie d’Ollier par l’existence d’anomalies vasculaires y compris des hémangiomes. Les deux maladies peuvent être associées à des chondrosarcomes ainsi qu’à d’autres néoplasies non sarcomateuses, notamment intracrâniennes. Dans une revue de littérature exhaustive, Ranger et Szymczak [203] en 2009 ont recherché les associations de ces deux entités à des néoplasies intracrâniennes. Ils ont trouvé 24 cas de maladie d’Ollier associées pour 6 d’entre elles à des chondrosarcomes et pour 18 autres à des tumeurs gliales, et 22 syndromes de Maffucci dont 13 avec chondrosarcomes, 8 avec diverses tumeurs et 1 avec chondrosarcome et une autre tumeur.
31
Parmi ces autres tumeurs associées au syndrome de Maffucci, on trouve 5 gliomes, 1 esthésioneuroblastome, 1 adénome hypophysaire, 1 hemangioendothéliome et 1 chordome. En 1987, Liu et al. [204] avaient présenté une série de 55 patients porteurs d’une maladie d’Ollier dont 1 associée à un chordome et 15 autres essentiellement à des chondrosarcomes (n = 14). Ces associations de chordomes et syndrome de Maffucci ou maladie d’Ollier semblent être les deux seules rapportées à ce jour. S’agissant de maladies congénitales mais non héréditaires, des recherches d’anomalies chromosomiques ont été réalisées mais pour l’instant sans résultat. Néanmoins, étant donné la proximité des pathologies chondromateuses et chordomateuses, il est possible qu’un lien existe entre elles. À ce propos, McMaster et al., dans leur revue épidémiologique de 2001, mentionnent que 39 des 414 chordomes ont eu un autre cancer ce qui est conforme à la fréquence des cancers dans sa population mais deux de ces cancers sont des lésions osseuses : un chondrosarcome et un histiocytome. On peut mentionner également une famille publiée par Weber et Scott [205] en 2005 comprenant un père et deux fils porteurs d’un cancer gastrique ou intestinal et un troisième fils présentant un chordome. 9.3. Association avec la maladie de Crohn Au moins une publication [206] fait état de l’association d’un chordome avec une maladie de Crohn et spécule sur le lien génétique possible existant entre ces deux affections du fait d’anomalies connues sur les mêmes chromosomes 1p, 3p et 7q. 9.4. Association avec un kyste de la poche de Rathke Une autre association avec un kyste de la poche de Rathke a été rapportée. Il semble que le cas présenté par Li et al. [207] en 2011 soit le seul à ce jour. L’intérêt de cette association réside dans l’embryogenèse de la notochorde qui, après avoir cheminé dans le clivus puis en avant de lui, le retraverse pour se terminer près de la selle turcique. On peut donc concevoir qu’un chordome dont l’origine se situe près de l’extrémité céphalique de la notochorde puisse s’associer à une lésion sellaire. Dans le cas rapporté, un homme de 49 ans, le chordome présentait un kyste dans sa partie supérieure qui se révélera être un kyste de la poche de Rathke inclus dans la tumeur. 9.5. Secrétant de l’ACTH Une autre association particulièrement curieuse est celle d’un chordome du sacrum secrétant de l’ACTH et responsable d’un syndrome de Cushing [208]. Cet homme de 76 ans avait un hypercortisolisme biologiquement démontré qui s’est amélioré après l’exérèse incomplète du chordome ; le cortisol plasmatique s’est normalisé et l’ACTH a substantiellement diminué mais n’est pas revenu complètement à la normale. De plus les cellules du chordomes fixaient positivement l’ACTH. Un tel syndrome a été décrit dans des tumeurs carcinoïdes mais semble-t-il jamais associé à un chordome. 10. Localisations extra-axiales Il existe un certain nombre de chordomes localisés en dehors de l’axe primitif de la notochorde, c’est-à-dire en dehors des éléments osseux du clivus à la région sacrococcygienne. Une de ces localisations ne pose pas de problèmes de compréhension puisqu’elle est située sous la muqueuse du nasopharynx, en avant du clivus, dans une zone où la notochorde chemine normalement. En effet la notochorde sort de l’apex de l’odontoïde pour pénétrer la pointe du clivus ; elle traverse ensuite le clivus à sa jonction 1/3 moyen–1/3 inférieur pour se retrouver en avant du clivus sous l’endoderme qui va donner la muqueuse pharyngée. Elle va
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 32
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
enfin retraverser le clivus dans son 1/3 supérieur pour se terminer dans la région sellaire vers sa partie postérieure (lame quadrilatère). La première traversée du clivus se fait au voisinage de ce qui est appelé le canal médio-basal [209] tandis que la seconde est située en avant de la synchondrose sphéno-occipitale et en arrière du canal craniopharyngien. Qu’un chordome se développe entre ces deux traversées osseuses, au niveau du nasopharynx est donc parfaitement compréhensible. En pratique, il est néanmoins souvent difficile d’affirmer une origine nasopharyngée pour des chordomes souvent volumineux et ayant déjà envahi le clivus. Seuls des chordomes diagnostiqués tôt dans leur évolution, à un stade où aucune lyse osseuse n’est visible, peuvent être qualifiés de nasopharyngiens. C’est pourquoi tous les cas rapportés avant l’utilisation du scanner ou de l’IRM restent discutables. Il en est ainsi des deux cas de la publication classique de Wright [210]. Même s’il est affirmé qu’il n’y avait aucune lésion osseuse (no bone involvement), cette affirmation repose sur des radiographies standard et une impression opératoire (sans microscope). C’est le cas aussi de l’observation de Batsakis et Kittleson [211] en 1963, de Richter et al. [212] en 1975 et de Shugar et al. [213] en 1980. Dans les formes purement nasopharyngées, la masse tumorale est distincte de l’os ; il n’y a aucune érosion du clivus mais en revanche on peut souvent observer un aspect de scalloping de la table externe avec respect de la corticale, auquel s’associe un petit tractus bien visible traversant le clivus et rattaché à la masse tumorale. Lors de l’intervention, l’exérèse est assez simple et parfois même réalisée en bloc. Les auteurs insistent sur l’intérêt de réséquer ce tractus en fraisant la face antérieure du clivus au pourtour de ce tractus pour éviter les récidives. Coppens et al. [214] en rapportent 3 cas, qui plus est familiaux, révélés par une obstruction nasale, tous de sexe féminin, âgées de 5,8 et 32 ans. Les 3 patientes ont été opérées et sont sans récidive à 12, 14 et 54 mois. Aucun traitement complémentaire (radiothérapie) n’a été proposé. Il s’agissait d’authentiques chordomes sur le plan radiologique (avec notamment prise de contraste) et immuno-histochimique et non pas de tumeurs bénignes à cellules notochordales. Pour Coppens, les 6 cas de chordomes nasopharyngiens publiés précédemment sont différents dans la mesure où ils présentaient tous une destruction osseuse importante concernant le clivus, le rostre sphénoïdal ou l’ethmoïde [181,213,215–218]. Néanmoins, depuis Coppens, on retrouve au moins deux publications de chordomes nasopharyngiens extraosseux. La première par Nguyen et al. [219] en 2009 porte sur 5 cas observés entre 1997 et 2007, âgés de 8 à
65 ans (moyenne 43 ans) et de sexe ratio M/F à 1/1,5. Quatre sont localisés sur la ligne médiane et s’étendent en haut vers le sinus sphénoïdal et en avant vers le nasopharynx ; le cinquième a une extension plus latérale vers l’espace parapharyngé et le sinus maxillaire. En scanner, ils sont tous extraosseux avec un scalloping du clivus. Deux d’entre eux présentent des calcifications, et 3 sur 5, un tractus les reliant au clivus bien visible. Les 5 cas prennent le contraste en IRM. Tous ont été opérés avec fraisage de la zone de raccordement au clivus. Quatre sont sans récidive mais le temps de suivi n’est pas mentionné et un a présenté une récidive au niveau du tractus tumeur-clivus. Un seul a rec¸u un traitement complémentaire par protons. La seconde publication, par Yan et al. [182], comprend 5 cas histologiquement prouvés, observés entre 2004 et 2008 au Bejing Tongren Hospital et ayant bénéficié d’un scanner et d’une IRM. Ces 5 cas représentent 0,67 % des 890 tumeurs primitives des fosses nasales et du nasopharynx observés sur la même période. En imagerie, ces tumeurs faisaient en moyenne 4 centimètres sur 6, ne montraient aucune lyse osseuse et présentaient toutes des calcifications intratumorales. De plus, en IRM, toutes se rehaussaient après injection de gadolinium. Une des tumeurs avait une extension essentiellement vers la fosse nasale gauche. Les auteurs ne mentionnent en revanche rien à propos d’un éventuel tractus les reliant au clivus. Les 5 chordomes ont été opérés et n’ont pas eu de radiothérapie complémentaire. De fac¸on surprenante, tous ont récidivé dans l’année suivant l’exérèse ce qui les différencie des autres cas publiés qui semblent être de bon pronostic (Fig. 50). Ces formes de chordomes extraosseux sont rares mais ont l’avantage d’être de découverte précoce devant le plus souvent, une obstruction nasale et donc de pouvoir être réséquées de fac¸on beaucoup plus radicale, parfois même en bloc, que les autres localisations crâniennes. Ceci expliquerait effectivement un meilleur pronostic que celui des chordomes intra-osseux du clivus. On peut mentionner ici un chordome chez un homme de 52 ans localisé à la partie latérale du clivus avec essentiellement une masse dans la fosse temporale droite [220] ; à la demande du patient, une simple biopsie transclivale par voie endonasale a été d’abord réalisée. Une fois le diagnostic de chordome établi, il a accepté une intervention d’exérèse ; mais sur l’IRM répétée en préopératoire la tumeur s’était presque complètement extériorisée dans le pharynx. Il a donc été repris en endoscopie endonasale. À la suite de ce geste et d’une protonthérapie il n’a plus eu de progression tumorale à 44 mois. Il est sur que si tous les chordomes du clivus se
Fig. 50. Localisations extra-axiales : pharyngée. Extra-axial localizations of the Pharynx. D’après Yan et al. [182] ; publié avec l’autorisation de l’American Society of Neuroradiology, et des auteurs.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
transformaient spontanément en chordomes du pharynx, leur exérèse poseraient beaucoup moins de problèmes. Un certain nombre de chordomes localisés latéralement et non pas sur la ligne médiane ont été rapportés. Ils ne correspondent pas à une extension latérale d’une localisation médiane et font donc supposer une origine extra-axiale. C’est le cas de chordomes développés au niveau du foramen jugulaire ([221–224] : 2 cas [225] : 3 cas, [183]) (Fig. 51). Ces chordomes du foramen jugulaire peuvent prêter à confusion avec les tumeurs plus fréquentes de cette localisation : paragangliomes ou schwanomes. Un méningiome chordoïde du foramen jugulaire [226] a d’ailleurs été rapporté également. Quelques cas de chordomes de la région du cavum de Meckel, pouvant simuler un neurinome du trijumeau ont également été publiés [184,227–230]. Dans la série, certes ancienne, de Kendall [198] 15 % des chordomes se développent à partir de la pointe du rocher. L’explication qui est donnée de ces localisations latérales est la possibilité d’une bifurcation (Forking) de la notochorde embryonnaire [20]. 11. Chordomes familiaux Quelques rares formes familiales de chordomes ont été publiées. Elles sont intéressantes car elles ont fait l’objet d’études génétiques qui pourraient déboucher sur de nouvelles possibilités thérapeutiques. En 2006, Bhadra et Casey [231] ont rapporté 2 nouvelles familles s’ajoutant à 9 autres publiées depuis 1958 soit un total de 11 familles. Chacune de ces familles compte au moins deux membres atteints, la plupart sur deux ou 3 générations ; l’une d’entre elles en comporte 10 sur 3 générations. Seul Bhadra indique que ses deux familles proviennent d’une cohorte continue de 175 patients porteurs de chordomes et observés sur une période de 10 ans (1995–2005). Les 11 familles sont décrites de fac¸on plus ou moins détaillée ; on peut dire qu’il y a au moins 46 membres atteints par la maladie auxquels on peut ajouter deux patients qui ont présenté un astrocytome intracrânien. Sur ces 46 patients, on sait que 19 sont de sexe féminin et 12 de sexe masculin, que leur âge varie de 3 à 68 ans et que leurs localisations sont essentiellement intracrâniennes : 7 nasopharyngiennes et 24 clivales pour seulement 5 sacrées. Deux patients ont présenté plusieurs localisations au cours de leur vie ;
33
en particulier, l’un d’entre eux a présenté un chordome nasopharyngien à l’âge de 9 ans puis une récidive ou (un autre chordome) à l’âge de 42 ans dont il mourra à l’âge de 47 ans. Chez au moins trois de ces familles, une transmission sur un mode autosomal dominant peut être évoquée. En fait les modifications du génome et surtout les variations du nombre de copies sont un facteur important de la prédisposition à une maladie donnée lorsqu’elle est liée à des désordres chromosomiques. Ces variations du nombre de copies, en particulier les duplications transmissibles, sont rarement démontrées dans les cancers familiaux ; en revanche, elle semble pouvoir l’être dans les chordomes familiaux chez lesquels a été retrouvée une duplication du gène T. Initialement avait été démontré [232] un réarrangement du chromosome 1p36 comportant possiblement un gène suppresseur prédisposant à la survenue d’un chordome. La même étude a été ensuite reproduite sur une cohorte de 35 chordomes sporadiques et a confirmé l’implication du 1p36 dans le développement tumoral chez 31 d’entre eux. Une autre étude publiée par Kelley et al. [233] en 2001, portant sur la famille rapportée par Stepanek et al. [234] et sur deux autres familles, faisait ensuite ressortir le chromosome 7q33 comme un nouveau candidat potentiel prédisposant au chordome ; cette étude a d’abord été reprise et confirmée par Yang et al. [235] en 2005 mais ces mêmes auteurs, en 2009 [143,144], ont réévalué les membres de 7 familles en considérant que les résultats des études précédentes n’étaient pas cohérents puisque certains membres de certaines familles ne montraient pas les mêmes anomalies que les autres. Cette fois c’est le chromosome 6q27 qui est avancé avec chez tous les membres étudiés (n = 7) sans exception, de 4 familles sur 7, des duplications sur la même région de ce chromosome ; en revanche la duplication n’est retrouvée chez aucun des membres des 3 autres familles. La région minimale du locus de ce chromosome partagée par toutes les familles positives contient plusieurs gènes jouant probablement un rôle important dans le chordome et les cancers en général. Cependant l’un de ces gènes, le gène T, encode pour la brachyurie qui est un facteur de transcription spécifique de la notochorde. En effet il est exprimé dans le noyau des cellules de la notochorde dont il est un facteur important du développement [236]. Il a même été démontré que la brachyurie est spécifiquement exprimée dans les chordomes alors qu’elle ne l’est pas dans plus de 40 autres types de néoplasme explorés, y compris dans les chondrosarcomes [145]. Yang et al. ont de plus confirmé en étude quantitative PCR, les duplications du gène T sur
Fig. 51. Forme dédifférenciée en IRM avec aspect hypodense en T2 (Patient du Dr Manzo) MRI features of a dedifferentiated chordoma with hyposignal in T2 (thanks to Dr Manzo).
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
34 Tableau 6 Formes familiales de chordomes. Family forms of chordomas. Références
Membres
Localisation
Âge
Foote et al. [237]
1 frère + 1 sœur
Sacrum
Âge moyen (?)
Enin [238]
2 frères
Nasopharynx
Jeunes (?)
Kerr et al. [239], (3 générations)
1 homme
Nasopharynx
?
1 mère 1 fille
Nasopharynx Nasopharynx
? ?
Chetty et al. [240]
1 enfant + ?
Clivus
3 ans
Stepanek et al. [234], (3 générations)
1 homme
Sacrum
28 ans
1 sœur 1 nièce 1 cousin
Nasopharynx Clivus Nasopharynx
39 ans 20 ans 31 ans
1 père
Nasopharynx
9 + 42 ans
1 fille 1 fille 1 fille
Multicentrique Astrocytome Clivus
25 ans 12 ans 17 ans
10 membres
68, 56, 46, 28, 39, 30, 35, 20, 16, 6 ans
1 homme 1 fille 1 neveu
9 clivus 1 sacrum 1 nasopharynx 9 histo, 1 IRM Clivus Astrocytome Clivus
2 sœurs, 3 cousins, 1 cousine
?
?
1 femme
Clivus
46 ans
1 sœur
Clivus
1 cousin + 6 membres
Clivus Clivus
7 ans, 5 récidives, décédé 25 22 ans ?
1 femme
Clivus + sacrum
1 grand-mère 1 père
Clivus Clivus
Dalprà et al. [241] + Miozzo et al. [232], (2 générations)
Kelley et al. [233] Korczak et al. [242], (3 générations) Yang et al. [235] ; [143]
Yang et al. [235] ; [143], (3 générations) Bhadra et Casey [231], (2 générations)
Bhadra et Casey [231], (3 générations)
les 4 des 7 familles positives et les ont validées en testant leurs absences sur 100 contrôles sains. Bien entendu puisque 3 familles ne présentent pas ces duplications, cette duplication du gène T ne serait pas le seul facteur de prédisposition à la survenue d’un chordome ; il faudrait alors imaginer des altérations d’autres gènes ou d’autres mécanismes génétiques (Tableau 6). 12. Métastases Les métastases s’observent avec une fréquence variable selon les séries, au cours de l’évolution des chordomes. Les chiffres varient de 7 à 43 % [243–245]. Leur existence est connue depuis fort longtemps puisque la première métastase rapportée, l’a été en 1919 par Potoschnig (cité par Markwalder et al. [246] dans leur revue de littérature de 1919 à 1978). Tous les auteurs insistent sur le fait que ce ne sont pas les métastases qui entraînent le décès du patient mais presque toujours la récidive locale. D’ailleurs, McPherson et al. rapportent un délai de survie des patients après chirurgie initiale, équivalent chez les patients avec et sans métastases (106 mois). On peut souligner aussi le fait que nombre de métastases sont asymptomatiques et ne sont découvertes que lors du bilan d’une récidive, voire après le décès lors de l’autopsie [244]. Le plus souvent les métastases sont observées après récidives. Cependant, Kamel et al. [247] en 2005 rapportent une métastase cérébrale découverte avant toute récidive. Il est exceptionnel
46 ans 17 ans 12 ans
3 puis 6 ans Récidive 19, décédé 22 32 ans Décédé à 55 ans
également que le chordome primitif soit découvert après les métastases. Lountzis décrit un cas de métastases cutanées multiples chez un enfant de 20 mois dont la biopsie a permis le diagnostic de chordome puis la mise en évidence par IRM d’un chordome du clivus. Cet enfant avait par ailleurs les stigmates d’une sclérose tubéreuse de Bourneville. Néanmoins, le plus souvent c’est après une ou plusieurs récidives et un délai parfois très long qu’apparaissent les métastases. Loehn et al. [252] rapportent 1 cas de métastase mandibulaire plus 4 autres de la littérature apparues entre 18 mois et 6 ans. Bergh et al. [245] observent 17 récidives et 11 métastases (28 %) dans une série de 39 cas de chordomes sacrés et rachidiens suivis en moyenne 8,1 ans ; dans cette étude, le délai moyen de découverte des métastases est de 6 ans, presque toujours après une récidive. Il indique que la survie moyenne lorsqu’une métastase est découverte est de 0,2 ans. Pour McPherson et al., l’estimation par la méthode de Kaplan-Meier de la survie moyenne après diagnostic d’une métastase de chordome est de 7,6 mois. Heffelfinger et al. [243], dans une série plus ancienne (1973), indiquent un délai moyen de survenue de 2 ans pour les chordomes vertébraux, 2,5 ans pour les chordomes sacrés et entre 3 et 4 ans pour ceux de la base du crâne. Le plus long délai que nous avons retrouvé dans la littérature est de 12 ans pour des métastases cutanées multiples après un chordome sacré [248]. Pour McPherson et al. [174], le délai moyen d’apparition des 7 métastases de sa série de 37 chordomes sacrés et rachidiens avec un suivi de 10 ans, est de 6 ans également. L’estimation de ce délai par méthode de Kaplan-Meier est de
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
143,4 mois. Dans cette série, toutes les métastases sont survenues chez des patients en récidive et représentent 28 % de ces patients en récidive. McPherson et al. [174] précisent que 2 métastases sont survenues après résection en bloc contre 5 après résection par fractionnement tumoral. York et al. [249] observent dans une série de 40 chordomes sacrés, 12 % de métastases après exérèse monobloc et 25 % après exérèse par fractionnement. C’est le seul facteur de risque de survenue de métastase (et aussi de récidive) qui sorte de l’analyse de ces séries ; tous les autres facteurs, y compris histologiques, sont sans influence. Dans la série de McPherson et al. [174], existent 3 chordomes dédifférenciés ; aucun d’entre eux ne s’est accompagné de métastases. Les métastases sont le plus souvent localisées au niveau du poumon [250], du foie, des os (humérus [251], mandibule [252,253], de la peau [254,248] et parfois des ganglions [255]). Dans la revue de littérature de Chambers et Schwinn [244] portant sur 70 cas, 58 % des métastases sont pulmonaires, 33 % ganglionnaires, 22 % hépatiques, 17 % osseuses et 9 % musculaires. Mais ont aussi été décrites des localisations beaucoup plus surprenantes comme le péritoine [256], le cœur [257], le rein [258] ou les ovaires [259], le sein [260], le cerveau [247]. Seulement 7 cas de métastases cérébrales ont été publiés, toutes sauf une dans un contexte de métastases multiples [247]. Les métastases s’observent nettement plus souvent à partir des chordomes sacrococcygiens (73 %) que des chordomes de la base du crâne (9 %) [244]. Dans la série de McPherson et al. (n = 37), 5 patients avaient un chordome sacré, 1 un chordome cervical et un autre un chordome lombaire. Pour Markwalder, cette prédisposition serait liée aux grosses veines pré-sacrées qui permettent une diffusion systémique facile. 13. Essaimage tumoral Le chordome comme nombre de tumeurs malignes peut essaimer et produire des localisations à distances de différentes fac¸ons. L’essaimage le plus fréquent se fait le long de la voie d’abord. Un
35
autre essaimage se fait le long des voies d’écoulement du LCR ce qui suppose un chordome intradural ou ayant un prolongement intradural. Enfin un essaimage peut se faire au travers d’une dérivation du LCR. 13.1. Essaimage le long de la voie d’abord chirurgical L’essaimage le long de la voie d’abord chirurgical est le plus classique. Toutes les séries un peu importantes en comportent un petit pourcentage. Par exemple, Arnautovic´ et Al-Mefty [261] en observent 6 sur 82 chordomes de la base du crâne opérés. Fischbein et al. [173] en retrouvent 3 sur 70 cas. Fagundes et al. [262] en 1995 estiment à 5 % la probabilité d’un essaimage chirurgical. C’est un chiffre qui peut paraître important mais qui s’explique aisément par la voie d’abord utilisée. Il s’agit en effet dans 90 % des cas d’une voie transnasale ou transsphénoidale, donc étroite, avec la possibilité fréquente que des instruments frottent sur les parois. Les localisations secondaires sont donc en général observées dans le nez ou dans l’ethmoïde. Le délai dans lequel sont découvertes ces pseudo-métastases varie de quelques mois à 4 ans après l’intervention. Ce délai est donc nettement plus court que le délai moyen d’observation des véritables métastases qui est de 6 ans [245]. 13.2. Essaimage le long des espaces sous-arachnoïdiens L’essaimage le long des espaces sous-arachnoïdiens est également possible dans le cas de chordomes avec contingent intradural (Fig. 52). Il semble que cette occurrence ait été rapportée pour la première fois en 1954 par Holzner [263]. Depuis nous en avons colligé 10 autres cas. Tous les chordomes étaient initialement localisés au clivus sauf un au niveau de l’angle pontocérébelleux. Il s’agissait de 8 hommes et 2 femmes (un des cas n’est pas précisé). L’âge variait de 6 ans à 69 ans (moyenne : 46 ans). La dissémination se fait le plus souvent sur les racines de la queue de cheval (5 sur 8 connus, 2 sur le cône médullaire et 1 dans la région cervico-dorsale). Il faut
Fig. 52. Dissémination au long des espaces sous-arachnoïdiens au niveau de la queue de cheval. Seeding along the subarachnoid spaces at the level of the cauda equina. D’après Champeaux et al. [271] ; publié avec l’autorisation d’Elsevier-Masson SAS.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
36 Tableau 7 Essaimage le long du LCR. Seeding along the LCR. Références
Âge/sexe
Site initial
Site à distance
Délai
Holzner [263] Stough et al. [264] Plese et al. [265] Marigil et al. [266] Raffel et al. [267] Krol et al. [268] Forsyth et al. [269] Korinth et al. [74] Asano et al. [270] Champeaux et al. [271] Martin et Olson [272]
59/M 41/M 6/F 44/M 40/M 41/M ? 48/F 53/M 59/M 69/M
Clivus Clivus Clivus Clivus Clivus Clivus Clivus CPA Clivus Clivus Clivus
Cauda equina Th12-L1 ? ? Multiple (1) Cervical(2) Lombaire C7-Th1 Thoracolombaire Th4, 8, 9 et lombosacré Racine S1 Cauda equina
Autopsie 5 ans Autopsie Simultané 7 mois 1 an 2 ans ? ? 11 ans 6 ans ?
noter que 3 ont des localisations multiples : 1 cervical et lombaire, 1 dorsal (Th4, 8, 9) et lombosacré et un non précisé. Le délai de découverte de la ou des localisations à distance varie de 7 mois à 11 ans (moyenne : 4,3 ans). L’une d’entre elles a été diagnostiquée simultanément à la lésion du clivus. Deux disséminations par le LCR n’ont été identifiées qu’à l’autopsie. 13.3. Essaimage au travers d’une dérivation ventriculo-péritonéale Enfin, l’exceptionnel essaimage au travers d’une dérivation ventriculo-péritonéale n’a semble-t-il été observé qu’une seule fois par Figueiredo et al. [81] en 2011. Il a été mentionné plus haut dans le chapitre des chordomes intraduraux. En fait, c’est sur la récidive intracrânienne associée à une masse intrapéritonéale autour du cathéter, que le diagnostic de germinome initialement posé 16 ans plus tôt a été rectifié en faveur du chordome (Tableau 7). 14. Formes malignes ou dédifférenciées Le chordome peut se présenter sous 3 formes histologiques principales : classique ou conventionnelle, chondroïde et dédifférenciée. Cette dernière forme correspond à une forme conventionnelle dans laquelle des zones subissent une transformation en lésion de haute malignité de type variable : histiofibrome, fibrosarcome ou plus rarement ostéosarcome ou rhabdomyosarcome [273] (Fig. 51). Cette forme maligne ou sarcomateuse du chordome est rare ; depuis la première description par Debernardi en 1913 [274] environ 50 cas avaient été rapportés en 1987. Elle représenterait environ 1 % de tous les chordomes [275] et serait plus fréquente à la base du crâne qu’au niveau du sacrum [269,275]. Le chordome dédifférencié s’observe le plus souvent après une ou plusieurs récidives mais il est parfois présent d’emblée lors du diagnostic initial (formes primaires). Il a aussi été suggéré que la radiothérapie favorisait cette transformation maligne mais cela n’a jamais été clairement démontré [276,277,560]. Pour Morimitsu et al. [276], les chordomes dédifférenciés comportent une démarcation nette entre les zones conventionnelles et malignes, alors que lorsque existent des zones transitionnelles, le diagnostic de chordomes sarcomatoïdes serait plus adapté. Quelle que soit la forme, le pronostic est mauvais avec la survenue de métastases et une issue fatale chez la majorité des patients en moins d’un an [274,276,278–282]. Comme toujours il y a des exceptions ; ainsi l’un des cas rapportés par Meis et al. [274] présentait une petite zone dédifférenciée sur un mode osteosarcomateux et le patient survécut 76 mois. Hanna et al. rapportent 4 cas primaires sur une série de 29 cas (proportion tout à fait inhabituelle), dont l’un a survécu 63 mois. Inversement deux autres de ses patients sont décédés 7 et 9 mois après le traitement initial. Le quatrième est vivant sans récidive à un an. Hanna et al. font un lien entre le pronostic et l’importance du contingent dédifférencié. De plus il considère que
ce contingent dédifférencié peut être identifié en IRM. En effet dans un chordome conventionnel, la tumeur apparaît en hypersignal en T2 ; dans 3 de ses 4 cas, les zones indifférenciées sont clairement visibles car elles apparaissent en hyposignal au milieu des zones classiques, en hypersignal (Fig. 51). Cela semble avoir été démontré initialement par MacSweeney et al. [283]. Saifuddin et al. [284] utilisent cette information pour guider la biopsie. On retrouve là l’un des problèmes de l’analyse histologique et pronostique lié à la grande hétérogénéité de la masse tumorale qui peut comprendre de multiples secteurs très différents. Il a été de plus démontré que les compartiments tumoraux conventionnels restaient positifs pour la cytokératine 19 et la brachyurie alors que les zones dédifférenciées ne l’étaient plus, ce qui confirme bien la perte des caractéristiques du chordome et sa transformation en un autre type tumoral. Il est clair que la mise en évidence de zones dédifférenciées en préopératoire doit conduire à une exérèse la plus complète possible, voire monobloc ; sa confirmation histologique doit faire pratiquer systématiquement une radiothérapie complémentaire qui peut parfois se discuter après exérèse monobloc dans les formes classiques. Certains ont même proposé dans ces formes malignes une chimiothérapie adjuvante avant la radiothérapie [199,285]. 15. Épidémiologie Le chordome est globalement une tumeur très rare. Son incidence varie selon les études de 0,5 à 8 par million d’habitants et par an [286–288]. Ceci représenterait donc pour la France entre 30 et 480 nouveaux cas par an mais la vérité est probablement plus près du chiffre inférieur. Le registre américain (SEER) portant sur 400 cas observés en 22 ans (1973–1995) indique une incidence de 0,08 pour 100 000 [286], 0,08 chez les sujets de race blanche, 0,02 chez les sujets de race noire et 0,07 chez les autres (essentiellement asiatiques). Pour Mukherjee et al. [289,290] en 2011, 91,2 % des 414 chordomes rassemblés sur le même registre (SEER) sont de race blanche, 6,3 % asiatiques et 2 % afro-américains. Le chordome représente de 1 à 4 % des tumeurs osseuses malignes primitives [64,291]. Il compte pour 0,4 % des tumeurs primitives intracrâniennes dans le registre japonais (Kawaze) et pour 0,1 à 0,2 % des tumeurs de la base du crâne [292,293]. Dans l’étude coopérative de Fuentes et Benezech [294] de 1989 portant sur 206 tumeurs osseuses primitives du rachis, le chordome est la lésion prédominante chez l’adulte et la 4e chez l’enfant de moins de 15 ans. Le chordome est la 3e tumeur la plus fréquente en cervical mais la première en C1-C2 (suboccipital segment). Dans cette étude, le chordome compte pour 17 % de toutes les tumeurs osseuses primitives du rachis. En 2007, Kelley et al. [295] ont publié une revue de 2750 tumeurs osseuses primitives colligées dans le registre de Leeds (Leeds regional bone tumor registry) pendant 48 ans (1952–2000) en provenance de neurochirurgiens, d’orthopédistes et d’oncologistes. Seules 126 d’entre elles étaient
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
localisées sur le rachis avec le chordome comme tumeur la plus fréquente après le myélome et avant l’ostéosarcome. Considérant que la population sur laquelle a porté cette étude était de 3,5 millions d’habitants, cela voudrait dire que la France, environ 20 fois plus peuplée, aurait eu sur la même période 2520 tumeurs osseuses primitives du rachis et donc 60 nouveaux cas par an ; le chordome représentant 25 % environ des tumeurs osseuses, ce serait seulement 15 nouveaux cas qui seraient observés par an. Mukherjee et al. rassemblent 1892 tumeurs osseuses primitives malignes du rachis sur 30 ans (1973–2003) [290]. Le chordome (414 cas) vient en 4e position après le chondrosarcome (579 cas), le sarcome d’Ewing (469 cas) et l’ostéosarcome (430 cas). La distribution de la localisation est classiquement la suivante : 50 % sacrococcygienne, 35 % sphéno-occipitale et 15 % rachidienne depuis les publications de la Mayo Clinic par Heffelfinger et al. [243] et Dahlin [275] portant sur 282 cas. D’autres séries ont rapporté des chiffres identiques [288,296,297]. Mais ces rapports varient beaucoup en fonction du mode de recrutement. Dans le SEER report, il s’agit de registres par état colligeant la totalité des cas ; pour cette étude, la distribution est à peu près équivalente entre les trois principaux sièges du chordome : 29,2 % (117) au niveau du sacrum, 32 % (128) en intracrânien et 32,8 % (131) au niveau spinal. Sur l’ensemble des localisations il y aurait une légère prédominance masculine, (60 % d’hommes) avec une incidence à 0,1 pour 100 000 chez les hommes contre 0,06 chez les femmes. La localisation crânienne s’observe plutôt chez la femme (39 % contre 23,4 % pour les sacrées et 31,5 % pour les rachidiennes). Inversement l’homme a plutôt des localisations sacrées et rachidiennes, 33,2 et 33,6 % contre 27,7 % pour les localisations crâniennes. L’âge médian au moment du diagnostic est de 58,5 ans avec des extrêmes de 3 à 95 ans pour McMaster qui précise qu’il existe une augmentation progressive de l’incidence avec l’âge, le pic se situant pendant la 8e décade. Pour Mukherjee, c’est le chordome qui a l’âge moyen de diagnostic le plus élevé comparativement aux trois autres tumeurs osseuses les plus fréquentes : 59,9 ans pour le chordome (médiane : 62 ans), 50,8 pour le chondrosarcome (médiane : 50 ans), 48,3 pour l’ostéosarcome (médiane : 51 ans) et 19,2 pour le sarcome d’Ewing (médiane : 17 ans). D’une fac¸on globale, le chordome est rare chez le sujet jeune de moins de 40 ans (incidence : 0,2 par million) et encore plus en dessous de 10 ans. Pour McMaster, seulement 77 des 374 cas recensés (20,5 %) ont moins de 40 ans. L’ensemble des auteurs souligne que l’enfant représente environ 5 % de la totalité des chordomes. Bien que dans le registre SEER, le nombre de chordomes chez le sujet noir soit très petit (n = 9), il faut noter que 7 d’entre eux ont moins de 40 ans ; dans ce groupe de patients la médiane pour l’âge est à 27 ans contre 59 ans chez les sujets blancs. Le quartile d’âge le plus jeune comprend une majorité de chordomes crâniens (54,5 %) alors que le quartile le plus vieux a plutôt des chordomes sacrés (41,3 % contre 15,2 % crâniens). L’âge moyen des chordomes crâniens est de 49 ans contre 69 ans pour les chordomes sacrés. Enfin 25,8 % des chordomes crâniens ont moins de 35 ans ce qui n’est le cas que pour 7,7 % des chordomes sacrés. Sans doute est-il plus parlant de dire que dans cette étude portant sur 400 cas, seulement 2 des 117 chordomes sacrés ont entre 3 et 25 ans (1,7 %), 18 entre 26 et 48 ans et 97 au-delà de 49 ans (82,9 %) ; à l’inverse parmi les 128 chordomes crâniens, 18 ont entre 3 et 25 ans (14 %), 44 entre 26 et 48 ans et 66 plus de 49 ans (51,5 %). On aurait pu penser que l’incidence des chordomes s’est modifiée avec l’évolution des techniques histologiques et notamment de l’utilisation de l’immuno-histochimie qui permet maintenant de faire clairement la séparation entre chordomes et chondrosarcomes. En fait dans l‘étude de McMaster, l’incidence augmente modérément de 1973 à 1995 (de 0,6 à 0,8 pour 1 000 000) plus
37
probablement du fait des progrès de l’imagerie et donc de la détection des tumeurs. L’histoire naturelle des chordomes sans traitement est difficile à préciser mais la survie depuis le diagnostic est estimée inférieure à 2 ans. Dans la série McMaster, 97 % ont rec¸u un traitement, 48,5 % par chirurgie seule, 37,8 % par chirurgie plus radiothérapie sous une forme ou une autre et 13 % par radiothérapie isolée, le plus souvent proposée chez les sujets âgés et pour les localisations sacrées. La survie moyenne tous sexes, âges et localisations confondues est de 6,29 ans ; elle est un peu plus longue chez la femme que chez l’homme (7,25 contre 5,93 années) mais de fac¸on non significative. De même il n’y a pas de différence significative en termes de survie selon les localisations : 5,88 ans pour le rachis mobile, 6,48 pour le sacrum et 6,94 pour le crâne. On observe un pronostic un peu meilleur des chordomes crâniens chez la femme par rapport à l’homme mais là encore non significatif (7,7 ans contre 6,42). La survie relative à 5, 10, 15 et 20 ans, c’est-à-dire le rapport du taux de survie des chordomes par rapport à celui de la population générale de même sexe, âge et race est de 67,6, 39,9, 39,2 et 13,1 %. Là encore, il n’y a pas de différence selon la localisation : 64,7 % pour les chordomes crâniens à 5 ans, 67,2 % pour les rachidiens et 73,6 % pour les sacrés ; Il en est de même pour l’âge : la survie à 5 ans est de 62,1 % avant 25 ans, 44,1 % entre 25 et 48 ans, 69,2 % entre 49 et 71 ans et 50,7 % au-dessus de 71 ans. Enfin même conclusion pour le sexe ; chez les hommes la survie à 5,10 et 15 ans est de 65,1, 38 et 34,5 % alors que chez les femmes elle est de 71,4, 43,4 et 50,5 %. Les études chez l’enfant sont rares compte tenu de l’incidence très faible du chordome chez le sujet jeune. En 2010, Ridenour et al. [298] ont repris l’ensemble de la série de chordomes de la Mayo Clinic de 1910 à 2006. Parmi les 449 cas observés, seulement 35 ont moins de 25 ans (7,5 %). En fait, il s’agit d’enfants et de jeunes adultes dont le plus jeune a 8 ans ; la moyenne se situe à 17,3 ans. Il n’y a donc aucun très jeune patient (moins de 5 ans) dont plusieurs auteurs disent que leur pronostic est très mauvais [245,299–302]. À l’inverse, celui des enfants plus âgés et des jeunes adultes est meilleur que celui des adultes en général [303,304]. La série de la Mayo Clinic compte 18 garc¸ons et 17 filles répartis en 66 % sphéno-occipitaux, 20 % spinaux et 14 % sacrococygiens. Le taux de survie est de 63 % avec un suivi moyen de 10 ans et demi avec des extrêmes allant de 1 mois à 42 ans. Les auteurs notent 3 métastases (9 %). La survie est la meilleure pour les localisations rachidiennes (86 %) devant les crâniennes (65 %) et les sacrées (20 %). Ils mettent en parallèle la localisation et l’histologie, observant que tous les chordomes sacrés sont des formes atypiques, alors que la plupart des chordomes crâniens (74 %) sont des formes conventionnelles. L’un des problèmes de cette série est son hétérogénéité du simple fait de la longueur de la période d’observation (96 ans). Deux autres études, l’une par Borba et al. [299] en 1996 et l’autre par Hoch et al. [304] en 2006, ne rapportent que des localisations crâniennes. La série de Borba et al. est une revue de littérature des chordomes de moins de 21 ans comportant 75 patients auxquels ils ajoutent 4 cas personnels, observés là encore sur une longue période de temps : 1923–1995. On y compte 46 % de patients de sexe féminin et 54 % de sexe masculin. L’âge moyen est de 10 ans, le suivi moyen de 39 mois (1 à 300 mois) avec une survie de 56,8 %. Cette étude insiste beaucoup sur les différences histologiques observées dans cette catégorie de population qui rendraient compte des différences de pronostic. Les chordomes classiques (histologie conventionnelle) sont différenciés des chordomes chondroïdes (avec des aspects chondromateux) et des chordomes atypiques. Leur population globale se décompose en forme classique : 64,6 %, chondroïde : 13,5 % et atypique : 22,4 %. Globalement, tous les chordomes atypiques sont décédés contre 37,5 % des chondroïdes et 23,1 % des classiques. Si on considère ensuite le groupe d’enfants de moins de 5 ans (21 sur 75), on
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 38
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
observe 35 % de formes classiques, 65 % de formes atypiques et aucun chordome chondroïde. La localisation de ce groupe d’âge est essentiellement au niveau du clivus (19 sur 21) ; un est du nasopharynx ; le dernier est appelé « de la base du crâne ». La survie moyenne est de 31,5 % pour un suivi moyen de 25,5 mois. Tous les patients ayant une forme atypique sont décédés dans un délai moyen de 6,6 mois avec des extrêmes de 3 à 18 mois. En revanche tous ceux ayant une forme classique sont vivants dans un délai de 68 mois en moyenne (6–170 mois). Dans ce groupe âgé de moins de 5 ans, 11 patients sur 19 (58 %) ont présenté des métastases le plus souvent pulmonaires ou osseuses ; tous ces patients avaient une forme histologique atypique. Considérant maintenant les chordomes âgés de 5 à 20 ans, 85 % étaient localisés au niveau du clivus, 11 % dans la région parasellaire et 4 % dans le nasopharynx. Sur le plan histologique, les formes classiques sont prépondérantes (78,7 %) ; les formes chondroïdes comptent pour 17,1 % ; les formes atypiques sont finalement rares (4,2 %). Le suivi moyen est de 44,2 mois (1–300 mois) avec une mortalité de 34,5 % dans l’ensemble du groupe, de 18,7 % pour les formes classiques dont le suivi moyen est de 61,2 mois, 37,5 % pour les chordomes chondroïdes avec un suivi moyen de 67,8 mois et 100 % pour les atypiques. On n’observe des métastases que dans seulement 8,5 % des cas. Il apparaît clairement dans cette série qu’il existe un pronostic radicalement différent (mortalité et métastases) entre le groupe d’enfants de moins de 5 ans et ceux de 5 à 20 ans et que cette différence s’explique par la très forte proportion de formes atypiques de chordomes. Dans la série de Hoch et al. [304] sont rassemblés 73 cas de chordomes chez des enfants de moins de 18 ans observés au Massachusets General Hospital entre 1981 et 2003 soit 3,3 cas par an en moyenne. L’âge moyen est de 9,7 ans (1–18 ans) avec une distribution en faveur du sexe féminin (58 %). Dans cette série, on distingue les formes conventionnelles (classiques) majoritaires (58 %), les formes chondroïdes (23 %) et les formes cellulaires (19 %). Ces formes cellulaires comportent une forte densité cellulaire mais pas de matrice myxoïde ni d’architecture lobulée ; parmi ces formes cellulaires, les auteurs identifient 6 cas (8 %) qu’ils qualifient de faiblement différenciés ; la caractéristique principale est l’absence de vacuolisation cytoplasmique et de cellules physaliphores. On peut les rapprocher des formes atypiques de la série de Borba et al. Ils n’observent aucune forme non différenciée. Tous les malades ont été traités de fac¸on comparable, par chirurgie plus protonthérapie postopératoire. Le suivi moyen est de 7,25 ans (1–21 ans) avec une survie de 81 % pour l’ensemble de la série. Il y a 14 décès (9 de sexe féminin) parmi lesquels 5 des 6 formes faiblement différenciées dont 2 avec métastases pulmonaires. Le sixième patient avec forme faiblement différenciée est vivant un an après son diagnostic, mais avec des métastases lymphatiques cervicales. Les 9 autres décès sont des formes conventionnelles (6 cas, 14 %) dont un cas avec des aspects rhabdoïdes et des formes chondroïdes (3 cas, 18 %). Aucun décès n’est constaté dans les formes cellulaires. À titre de comparaison, les auteurs indiquent une mortalité de 55 % à 5 ans dans leur série de 125 adultes porteurs de chordomes de la base du crâne et traités de fac¸on similaire (chirurgie plus protons). On retrouve donc le mauvais pronostic des formes faiblement différenciées que l’on peut rapprocher des formes atypiques de la série de Borba et al. Les auteurs soulignent cependant, d’une part, la différence importante avec des formes d’aspect très voisin qu’ils appellent cellulaire et, d’autre part, le fait qu’aucun paramètre histologique sauf peut-être la nécrose, tel que l’aspect chondroïde, l’activité mitotique, l’atypie cytologique, ou le développement vasculaire n’est prédictif du pronostic dans les autres formes de chordomes et notamment de la survie. Ceci est plutôt surprenant si l’on observe que les formes faiblement différenciées comportent ces mêmes paramètres en quantité importante.
Ils constatent aussi que comme chez l’adulte le pronostic des formes conventionnelles et chondroïdes n’est pas significativement différent. Comme dans la série de Borba et al., Hoch relève que ces formes faiblement différenciées sont rencontrées chez les sujets très jeunes : 4,8 ans en moyenne avec un seul cas ayant plus de 5 ans et que les métastases y sont fréquentes (3 des 6 cas). Au final il déplore que les aspects histologiques de ces formes atypiques ne soient pas standardisés et que leur définition puisse varier d’un auteur à l’autre. 16. Radiothérapie (C.-H. Canova, F. Riet, S. Bolle, V. Calugaru, R. Dendale, J.-J. Mazeron, L. Feuvret) 16.1. Introduction Le défi thérapeutique pour les chordomes de la base du crâne est liée à la localisation anatomique en raison de la présence de nombreuses structures nobles alentours (vaisseaux, nerfs, tronc cérébral, moelle épinière). La première phase thérapeutique est neurochirurgicale et maximaliste afin de réduire le volume tumoral et de créer un espace suffisant entre la tumeur et les structures à risque afin d’optimiser l’irradiation [305]. Cette dernière est systématiquement recommandée afin d’améliorer le contrôle local. À ce jour, la protonthérapie reste la technique de radiothérapie de référence pour ces tumeurs nécessitant de hautes doses et situées dans une zone à haut risque de complications [306]. Parallèlement, grâce aux innovations technologiques en radiothérapie, de nouvelles méthodes d’irradiation sont en cours d’évaluation pour cette indication. D’autres modalités de radiothérapie telles que la radiothérapie stéréotaxique par Gammaknife ou Cyberknife avec de faibles effectifs montrent des résultats intéressants en termes de contrôle local mais il est difficile de proposer un arbre décisionnel précisant l’indication de ces techniques si différentes [307]. Dans cette revue, nous allons décrire ces différentes modalités dans la stratégie globale de prise en charge du chordome de la base du crâne. 16.2. La complémentarité entre le neurochirurgien et le radiothérapeute Le chordome est une tumeur à tropisme principalement locorégional ayant tendance à récidiver localement et possédant un pouvoir métastatique relativement faible [308]. Le traitement de référence comporte une chirurgie suivie systématiquement d’une radiothérapie. La difficulté de ce traitement est directement lié aux contraintes que pose la proximité immédiate des structures neurologiques et vasculaires Aussi, outre le contrôle local, la gestion préventive des effets secondaires liés au traitement est primordiale. Cette prise en charge reste donc aujourd’hui un défi pour les neurochirurgiens et les radiothérapeutes, même avec le développement de la microchirurgie et des nouvelles méthodes d’irradiation. Une exérèse macroscopiquement complète est obtenue dans 62 à 79 % mais l’imagerie postopératoire révèle souvent des reliquats [309]. Même dans les cas où celle-ci semble complète, les taux de rechute sont élevés, de l’ordre de 12 à 60 % [309,310]. La chirurgie première est fondamentale et ses objectifs sont triples : réduction maximale du volume tumoral, prévention des effets secondaires, et création d’un espace suffisant (idéalement de quelques millimètres) entre la lésion et les organes critiques de voisinage. Après l’intervention, le radiothérapeute est partagé entre le fait de délivrer une dose tumoricide au chordome et de respecter les contraintes de dose appliquées aux structures à risque avoisinantes. Le différentiel de dose est souvent important. Par exemple, si le chordome (dose prescrite 73,8 Gy) est en contact avec le tronc
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
cérébral (dose maximale tolérée : 64 Gy), la dose minimale rec¸ue par la tumeur est la dose maximale tolérée par la structure à risque. Par conséquent, une partie de la tumeur est sous-dosée avec un risque de rechute dans cette zone [311]. Si un espace est créé entre la tumeur et l’organe à risque, alors le risque de sous-dosage diminue et ceci d’autant plus que la distance est grande et le gradient de dose du rayonnement utilisé est élevé (distance millimétrique pour passer de 20 % à 80 % de la dose délivrée). De ces données, il apparaît clairement que la collaboration entre le neurochirurgien et le radiothérapeute est très importante. La série du centre de protonthérapie d’Orsay a démontré que les facteurs pronostiques du contrôle local étaient la dose minimale rec¸ue par la tumeur (imposée par les structures à risque de voisinage) et la proportion de la tumeur recevant la dose prescrite [311]. Le volume postopératoire (volume seuil de 25 mL) n’apparaît pas comme un facteur pronostique évident du contrôle local dans la série de l’institut Paul Scherrer en Suisse (centre de protonthérapie) [312]. Afin de répondre à ces prérogatives, certaines équipes chirurgicales usent d’une attitude « agressive » avec la réalisation de plusieurs temps opératoires à voies d’abord variées pour obtenir une réduction tumorale optimale, et l’associe parfois à un comblement de la perte de substance par l’interposition de graisse [313], malgré le risque d’ensemencement des greffons décrits par certains [261]. 16.3. Radiothérapie des chordomes 16.3.1. Radiothérapie par photons Devant les taux de rechute élevés obtenus après une chirurgie exclusive, il a été initialement proposé une irradiation adjuvante par photons. La survie sans progression était toujours inférieure à 40 % dans les séries, avec des taux aussi bas que 17 %. La proximité des organes à risque par rapport à la tumeur et les propriétés balistiques des photons empêchaient de délivrer des doses supérieures à 60 Gy au niveau de la tumeur, ce qui impactait directement le contrôle local comme ceci apparaît dans le Tableau 8. 16.3.2. Hadronthérapie Le terme d’hadron, dérivé du grec « ␣␦о␥ », signifie « force ». Les hadrons sont composés de quarks (particules élémentaires du noyau). Le terme hadron est utilisé en radiothérapie pour les protons et les neutrons qui sont les constituants des noyaux et par extension pour les noyaux atomiques légers comme les atomes hélium, oxygène, carbone, connus aussi sous le terme de « ions légers » ou « ions lourds » pour le néon et l’argon [318]. À ce jour, les protons sont utilisés en routine et les ions Carbone sont en cours d’évaluation dans deux uniques centres : à Chiba au Japon et à Darmstadt en Allemagne. 16.3.3. Utilisation des protons 16.3.3.1. Aspect clinique. Les premières études cliniques d’irradiation par des protons remontent aux années 1950 suite à la découverte de leurs propriétés physiques. L’utilisation des protons est justifiée par leurs caractéristiques physiques et non biologiques. Leur effet biologique est quasi identique à celui des photons. La protonthérapie permet d’augmenter la dose dans la tumeur et d’épargner au maximum les organes critiques avoisinants grâce aux données balistiques de ces particules [311]. En raison de leur masse élevée, ces dernières diffusent très faiblement latéralement en dehors du faisceau. Lors de leur parcours, les particules de protons déposent une quantité croissante d’énergie pour s’arrêter brutalement en fin de trajectoire (appelé pic de Bragg). Cette particularité physique est fondamentale pour expliquer le gradient de dose qui peut être obtenu à proximité d’un organe critique. La dose varie de 10 à 15 % par millimètre de tissu traversé [311]. Les protons ont en effet permis une augmentation de la dose totale, une meilleure conformation des isodoses à la tumeur, et une
39
meilleure protection des tissus sains. Il a alors été montré que le contrôle local était amélioré et le risque de toxicité acceptable dans de très nombreuses séries. C’est pourquoi, depuis plusieurs années, l’irradiation par protons est devenue la technique d’irradiation de référence dans la prise en charge des chordomes de la base du crâne après chirurgie [306]. Les taux de survie sans progression étaient de 58 à 78 % à 5 ans (Tableau 9). 16.3.3.2. Tolérance de la protonthérapie. Les contraintes de dose appliquées aux organes à risque sont bien établies aujourd’hui pour la majorité des structures. Il peut arriver selon la topographie de la lésion tumorale, que l’hypophyse et l’oreille interne homolatérale à la tumeur ne soient pas protégées. Puisqu’un traitement substitutif peut être proposé en cas de toxicité (hormonal, auditif), la priorité est appliquée à la qualité de l’irradiation de la tumeur et non pas à la protection de ces deux structures. Ce raisonnement ne s’applique pas aujourd’hui aux autres structures nobles alentours. Aujourd’hui, les séries de protonthérapie sont les plus nombreuses, et le recul en termes de suivi des patients est le plus conséquent. Les effets secondaires tardifs de la radiothérapie (par définition, 6 mois après la fin de la radiothérapie et pouvant survenir des années plus tard de fac¸on imprévisible) commencent à être bien décrits. 16.3.3.3. Tolérance encéphalique temporale. En raison de la localisation du chordome, les régions temporales et les régions hippocampiques sont systématiquement irradiées à des niveaux de dose variables. Leur atteinte peut se manifester par une altération des fonctions neuropsychiques telles que la mémoire, les émotions et l’apprentissage. L’étude de Santoni et al. [327], comportant 96 patients, a montré des taux de complications neuropsychiques, respectivement à 2 et 5 ans, de 8 et 13 % pour ce type de traitement. L’étude de Glosser et al. [328], portant sur 17 patients irradiés jusqu’à 66 Gy ECO pour des tumeurs de la base du crâne, n’a retrouvé aucun effet secondaire cognitif précoce ou tardif ni de nécrose temporale chez les patients qui ne présentaient pas de récidive. Les résultats rapportés sont très variés, dépendant du nombre de patients, du suivi, des critères d’évaluation utilisés. À ce jour, aucune donnée dosimétrique n’est disponible pour proposer des recommandations en termes de contraintes de dose pour les lobes temporaux [329]. 16.3.3.4. Tolérance du tronc cérébral et de la moelle épinière. Debus et al. [330] ont étudié la tolérance du tronc cérébral chez 367 patients traités pour un chordome ou un chondrosarcome. Dixsept cas ont présenté une toxicité attribuable à l’irradiation avec une symptomatologie comportant différents tableaux de paralysies sensitivomotrices selon le niveau d’atteinte lésionnel. Quatrevingt-dix pour cent des patients souffraient de ces troubles dans les trois ans suivants l’irradiation. Parmi les trois patients décédés directement de cette complication, la symptomatologie avait débuté après 30 mois et le délai entre l’apparition des symptômes et le décès a été d’environ cinq mois. L’analyse de cette étude a permis de mettre en avant plusieurs facteurs pronostiques de cette complication : une dose d’irradiation supérieure à 60 GyECo dans plus de 0,9 cc de tronc cérébral, un antécédent de diabète et le nombre d’interventions chirurgicales antérieures à l’irradiation. Pour la moelle épinière, une analyse dosimétrique a étudié les histogrammes doses volumes et l’homogénéité de la dose chez 85 patients présentant une tumeur vertébrale cervicale. L’étude a montré 13 complications sensitivomotrices médullaires de grade 1–2 et quatre complications de grade 3 pour des doses au centre et à la surface de la moelle de respectivement, 55 à 58 GyECo et 67 à 70 GyECo. L’analyse multivariée a montré qu’aucun paramètre dosimétrique n’était associé à un risque surajouté de lésion médullaire. Le seul facteur significatif de lésion médullaire a été le nombre d’interventions chirurgicales [331].
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
40 Tableau 8 Séries d’irradiations des chordomes par photons. Photon irradiation of chordoma. Séries
Nombre de patients
Type de radiothérapie
Dose en Gy
Médiane de suivi en années
Survie globale à 5 ans ± 10 ans
Survie sans progression (%)
Magrini et al. [314] Forsyth et al. [269] Romero et al. [315] Catton et al. [316] Zorlu et al. [317]
12 39 18 24 18
Photons seuls Photons seuls Photons seuls Photons seuls Photons seuls
58 50 50,1 50 60
6 8,3 3,1 5,2 3,6
58 et 35 % respectivement 51 et 35 % respectivement 38 % Médiane de survie à 62 mois 35 %
25 39 17 23 23
Pour les deux structures évoquées ci-dessus, le nombre de chirurgies apparaissait comme un facteur de risque de toxicité. Il se pose toutefois la question du contexte de ces chirurgies : soit des chirurgies multiples suite à de multiples récidives non irradiées, soit une stratégie globale chirurgicale avec plusieurs voies d’abord afin d’obtenir une exérèse optimale avant une irradiation. Dans ce dernier cas, il semble que le gain apporté par la qualité de la chirurgie, même en plusieurs temps, soit supérieur aux risques de cette pluralité chirurgicale. A contrario, les gestes répétés en raison de l’absence d’une irradiation postopératoire immédiate sont à l’évidence plutôt délétère. 16.3.3.5. Tolérance hypophysaire. Pai et al. [332] ont étudié les complications endocriniennes chez 107 patients traités pour des tumeurs de la base du crâne avec des protons. Les endocrinopathies radio-induites ont été évalués respectivement à cinq et dix ans, avec 72 et 84 % d’hyperprolactinémie, 30 et 63 % d’insuffisance thyroïdienne, 29 et 36 % d’hypogonadisme, et 19 et 28 % d’hypocorticisme. Les doses supérieures à 50 GyECo au niveau du système hypothalamo-hypophysaire et 70 GyECo dans la glande hypophysaire semblaient être des facteurs de risque de ces complications. Aucun trouble de la fonction post-hypophysaire de type diabète insipide n’a été décrit. 16.3.3.6. Tolérance des voies optiques. Les voies optiques sont aussi des organes radiosensibles, souvent placés à proximité ou au contact de la lésion tumorale. Habrand et al. [333] ont montré que le taux de complications visuelles chez 20 patients atteints de tumeurs au niveau du clivus, était de l’ordre de 10 % pour une dose de 55 GyECo et de plus de 20 % pour des doses délivrées aux nerfs optiques ou au chiasma optique supérieures à 60 GyECo. Ceci souligne l’apport majeur d’une chirurgie optimale dans cette région pour limiter le volume résiduel postopératoire à proximité ou tout du moins au contact. 16.3.3.7. Tolérance cochléaire. La surdité radio-induite est une complication souvent décrite [334]. Cependant, les critères sont rarement définis. Schoenthaler a montré que pour deux tiers des patients qui ont souffert d’une perte auditive, l’oreille interne avait
rec¸u une dose d’irradiation supérieure à 62,7 GyECo. Une atteinte de la cochlée homolatérale à la tumeur relève certainement plus de la nécessité de traiter au mieux la tumeur et alors de l’impossibilité de protéger la cochlée que de la notion de toxicité (non souhaitée) par elle-même. 16.3.3.8. Tolérance des nerfs crâniens. À partir d’une analyse dosimétrique, Urie et al. [334] ont utilisé un système de planification en trois dimensions, pour étudier les complications nerveuses chez 27 patients et 594 structures nerveuses délinéées. Ils ont retrouvé seulement 17 souffrances nerveuses chez cinq patients. Le risque de complications était de 1 % à 60 GyECo et de 5 % à 70 GyECo. 16.3.4. Utilisation du carbone L’utilisation des ions carbone représente une modalité intéressante. En effet, ils possèdent les avantages physiques des protons (pic de Bragg) et une efficacité biologique relative supérieure, intéressante pour les tumeurs radio résistantes. Des résultats prometteurs ont été obtenus au Japon et en Allemagne. Mais cette technologie reste expérimentale et peu disponible dans le monde. En Allemagne, 96 patients atteints de chordomes de la base du crâne avec un résidu macroscopique postopératoire important ont été irradiés par ions Carbone à la dose de 60 GyECO délivrés en 20 fractions sur une période de 3 semaines. Avec un suivi médian de 31 mois, 15 patients ont présenté une récidive, le taux de contrôle local à 5 ans était de 70 % et la survie globale de 88,5 % à 5 ans. En termes de toxicité tardive, 4,1 % des patients ont présenté une neuropathie des nerfs crâniens de grade 3 et 7,2 % ont présenté une encéphalopathie temporale de grade 1–2. La dose délivrée par les ions carbones est biologiquement équivalente à un dose égale ou supérieure à 75 Gy equivalent cobalt et semble augmenter le contrôle local [307]. Un intérêt particulier est à porter dans l’avenir sur ce type de traitement en termes d’efficacité au long cours mais aussi en termes de toxicité, pour laquelle les données sont encore éparses. 16.3.5. Radiothérapie en conditions stéréotaxiques 16.3.5.1. Radiothérapie par Gammaknife. Le Gammaknife est un système d’irradiation dédié à la neurochirurgie, c’est-à-dire une
Tableau 9 Séries d’irradiation par protons. Proton irradiation. Type de radiothérapie
Dose en GyECO
Médiane de suivi en mois
Survie globale à 5 ans ± 10 ans
Survie sans progression à 5 ans
45
Protons ± photons
59,4–80
62 %
59 %
Austin-Seymour et al. [320] Benk et al. [321] Hug et al. [322] Munzenrider et Liebsch [323]
68 18 58 621
Protons ± photons Protons ± photons Protons ± photons Protons ± photons
Médiane 69 Médiane 69 (55,8–75,6) Moyenne 70,7 66,8
33 patients suivi > 12 mois 34 72 NC 41
Noël et al. [311] Igaki et al. [324] Fuji et al. [325] Rombi et al. [326]
100 13 8 19
Protons ± photons Protons ± photons Protons ± photons Protons
67 72 63 74
31 69,3 42 46
82 % 68 % 79 % 80 à 5 ans 54 à 10 ans 80,5 % 66,7 % 100 % à 3 ans 81 %
58 % 78 % 59 % 73 à 5 ans 54 à 10 ans 53,8 % à 4 ans 42 % 100 % à 3 ans 89 %
Séries Berson et al. [319]
Nombre de patients
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
41
Tableau 10 Séries de radiochirurgie. Radiosurgery. Séries
Nombre de patients
Histologie tumorale
Suivi médian
Taux de contrôle tumoral au cours du suivi
Survie globale
Muthukumar et al. [335] Pamir et al. [336] Feigl et al. [337]
15
40
73 %
NC
23 17
72 % 93 %
NC NC
Krishnan et al. [338]
29
9 CD 6 CS 7 CD 3 CD 10 CS 25 CD 4 CS
54 57,6
NC
Martin et al. [339]
28
Liu et al. [340] Ito et al. [52]
31 19
18 CD 10 CS 31 CD 19 CD
90 76 (6–102) 87,2 après la chirurgie initiale
75 % 32 % de contrôle à 5 ans 62 % (5 ans) 80 % (5 ans) 21,4 % (5 ans) 47,9 % (5 ans)
7 13
radiothérapie en conditions stéréotaxiques en dose unique pour les lésions crâniennes exclusivement. Cet appareil peut être utilisé en traitement adjuvant des chordomes de la base du crâne en situation postopératoire, ou après radiothérapie classique en cas de récidive tumorale. La dose médiane prescrite sur l’isodose 50 % est comprise entre 12 et 16 Gy dans les principales études. Le contrôle local est augmenté de manière significative dans les différentes études (Tableau 10). Dans la série d’Ito et al. [52], 11 patients sur 19 atteints d’un chordome du clivus opérés, ont présenté une récidive. Un traitement par Gammaknife a été effectué pour les 11 récidives et tous les patients étaient vivants au terme des 5 ans de suivi avec un index de Karnofsky moyen de 89,5 %. Dans d’autres séries, le contrôle local variait de 21 % à 93 %. Il faut noter que ces séries comportent peu de patients, et un recul faible. Il est aussi important de rappeler que la radiochirurgie peut se proposer pour des tumeurs de petit volume (inférieur à 14 cc soit 3 cm de diamètre) et situées à distance des voies optiques. 16.3.5.2. Radiothérapie par Cyberknife. Le Cyberknife est un accélérateur linéaire miniaturisé fixé à un bras robotisé piloté par ordinateur permettant d’orienter les faisceaux dans toutes les directions possibles avec une précision de positionnement inférieur à 1 mm. Un système couplé d’imagerie permet un guidage en temps réel, avec recentrage immédiat des faisceaux d’irradiation par le robot. Le Cyberknife est une modalité thérapeutique intéressante pour toutes les localisations axiales et extra-axiales du chordome qui se pratique avec un hypofractionnement, c’est-à-dire avec des doses par fraction supérieure à 2,25 Gy. Dans l’étude d’Henderson et al. [341], la dose recommandée était de 40 Gy en 5 fractions sur le volume tumoral macroscopique avec une marge de 1 cm. Le faible nombre de séries et les faibles effectifs ne permettent pas d’établir de recommandations à ce jour quant à la place du Cyberknife dans le traitement du chordome (Tableau 11). Toutefois, cette technologie de haute précision couplée à une imagerie embarquée laisse envisager un avenir à confirmer dans les ré-irradiations de chordome ou encore dans des études d’efficacité avec modification du fractionnement. 16.3.5.3. Radiothérapie en condition stéréotaxique avec fractionnement classique. Hauptman et al. [343] se sont intéressés à l’irradiation en conditions stéréotaxiques adjuvante avec un accélérateur linéaire de 10 patients atteints de chordome de la base du crâne. L’irradiation s’est effectuée par fraction de 2 Gy par séance avec des doses maximales totales variant entre 53 et 84 Gy. Six
62 % 75,8 % à 5 ans 100 % à 5 ans
tumeurs sur dix sont restées stables ou ont diminué après une dose moyenne de 57,7 Gy, parmi lesquels deux ont bénéficié d’une arc-thérapie dynamique. Le suivi moyen a été de 54 mois. Les effets secondaires de l’irradiation stéréotaxique fractionnée ont été une endocrinopathie et une neuropathie d’un nerf crânien chez deux patients différents. L’équipe d’Heidelberg a rapporté un taux de contrôle local à 5 ans de 50 % après une irradiation stéréotaxique normo-fractionnée pour une dose totale de 66,6 Gy chez 37 patients avec un seul cas de toxicité avec atteinte du tronc cérébral [344]. 16.4. Conclusion La prise en charge du chordome de la base du crâne nécessite une expertise neurochirurgicale et radiothérapeutique concomitante. La microchirurgie doit être maximaliste au niveau des organes critiques tels que le tronc cérébral, la moelle épinière, l’appareil opto-chiasmatique afin d’améliorer le contrôle local et la prise en charge secondaire par le radiothérapeute ; en limitant toutefois les risques de par cette complémentarité. La protonthérapie est actuellement la deuxième composante du traitement standard dans la prise en charge des chordomes. Plusieurs autres techniques de radiothérapie se sont développées et pourront constituer des alternatives, soit à cause de la rareté des centres de protonthérapie dans le monde, même si l’émergence de nouveaux centres est importante, soit par l’intérêt intrinsèque de ces techniques de haute précision. Des études comparatives randomisées seront nécessaires pour mieux définir la place des différentes techniques de radiothérapie dans la stratégie globale. 17. Biologie moléculaire Malgré un traitement chirurgical agressif et en dépit d’une exérèse complète voire en bloc, une récidive est quasiment inéluctable ; un traitement complémentaire est donc nécessaire. Les différentes radiothérapies utilisées aujourd’hui semblent ne pouvoir que retarder, mais non pas empêcher, la récidive. Les différents essais de chimiothérapie utilisant les protocoles préconisés dans le traitement des sarcomes, n’ont apporté que peu ou pas de bénéfice en termes de survie ou de récidive. Les thérapies ciblées basées sur la biologie moléculaire de la pathogenèse, de la croissance et de la prolifération tumorale est en plein développement dans tous les cancers et également dans le chordome. Pour celui-ci, les données commencent à s’accumuler et on voit apparaître quelques
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
42 Tableau 11 Séries de traitement par Cyberknife. Treatment by Cyberknife. Séries
Nombre de patient
Localisations
Place de la radiothérapie
Suivi médian
Henderson et al. [341]
18
35 (24–40)
20
Adjuvant : 17 Traitement premier : 1 Adjuvant : 11 Récidives : 9
46 mois (24–40)
Jiang et al. [342]
Base du crâne : 7 Rachis : 8 Sacrum : 3 Base du crâne : 13 Rachis : 4 Sacrum : 3
34 mois (2–131)
32,5 (18–50)
essais cliniques. C’est sur ces données que sont basés les espoirs soit de thérapies néoadjuvantes qui pourraient réduire le volume tumoral avant la chirurgie, soit de thérapies complémentaires postopératoires qui permettraient de réduire l’agressivité chirurgicale. Comme pour de nombreux cancers, des anomalies chromosomiques ont pu être détectées dans la plupart des chordomes [345]. Ces anomalies sont représentées par des altérations du nombre de copies d’ADN, soit sous forme de pertes, observées le plus souvent sur les bras chromosomiques 9p, 3p et 1p soit sous forme de gains sur 7q, 20,5q et 12q. Il faut rappeler que le gène T de la brachyurie en 6q27 et du CD 24 sont sélectivement exprimés dans la quasitotalité des chordomes tout comme les cytokératines. Les délétions seraient plus fréquentes que les amplifications [346,347]. Ces altérations auraient également une valeur pronostique [348] ; selon Almefty et al. [349], le taux de survie sans récidive à 5 ans serait de 84 % en l’absence d’anomalies chromosomiques et seulement de 34 % en cas de caryotype anormal. Pour l’instant, les altérations chromosomiques, hormis celles concernant la Brachyurie, sont trop disparates pour en tirer d’éventuelles conclusions thérapeutiques. C’est plutôt sur les perturbations (secondaires aux anomalies chromosomiques) des voies de transduction et de transcription que les recherches paraissent les plus prometteuses. Néanmoins, jusqu’à présent, tous les essais de traitement inhibant spécifiquement une de ces voies, n’ont apporté que des résultats modestes faisant d’ailleurs s’orienter aujourd’hui plutôt vers des combinaisons de traitement à base d’inhibiteurs de différentes étapes de ces voies de transduction. La première étape des voies de transduction concerne la Tyrosine Kinase dont le récepteur (RTK) est l’une des familles de protéines les plus étudiées dans différents cancers et dans le chordome. Il existe au moins 58 RTK différents mais agissant tous par le même mécanisme. Les RTK sont les éléments les plus importants par lesquels des facteurs extracellulaires (essentiellement des facteurs de croissance) vont stimuler la croissance et la prolifération tumorale via une cascade de facteurs jusqu’au noyau de la cellule (Fig. 53). L’activation par phosphorylation des RTK se fait par l’intermédiaire d’un ligand correspondant à différents facteurs ; les plus importants mis en évidence sont l’epidermal growth factor (EGF), le transforming growth factor (TGF), le platelet-derived growth factor (PDGF) et l’hepatocyte growth factor (c-MET). Tous ces facteurs sont exprimés dans une majorité de chordomes et interviennent dans la régulation de la prolifération cellulaire. Le RTK activé induit l’activation de différentes voies vers le noyau. Les voies les plus classiques sont celles empruntant soit PI 3 (phosphoinositide 3-kinase), AKT, mTOR (mammalian target of rapamycine), soit le système rénine-angiotensine (RAS), la mitogen-activated protein kinase (MEK) et l’extracellular signal-regulated kinase (ERK) soit enfin la protéine activatrice du signal tranducer et activator of transcription (STAT 3). En fait, il existe de nombreux mécanismes par lesquels une dysrégulation dans la cascade RTK jusqu’au noyau de la cellule aboutit à une transformation maligne et à sa prolifération. On peut citer :
Dose en Gy
Contrôle local
Survie globale
59,1 % à 65 mois
74,3 % à 65 mois
Adjuvant : 81,8 % Récidives : 28,6 %
52,5 % à partir du premier traitement par CK
la surexpression des facteurs de croissance, ligands des RTK, ou une mutation aboutissant à une activation continue ou encore une mutation avec amplification des gènes. Un exemple est représenté par le gène TSC (sclérose tubéreuse de Bourneville) qui peut être inactivé par une surexpression de l’EGFR induisant ensuite une activation de PI 3 puis de AKT et de mTOR. L’inhibition des protéines TSC active le mTOR et déclenche la croissance cellulaire et la prolifération tumorale. C’est le probable mécanisme conduisant à l’association Sclérose Tubéreuse et chordome. Un autre exemple s’observe avec l’hétérozygotie du gène 1p, fréquente dans les chordomes et possiblement à l’origine de l’activation du gène mTOR localisé en 1p36,2. Par conséquent, l’utilisation thérapeutique d’inhibiteur du mTOR (rapamycin analogs ou sirolimus) paraît logique dans les chordomes ayant une surexpression de l’EGFR, une inactivation du complexe TSC1/2 et une activation du mTOR. C’est ce qui a été essayé chez 10 patients ne répondant pas à une inhibition du PDGFR (imatinib) par Stacchiotti et al. [350] en 2009 avec une réponse partielle pour 7 d’entre eux à 3 mois. Sur des lignées cellulaires (UCH-1), Schwab et al. ont utilisé un inhibiteur simultanément de la PI 3 et du mTOR, le PI-103 et a obtenu une diminution de la prolifération en induisant une apoptose [351]. En fait depuis quelques années, différents essais cliniques ont été réalisés avec différents inhibiteurs. Le premier en date fut l’imatinib, inhibiteur du PDGFR sur la base des résultats obtenus sur d’autres cancers et notamment le cancer gastro-intestinal et la leucémie myéloïde chronique [352,353]. Il a ensuite été testé sur le chordome [199,354] chez 6 puis 18 patients avec des réponses assez modestes : diminution de la prise de contraste chez 11 patients et diminution du volume tumoral chez seulement 2 des 18 patients ; néanmoins la plupart des patients se sont améliorés cliniquement et l’effet s’est prolongé pendant un an. Une autre étude [355], multicentrique sur 56 patients a montré une stabilité tumorale dans 70 % des cas. La médiane sans progression tumorale était de 32 semaines avec 38 % des cas sans progression tumorale à un an. Il faut reconnaître que si ces résultats ne sont pas très impressionnants, il s’agissait dans la majorité des cas de traitements donnés à titre compassionnel chez des patients porteurs de chordomes en phase avancée ayant épuisé les autres modalités thérapeutiques. Plusieurs « case reports » ont également porté sur des inhibiteurs de l’EGFR [356–358] tels que le cétuximab, le géfitnib et l’erlotinib. Pour l’instant l’inactivation du récepteur c-MET, retrouvée dans environ 80 % des chordomes crâniens et rachidiens [359,360] n’a pas été explorée, bien qu’elle ait montré une certaine efficacité dans d’autres cancers [361]. Puisque la cascade impliquée dans la plupart des chordomes est celle de PI 3/AKT/mTOR [362,363], son blocage en l’un de ces points paraît pouvoir être plus efficace que celle des facteurs d’activation de la RTK. En effet, compte tenu du nombre de RTK, l’inactivation
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
43
Fig. 53. Schéma des différents facteurs de transduction et de transcription intervenant dans la croissance et la prolifération cellulaire depuis la membrane cellulaire avec les différents récepteurs qui activent la Tyrosine Kinase (PDGFR, EGFR, c-MET) et les cascades intracellulaires principales notamment PI3K, Akt, mTOR et STAT3. Scheme of the different factors of transduction and transcription modifying the tumoral growth and cell proliferation from the cell membrane to the nucleus. It shows the receptors activating the Tyrosin kinase (PDGFR, EGFR, c-MET) and the intracellular cascades, essentially: PI3K, Akt, mTOR, and STAT3. D’après Barry et al. [569] ; publié avec l’autorisation de Wolters Kluwer.
de l’un d’entre eux laisse les autres possiblement actifs. Les RTK activant presque toujours la même cascade, l’idée d’agir sur un des facteurs de cette cascade paraît plus satisfaisante. Il existe plusieurs inhibiteurs du mTOR : sirolimus, RAD001, CCI-779 qui sont en cours d’études [364] dans plusieurs essais cliniques. Il a également été testé un inhibiteur du STAT3 qui est retrouvé sous sa forme activée dans de nombreux chordomes y compris et de fac¸on encore plus importante dans les formes récidivantes et métastatiques. Pour Yang et al. [144], il existe une corrélation entre le niveau d’expression du Stat3 et le pronostic. Ils retrouvent le Stat 3 exprimé chez les 70 patients étudiés. De plus, ils ont utilisé le SD-1029 sur 3 lignées cellulaires différentes de chordomes et obtenue par inhibition du STAT3 un arrêt de la croissance cellulaire avec apoptose. Ils ont également montré un effet synergique du SD-1029 et du cisplatine ou de la doxorubicine sur la mort des cellules de chordomes. L’inhibition du STAT3 par cet agent paraît d’autant plus intéressant que les cellules normales semblent tolérer parfaitement la perte de la fonction du STAT3. Mais là encore on se heurte à un nouvel écueil : l’existence d’un effet «feed back» négatif qui fait que les facteurs en amont du facteur inactivé, sont eux hyperactivés. C’est probablement le cas de PI 3/AKT en amont du mTOR inactivé. Par conséquent on se tourne maintenant vers soit des inhibiteurs agissant à plusieurs niveaux comme le PI-103 bloquant le mTOR mais aussi l’AKT soit des combinaisons d’inhibiteurs agissant à différents niveaux ; par exemple inactivation des facteurs d’activation des RTK et du mTOR. Une étude par Stacchiotti et al. [350] a ainsi testé l’association iminitab (PDGFR) plus sirolimus (mTOR) sur 10 patients réfractaires à l’iminitab seul, et obtenu une réponse, là encore, pas très importante. Ce type d’association a également été essayé dans les gliomes [365–367]. Un gène suppresseur naturel, le PTEN (phosphatase et tensine homologue), pourrait être le candidat de ce type d’association thérapeutique. PTEN inhibe le passage PI3 vers AKT ; lorsqu’il disparaît ou est muté, AKT est activé ainsi que la suite de la chaine et notamment mTOR. Une perte ou une mutation du gène de PTEN a été démontré dans de nombreux cancers : 40 % des gliomes et 25 % des
chordomes. Ces chordomes comme les gliomes déficients en PTEN s’avèrent résistants aux monothérapies. En revanche, l’association d’un inhibiteur de l’EGFR à un inhibiteur du mTOR a montré dans les glioblastomes un meilleur effet sur la prolifération tumorale que l’un d’entre eux utilisé isolément [361]. On ne fera que rappeler les espoirs que donne la Brachyurie, marqueur très spécifique des chordomes et dont l’inhibition in vitro entraîne la régression tumorale (cf le chapitre sur la Brachyurie). Il faut ajouter que pour certains, il reste une place pour les chimiothérapies classiques isolée ou associée aux chimiothérapies ciblées ; par exemple imatinib et cisplatine [354,368–371]. Une autre technique utilisant l’injection intratumorale de carboplatine dont la concentration est renforcée par de l’épinéphrine a été rapportée par l’équipe de Dijon [372]. Il semble que l’on puisse ainsi induire une nécrose tumorale avec réduction volumique (de 42 %) mais elle nécessite d’être fréquemment répétée ; dans le cas rapporté, 11 injections ont été réalisées en 18 mois. Une autre publication [373] rapporte le traitement de 7 patients par injections percutanées (22 au total) dans des chordomes sacrococcygiens récidivants d’un mélange de pingyamycin et de lipiodol. Avec un suivi allant de 10 à 26 mois, les auteurs observent une régression tumorale dans tous les cas sans complication particulière. Au total, le besoin d’une chimiothérapie complémentaire est évident et en particulier pour les chordomes de la base du crâne pour lesquels l’exérèse chirurgicale est difficilement complète. Pour l’instant, les essais thérapeutiques ont surtout porté sur des chordomes récidivants en fin d’évolution avec peu de succès. Néanmoins, des progrès importants ont été obtenus dans la compréhension des mécanismes qui régulent la prolifération cellulaire et la croissance tumorale de différents cancers, ce dont a profité le chordome. Il paraît démontré que ce sont des associations d’inhibiteurs agissant en différents points des voies de la transduction intracellulaire qui ont le plus de chance d’être efficaces. Les combinaisons possibles sont multiples (association d’inhibiteurs des RTK, d’inhibiteurs de RTK et mTOR, d’inhibiteurs mTOR et PI 3/AKT, etc.) ; peut -être faut-il trouver celle adaptée à chacun des cas de chordomes en fonction des facteurs qu’ils expriment.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 44
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
18. Thérapie ciblée : prise en charge systémique des formes avancées et métastatiques, une revue de la littérature (E. Boissier, V. Calugaru, S. Vignot, S. Bolle, R. Dendale, L. Feuvret) 18.1. Historique Très peu d’études ont été réalisées pour évaluer l’efficacité de la chimiothérapie, du fait de la rareté de la pathologie et de la difficulté de mettre en œuvre des études prospectives homogènes. En pratique, la chimiorésistance de ces tumeurs est reconnue même si des résultats positifs et isolés ont pu être rapportés avec les anthracyclines, les agents alkylants, le cisplatine et la thalidomide [285,369]. Les séries rapportant l’utilisation d’anthracyclines dans le cadre de la prise en charge des chordomes en progression sont nombreuses et retrouvent une certaine efficacité [285,369,374,375]. Plus récemment, une étude de phase II prospective a évalué l’intérêt du 9 nitrocamptothecin à la dose de 1,25 mg/m2 (inhibiteur de la topo-isomérase) chez 51 patients atteints de chordomes, de tumeurs gastro-intestinales et de sarcomes. Un seul patient sur les 15 ayant un chordome a présenté une réponse objective. Pour l’ensemble des patients atteints de chordomes la survie sans progression était de 47 % à 3 mois et de 33 % à 6 mois [376]. Les principaux effets secondaires retrouvés étaient l’hématotoxicité, une asthénie et des troubles digestifs (nausées et diarrhées). Les mécanismes expliquant cette chimiorésistance ne sont pas clairs. Ji et al. [377] ont retrouvé la surexpression de deux gènes, connus pour être des gènes de chimiorésistance dans les cancers (hypoxia-inducible factor 1 ˛ [HIF-1˛] et multidrug resistanceassociated protein 1 [MRP1]). Ces deux gènes pourraient aussi être impliqués dans le cadre des chordomes. Le niveau de prolifération habituellement bas de ces tumeurs pourrait également intervenir ainsi que la diffusion plus ou moins bonne des agents au sein de la lésion, notamment après irradiation. 18.2. Nouveautés Elles concernent la génétique et les voies de signalisation intra- ou extracellulaires. 18.2.1. Génétique L’analyse cytogénétique des chordomes a révélé la présence de caryotypes complexes, comme dans les sarcomes, avec principalement des caryotypes diploïdes, ou parfois hypodiploïdes. Au sein de ces caryotypes, de nombreux réarrangements à la fois en nombre et en structure ont été constatés. Le plus souvent, il a été observé, sur certaines régions, une perte des chromosomes 3, 4, 10, 13 [378]. Plus rarement, des gains au niveau des chromosomes ont aussi été identifiés, au niveau des chromosomes 5q, 7 et 20. Aucune amplification de gènes n’a été retrouvée. Les gènes suppresseurs de tumeurs CDKN2A et CDKN2B situé en 9p21,3 peuvent être délétés. Ces anomalies ont été confirmées par la méthode d’Hybridation In Situ en Fluorescence (FISH) dans plus de 70 % des patients atteints de chordomes. Ces gènes pourraient constituer une étape majeure dans l’oncogenèse des chordomes [347]. Dans l’étude de Miozzo et al. [232], il a été identifié la perte de l’hétérozygotie chez deux sœurs, au niveau du gène 1p36, qui serait un gène suppresseur tumoral, et qui a été retrouvé dans les formes familiales de chordomes. Mais seulement quelques cas isolés de formes familiales ont été décrits dans la littérature, repris dans la revue de Bhadra [231] en 2006. Le faible nombre de formes familiales recueillies rend l’interprétation de ces données prudente. Des études récentes ont montré une hyperexpression du gène T (Brachyury) dans les chordomes du sacrum. Une liaison entre la duplication du gène T (Brachyury) et les chordomes familiaux a
été trouvée par Yang et al. [143], mais il n’existe pas à ce jour d’application thérapeutique suite à la mise en évidence de ces remaniements chromosomiques. 18.2.2. Voies de signalisations Parallèlement aux études génétiques, la surexpression de plusieurs protéines pouvant jouer un rôle crucial dans l’oncogenèse des chordomes ont été décrites [379–382]. Ces protéines sont à l’origine de l’activation en cascade de différentes voies de signalisations modulant la prolifération tumorale et la survie cellulaire. Ces mécanismes pourraient être bloqués par des inhibiteurs en cours de développement, ce qui constituerait alors de nouvelles armes thérapeutiques dans les chordomes avancés. On peut retrouver, dans la littérature, la description du rôle essentiel des récepteurs tyrosines kinases (RTK), avec plus spécifiquement les récepteurs des facteurs de croissance plaquettaires (principalement PDGFRB), les récepteurs KIT, EGFR, IGFR et MET [356]. Ces récepteurs peuvent être activés par 3 mécanismes : • activation par son ligand spécifique, le plus fréquent ; • mutations-gains de fonction ; • amplification génique du récepteur qui peut être responsable d’une hyperexpression du récepteur. L’activation du récepteur par l’un de ces mécanismes va être responsable de sa dimérisation puis de sa phosphorylation dans son domaine intracellulaire. Il en résulte une activation de protéines spécifiques, qui à leur tour vont activer d’autres voies de signalisations intracellulaires. 18.3. Récepteurs à activité Tyrosine Kinase (RTK) 18.3.1. Platelet-derived growth factor receptor ˇ (PDGFRB) Le PDGFRB est une protéine transmembrannaire, composée d’une partie extra cellulaire et d’une partie intracellulaire. Son activation va jouer un rôle primordial dans la prolifération cellulaire et la différentiation embryonnaire. La PDGFRB, par rapport aux autres RTK, a la particularité de favoriser la croissance tumorale par l’activation de l’angiogenèse. En 2004, Casali et al. [550] ont démontré l’expression de PDGFRBéta par RT-PCR au niveau de 6 cas de chordomes avancés avec pour quatre d’entre eux une hyperexpression et une phosphorylation de cette molécule. Plus récemment, en 2010, Tamborini et al. [379] ont observé parmi 22 cas de chordomes, une activation de PDGFRB dans 95 % des cas. Son activation serait due à une boucle autocrine/paracrine avec surexpression du ligand PDGF. À ce jour, aucune mutation spécifique n’a été retrouvée pour ce récepteur. 18.3.2. Epidermal growth factor receptor (EGFR) L’EGFR est un récepteur connu pour être impliqué dans la genèse de nombreux cancers. À ce jour, il est reconnu comme proto-oncogène dans les cancers des voies aéro-digestives supérieures [383], dans le cancer du sein [384], du poumon [385], du côlon [386] et des tumeurs gliales malignes [387]. Il s’agit d’un récepteur transmembranaire dont le principal ligand est l’epidermal growth factor (EGF) mais aussi le transforming growth factor ˛ (TGF␣) et d’autres facteurs de croissance. L’interaction spécifique ligand-récepteur va entraîner l’activation du récepteur EGFR. Celui-ci va être reconnu par de nombreuses protéines possédant un domaine spécialisé appelé Src Homology 2 (SH2). Ces protéines, porteuses du domaine SH2, seront capables d’activer la voie des MAP kinases et la voie des PI3K. L’EGFR est impliqué principalement dans la tumorogenèse et dans la croissance tumorale. L’étude de Dewaele et al. [380] a observé chez 39 patients une hyperexpression de l’EGFR dans 26 cas. Il s’agissait dans 80 % des
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
cas de tumeurs avancées. Ces résultats sont confirmés par la série de Shalaby et al. [381] avec 173 chordomes analysés parmi lesquels une expression EGFR est observée dans 69 % des cas, avec forte suspicion du rôle d’un signal EGFR aberrant, après analyse par FISH. Tout comme le PDGFRB, l’EGFR n’a pas été retrouvé muté dans les chordomes.
18.3.3. Insuline growth factor receptor (IGFR) Ce récepteur transmembranaire jouerait un rôle dans la prolifération, la différenciation, la survie cellulaire, par protection de l’apoptose et la migration cellulaire. Il va activer les voies RAS/MAPK et PI3K/AKT. Mitsuhashi et al. [382] ont analysé l’expression du récepteur IGF1 et ont trouvé une hyperexpression de l’IGFR1 dans les chordomes. Ces résultats ont été confirmés par Sommer et al. [388], avec 41 % des tumeurs de sa série qui exprimaient l’IGFR. Le ligand IGF est connu pour être un marqueur de chimiorésistance dans certaines tumeurs dont les sarcomes [389]. Récemment, Scheipl et al. [390] ont démontré chez 50 patients atteints de chordomes une coexpression de l’IGFR 1 (76 %) et de l’IGF (92 %). Conjointement, une corrélation entre le volume tumoral et l’intensité de l’expression de IGF1R a été mise en évidence pour les tumeurs localisées (38).
18.3.4. MET Il s’agit d’un RTK qui est normalement activé lors de l’embryogenèse et de fac¸on pathologique dans de nombreuses tumeurs. Son ligand principal est le hepatocyte growth factor (HGF). Les récepteurs MET sont principalement exprimés dans les tissus chondroïdes, articulaires, cartilagineux et les tissus notochordaux, pouvant expliquer leur expression dans les chordomes [391]. Sa dérégulation favorise les capacités de survie, de prolifération, de motilité et de morphogenèse des cellules épithéliales, permettant le développement tumoral et la progression métastatique [346,392]. Pour Naka et al. [393], c-MET est exprimé dans 70 % au moment du diagnostic et dans 88 % des récidives de chordomes de la base du crâne. L’expression isolée de c-MET était corrélée à l’expression d’un marqueur épithélial, la cytokératine de faible poids moléculaire CAM5,2, au jeune âge du patient, et à un bon pronostic chez les patients atteints de chordomes de la base du crâne. Cependant la co-expression HGF/c-MET, par sécrétion paracrine, est associée à une agressivité tumorale, surtout en cas de rechute et est donc un facteur de mauvais pronostique [393,394].
18.3.5. KIT KIT est un RTK jouant un rôle majeur dans la prolifération tumorale. Son principal ligand est le Stem Cell Factor (SCF). Il est exprimé dans de multiples cancers chez l’homme (GIST, séminomes, mastocytoses, carcinomes adénoïdes kystiques) [395,396]. Il a été trouvé de fac¸on moins fréquente dans les chordomes mais semble jouer un rôle primordial dans le développement tumoral, principalement dans la survie, la prolifération et la différentiation cellulaire [199,356,397].
18.3.6. Voie mTOR Ces différents récepteurs activés vont entraîner principalement l’activation secondaire de deux voies : PI3K/AKT et RAS/MAPK, qui à leur tour vont activer la voie Mammalian Target of Ripammycin (mTOR) et ses protéines régulatrices de la transcription : S6K/S6 et 4 E-BP1. Dans les chordomes, les RTK seraient activés, principalement par expression paracrine et autocrine du ligand. Tamborini et al. [379,397] ont suggéré d’utiliser une association d’inhibiteurs des RTK et d’un inhibiteur mTor afin d’optimiser le contrôle tumoral.
45
18.4. Les molécules existantes 18.4.1. Imatinib L’imatinib mésylate est un inhibiteur pharmacologique des récepteurs PDGF, KIT et de protéine de fusion Bcr-Abl. Il est actuellement utilisé dans le traitement des leucémies myéloïdes chroniques et des tumeurs stromales digestives. La première utilisation dans les chordomes a été rapportée en 2004 par Casali [550] chez six patients atteints d’un chordome exprimant PDGFR avec une réponse tumorale sous forme de diminution de prise de contraste en imagerie ou de la fixation de FDG au PET. Ces résultats ont été confirmés par une étude prospective de phase II multicentrique incluant 55 patients [355]. Ces patients atteints de chordomes à un stade avancé, présentaient une hyperexpression de PDGFR . Une réponse partielle selon les critères RECIST était rapportée chez 2 % des patients et une stabilité chez 70 % des patients avec une médiane de survie sans progression de 9,1 mois. Un bénéfice clinique est observé dans 64 % des cas. En dehors d’une faible hématotoxicité, le principal effet secondaire est une rétention d’eau avec œdème périorbitaire (25 % des cas). Cette inhibition sélective du PDGFR par l’imatinib, chez les patients présentant un chordome avancé avec expression PDGFR est la première thérapie moléculaire ciblée ayant pu montrer une activité. 18.4.2. Imatinib et cisplatine Après une réponse initiale à l’imatinib, une nouvelle progression peut apparaître et l’association de l’imatinib à la dose de 400 mg/j à du cisplatine à faibles doses (25 mg/m2 par semaine) peut s’avérer efficace, confirmant les données in vitro de l’effet du cisplatine (Casali). Chez 4 des six patients de la série de Casali [550], a été observée une réponse tumorale dont deux avec une diminution tumorale radiologique. L’efficacité du cisplatine en monothérapie n’ayant pas été démontrée, ceci pourrait supposer une action synergique entre l’imatinib et le cisplatine dont le mécanisme n’est pas clair à ce jour [398]. 18.4.3. Imatinib et sirolimus Le sirolimus ou rapamycine est un immunosuppresseur de la protéine mTOR. Cet inhibiteur va entraîner un blocage du cycle cellulaire et de l’angiogenèse [399]. Des dérivés de la rapamycine (temsirolimus, everolimus) sont actuellement utilisés dans le traitement des cancers du rein [400], du sein et dans les lymphomes du manteau. Ces agents sont également en cours d’évaluation dans la prise en charge des cancers de l’endomètre et certains sarcomes. Stacchiotti et al. [350] ont analysé l’efficacité de l’association imatinib (400 mg/j) plus Siromilus (2 mg/j) en deuxième ligne après échec de l’imatinib seul, dans une série de 10 patients présentant un chordome. Une réponse tumorale a été observée chez 7 patients, avec pour 4 d’entre eux une réponse de plus de 10 % selon les critères de Choi et al. [24]. Un autre patient était considéré comme stable et l’autre progressait. Selon les critères de RECIST, un patient avait une réponse partielle, sept patients une stabilité et un patient une progression tumorale. Au niveau du PET-TDM, sept patients étaient en réponse radiologique. Le bénéfice clinique (défini selon RECIST par la somme de réponse complète [RC] + réponse partielle [PR] + stabilité [SD] ≥ 6 mois) était de 89 % à 6 mois. Les principaux effets secondaires étaient une hématotoxicité, des infections de grade 3 et une mucite de grade 1–2. 18.4.4. Anti-EGFR L’erlotinib et le géfitinib sont des inhibiteurs sélectifs du récepteur EGFR. Ils bloquent la transduction du signal et a priori la multiplication cellulaire. Leur indication est reconnue dans les cancers pulmonaires non à petites cellules, notamment chez les patients mutés EGFR et dans les cancers pancréatiques.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 46
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Le cétuximab est un anticorps monoclonal humain qui bloque le récepteur EGF. Il n’y a pas eu de phase 2 utilisant des anti-EGFR dans les chordomes avancés. Il ne s’agit que de cas isolés. Deux cas d’association du cétuximab et du géfitinib sont rapportés dans la littérature. Le premier cas était celui d’un patient atteint d’un chordome sacré avec des métastases pulmonaires ayant présenté une réponse partielle pendant 9 mois [356]. Le deuxième cas était celui d’un patient avec un chordome du clivus ayant présenté une réponse tumorale de l’ordre de 40 % à 4 mois [357]. Concernant l’erlotinib, deux cas sont décrits dans la littérature. Singhal et al. [358] ont observé, chez un patient, une réponse tumorale de plus de 30 % à 3 mois. Launay et al. [401] ont également constaté une réponse tumorale de 53 % à 3 mois et de 70 % à 6 mois chez un patient. Dans les deux cas, la réponse a été maintenue plus de 11 mois. Ces cas isolés témoignent du rôle potentiel du ciblage de la surexpression de l’EGFR qui doit être encore explorée. 18.5. Autres options thérapeutiques Une alternative au traitement systémique pourrait être l’injection intratumorale de carboplatine associée à l’épinéphrine permettant d’améliorer l’effet antitumoral du carboplatine. Il a été observé chez un patient une réponse partielle avec une diminution de 42 % du volume tumoral sur l’imagerie et une bonne réponse clinique avec nette amélioration de la compression médullaire [372]. L’association chirurgie et chimiothérapie intratumorale a permis d’obtenir un bon contrôle local chez cet unique patient et peut être une piste de recherche. À ce jour, il n’a pas été retrouvé de données sur l’intérêt de l’utilisation d’un traitement systémique en néoadjuvant de la chirurgie ou de la radiothérapie. Ce traitement pourrait réduire le volume tumoral avant chirurgie et faciliter l’exérèse maximale. En cas de radiothérapie, le traitement néoadjuvant pourrait permettre d’optimiser les champs d’irradiation afin de protéger d’avantage les organes à risques. De même, on a très peu de données sur l’intérêt d’un traitement systémique concomitant à la radiothérapie, afin d’augmenter l’effet des radiations ionisantes. Rhomberg et al. [402] ont utilisé la radiothérapie par photons couplés au razoxane (un inhibiteur de topoisomerase II) qui a un fort pouvoir radiosensibilisant, en bloquant les cellules en G2/M, la phase la plus radiosensible du cycle cellulaire. Parmi les patients traités, il y avait 13 chondrosarcomes et 5 chordomes. La dose moyenne utilisée a été de 63 Gy pour les chordomes. Le razoxane a été débuté 5 jours avant la radiothérapie et administré par voie orale pendant toute la durée de l’irradiation à raison de 2 comprimés de 125 mg par jour, le premier comprimé 1 h avant la radiothérapie et le deuxième le soir. Les résultats sont encourageants avec un taux de contrôle local et une survie globale de 100 % à 5 ans pour les chordomes, et ceci avec une excellente tolérance du razoxane. 18.6. Conclusion La connaissance de la biologie des chordomes permet de mieux comprendre les différents mécanismes indispensables à la prolifération et à la survie tumorale. Les premières études publiées semblent prometteuses et pourraient être le début d’une nouvelle ère thérapeutique dans la prise en charge des chordomes avancés ou métastatiques, par les thérapies moléculaires ciblées. En première ligne, il pourrait être intéressant d’initier un traitement par imatinib en complément du traitement local par chirurgie et radiothérapie. En cas de récidive, l’intérêt des associations imatinib et cisplatine ou imatinib et inhibiteur de mTOR pourrait être discuté. Il s’agit d’utilisations hors AMM et ces indications doivent être discutées collégialement. Une expertise oncologique est indispensable pour la prescription de ces molécules onéreuses et pour la gestion
de leurs toxicités particulières. Il serait essentiel de colliger prospectivement les résultats afin d’affiner les données sur l’efficacité de ces différentes options dans le traitement des chordomes. Dans tous les cas, l’inclusion dans des essais thérapeutiques doit être favorisée autant que possible. Cependant, du fait de la rareté de la pathologie, peu de patients peuvent être inclus dans des essais et les résultats sont souvent biaisés par l’inclusion de groupes d’analyse très hétérogènes.
19. Revue des grandes séries 19.1. Chordomes intracrâniens Les symptômes révélant un chordome sont bien sûr fonction de la localisation le long du clivus, allant de signes endocriniens pour les formes juxtasellaires aux troubles de la phonation et de la déglutition pour ceux proches du foramen magnum ou du foramen jugulaire. Il faut néanmoins souligner la grande fréquence d’une diplopie par atteinte oculomotrice soit au niveau du sinus caverneux soit du clivus. L’atteinte le plus souvent observée est celle du VI avec cette particularité qu’elle est parfois transitoire, régressant spontanément après quelques semaines pour souvent réapparaître ensuite et de fac¸on définitive. Cette symptomatologie oculomotrice intermittente faisait et fait encore souvent évoquer un diagnostic de sclérose en plaque avec le risque de retarder la réalisation d’une IRM. Le délai diagnostique est des plus variables avec une tendance à la diminution du fait de la facilité d’accès actuelle à une imagerie performante. En dépit de cela, les chordomes sont très souvent découverts alors qu’ils ont déjà atteint une taille conséquente, en moyenne de 4 cm au moment du diagnostic, selon diverses séries. Dans toutes les grandes séries, il existe un nombre non négligeable de patients déjà traités préalablement dans un autre centre, le plus souvent par chirurgie parfois par radiothérapie uniquement, avec un délai variant de quelques semaines à quelques années. Ces grandes séries comportent toutes plusieurs facteurs d’hétérogénéité qui rendent l’analyse de leurs résultats difficile. Outre qu’elles contiennent des patients primaires et d’autres en récidive, elles combinent souvent des localisations différentes (crâne, rachis mobile et sacrum), des modalités thérapeutiques variées (chirurgie seule, radiothérapie seule ou combinaison de chirurgie et de diverses formes de radiothérapie). À ceci s’ajoute l’hétérogénéité de comportement biologique très variable d’un chordome à l’autre. Il est difficile, à moins de séries très importantes, de lisser ces disparités ou de faire des sous-groupes suffisamment nombreux pour tirer des conclusions fiables. À notre sens, seule la méta-analyse réalisée par Di Maio et al. [403] en 2011 peut prétendre apporter des réponses utiles. Cette méta-analyse a porté sur 10 ans, de 1999 à 2009, avec comme critères de sélection : un diagnostic histologique affirmé, des chordomes du clivus et de la base du crâne, une série consécutive publiée entre 1999 et 2010, des informations sur le taux de survie global et sans récidive à 5 ans et une indication sur les modalités thérapeutiques et notamment sur le type de radiothérapie réalisée, le cas échéant. Partant de 248 publications potentielles, ils en ont retenu 23 soit un total de 807 patients. Les séries comptent de 11 à 100 patients. L’âge moyen est de 51,2 ans ; le suivi moyen de 53,6 mois. Le taux de résection complète (absence de résidu sur l’imagerie postopératoire) varie de 0 à 73,7 %. Le taux de survie à 5 ans est globalement de 78,4 % (variant de 61,5 à 100 %) et sans récidive de 50,8 % (variant de 15 à 80 %). Sur la base d’une analyse Kaplan-Meier des données individuelles additionnées, le taux de survie global à 5 et 10 ans est de 70 et 63 % et le taux de survie sans récidive de 54 et 26 %.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Tous les patients ont été opérés et certains également radiothérapés. Onze centres ont utilisé la photonthérapie fractionnée, 9 les protons, 6 le Gammaknife et 3 les ions Carbone. En fait dans une même série, plusieurs types de radiothérapie ont pu être pratiqués. La plupart ont utilisé une radiothérapie en cas de résidu postopératoire démontré et tous les centres sauf un n’en ont pas fait en cas de résection considérée comme complète. Il ressort de cette méta-analyse que le taux de survie sans récidive à 5 ans est nettement meilleure lorsqu’une exérèse complète a pu être réalisée : 87 % contre 50 % en cas d’exérèse incomplète (p < 0,0001) ; de même la survie globale passe de 95 % à 71 % (p < 0,001). À 10 ans, la résection complète donne un taux de survie globale de 95 % contre 53 % et la survie sans récidive 47 % contre 25 %. Le risque de récidive à 5 ans est 3,83 fois supérieur après résection incomplète et le risque de mortalité à 5 ans est 5,85 fois plus élevé. L’analyse des traitements complémentaires ne montre pas de différence significative sur le taux de survie global et sans récidive à 5 ans selon le mode de radiothérapie utilisée (n = 517 patients). Dans un sous-groupe peu important (n = 58) de patients avec résection complète, la survie sans récidive à 5 ans après chirurgie avec (n = 22) ou sans (n = 36) radiothérapie complémentaire n’est pas statistiquement différente. De cette analyse, il faut retenir le facteur pronostique majeur que représente une résection complète. L’intérêt de la radiothérapie complémentaire est difficile à affirmer. Compte tenu du caractère quasiment inéluctable de la récidive, peut-être la radiothérapie ne fait-elle, en cas de résection complète, que retarder sa survenue. Il faudrait des études avec un suivi plus long pour pouvoir le dire. En cas de résection incomplète, l’hétérogénéité des groupes de patients concernant l’importance de la résection et le type de radiothérapie fait qu’aucune conclusion pertinente ne peut être tirée. Des études randomisées avec et sans radiothérapie ou avec un type de radiothérapie contre un autre sont en cours [404]. Peut-être apporteront-elles des réponses. Il faut ajouter à ces facteurs de pronostic, l’agressivité biologique très variable d’un chordome à l’autre et pour un même chordome d’un secteur à l’autre. Sur une série courte de 19 chordomes du clivus, Ito et al. [60] trouvent une relation significative du MIB-1 avec la durée sans progression de la maladie et une limite optimale de valeurs du MIB-1 à 3,44 %. À l’inverse aucun autre facteur et en particulier l’extension tumorale et le type de résection n’a d’influence sur la survenue de récidives. Cependant, d’autres auteurs soulignent l’absence de valeur pronostique des index de prolifération (Ki67 ou MIB-1). Une autre méta-analyse a été publiée en 2010 avec des critères similaires [405]. Cette fois, les auteurs ont retenu 760 patients ayant suffisamment d’informations sur 2000 cas possibles. Ils ont subdivisé ces patients selon l’âge (inférieur et supérieur à 21 ans ; n = 322 et 348), selon l’histologie (chordomes classiques : n = 429 et chondroïdes : n = 32) et selon le traitement (chirurgie seule : n = 226 ou associée à une radiothérapie : n = 128). Le taux de récidive était supérieur chez les sujets de plus de 21 ans (74 % contre 60 %), dans les cas de chordomes classiques (77 % contre 38 %) et chez ceux traités par chirurgie seule (79 % contre 60 %). Les mêmes auteurs [405] ont également publié d’autres résultats de cette méta-analyse, ne conservant cette fois que 560 patients pour analyser les taux de survie actuariels à 5 et 10 ans. Là encore ils ont subdivisé les patients selon l’âge, l’histologie et le traitement, mais pour l’âge, ils ont considéré 3 sous-groupes : < 5 ans, entre 5 et 40 ans et > 40 ans). Le taux de survie pour l’ensemble de la série est de 63 % et 16 % à 5 et 10 ans. Il n’y a pas de différence entre les patients de plus ou moins 40 ans mais en revanche le taux de survie est meilleur à 5 ans pour les patients âgés de plus de 5 ans : 66 % contre 14 % pour le groupe de moins de 5 ans. Dans cette nouvelle étude, l’histologie ne fait pas de différence sur le taux de survie à
47
5 ans : 45 % pour les chondroides contre 67 % pour les formes classiques (p = 0,06) ; il en est de même pour le traitement : 54 % pour la chirurgie seule contre 56 % pour la chirurgie associée à la radiothérapie. La contradiction avec leur article publié un an plus tôt est évidente ; elle semble s’expliquer par une méthode d’analyse plus rigoureuse dans l’article le plus récent. Enfin, une autre analyse [406] repose sur 962 chordomes répertoriés dans le SEER américain (Surveillance, Epidemiology and End Results database) entre 1973 et 2005. Les données sont assez grossières mais on peut dire que la chirurgie améliore indiscutablement le taux de survie global des patients. En revanche, le taux de récidives et la morbidité associée aux multiples réinterventions font poser la question de l’intérêt de ces chirurgies répétitives. On peut illustrer les limites des études portant sur une seule série d’un seul centre, y compris quand elles sont importantes par les dernières publiées. Ainsi celle de l’université de Whashington (Seattle, États-Unis) par Di Maio et al. [407] en 2012 comporte 95 chordomes de la base du crâne. Ce chiffre est tout à fait respectable mais la série est divisée en deux groupes : 56 patients traités entre 1988 et 1999 et 39 patients entre 2000 et 2011. Le taux de résection complète est similaire (68 et 74 %) mais les complications postopératoires plus rares dans le groupe le plus récent. Il n’y a pas de différence du taux de survie sans récidive mais une amélioration de la survie globale à 5 ans (93 % contre 64 %). La différence essentielle dans la prise en charge consiste en une radiothérapie systématique dans la période récente y compris après résection complète alors que seules les exérèses incomplètes étaient irradiées dans la première période. Seuls 22 % ont été irradiés dans la première période contre 67 % dans la seconde. Dans cette étude, le mode de radiothérapie a été très variable comprenant des protons dans 19 %, des photons dans 4 %, du Gammaknife dans 4 %, du Cyberknife dans 2 % et de l’IRMT dans 1 %. Si l’on peut penser que la radiothérapie a amélioré les résultats, on ne peut rien dire de l’avantage éventuel d’un mode de radiothérapie par rapport à un autre. Les meilleurs résultats obtenus sont sans doute aussi liés aux progrès des techniques chirurgicales mais on peut aussi noter que dans la période récente, 39 % (n = 15) des patients étaient pris en charge alors qu’ils étaient en récidive contre 66 % (n = 37) dans la première période. Cela suffit à expliquer la diminution du taux de complications notamment les lésions nerveuses (48 % contre 10 %) et vasculaires (14 % contre 3 %). Il est également intéressant de remarquer que dans cette série, le nombre de chirurgie par patient est peu différent d’une période à l’autre. Une seule intervention a été réalisée chez 50 patients, deux chez 37 patients, 3 chez 7 et 4 chez un patient. Une autre grande série de Pékin [408] comporte 106 chordomes de la base du crâne mais l’analyse ne porte que sur les 79 cas ayant eu un suivi correct. L’âge moyen est de 35,6 ans (7 à 65 ans) incorporant donc une population pédiatrique. Le suivi moyen dépasse à peine 5 ans (63,9 mois). La série s’étend sur 12 ans (1993–2005). Une radiothérapie complémentaire a été effectuée chez 40 patients entre 10 et 42 mois après la chirurgie sous la forme le plus souvent d’une radiothérapie stéréotaxique (Gammaknife ou Linac). Aucune explication n’est donnée pour expliquer le long délai entre chirurgie et radiothérapie. À 1, 3, 5 et 10 ans, le taux de survie est de 87, 79, 67 et 59 % et le taux de récidive de 19, 35, 53 et 88 %. Les éléments qu’ils retrouvent comme étant de mauvais pronostic sont une chirurgie (21 %) ou une radiothérapie antérieure (14 %), (autrement dit les formes en récidive), les formes dédifférenciées et une résection incomplète (86 %) (Tableaux 12 et 13). 19.2. Les chordomes du sacrum Les chordomes du sacrum sont supposés représenter au moins un tiers de tous les chordomes ; pour certains ce serait la localisation la plus fréquente. Dans notre expérience, ils comptent pour à peine quelques pour cent. Ce sont sans doute les orthopédistes qui les
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
48 Tableau 12 Principales séries de chordomes de la base du crâne. Principal series of chordoma in the base of the skull.
Ito et al. [52] Sen et al. [409] Takahashi et al. [410] Samii et al. [293] Schultz-E [307] Almefty et al. [177] Tzortzidis et al. [411] Krishnan et al. [338] Pamir et al. [336] Noël et al. [311] Pallini et al. [412] Debus et al. [344] Hug et al. [322]
Durée
n
Âge
Résection totale (%)
5A OS (%)
5A DS (%)
Suivi (mois)
1992–2007 1991–2005 1996–2007 1979–2002 1998–2005 1990–2006 1988–2004 1990–2002 1986–2001 1993–2002 1988–2002 1990–1997 1992–1998
15 71 32 49 96 89 74 25 26 100 22 37 33
43,1 40,7 41,4 39,1 47 38,3 ? 45 40,5 53 50,3 49 48,7
80 58,5 0 49,4 0 45 71,6 0 23,1 16 42,3 0 3
100 75 92,5 65 88,5 74,8 82,4 ? 76,9 80,5 61,5 82 78,8
47,8 64 29,3 15 70 51,4 41 32 46,2 53,8 50 50 59
82,4 66 36,3 63 31 48 96 57,6 48,5 31 62,8 27 33,2
recrutent. Pourtant on ne retrouve qu’une seule publication en provenance de centres franc¸ais sur les chordomes du sacrum dans la littérature depuis l’année 2000 [413] et aucune sur les 12 dernières années. Dans cette publication, sont rapportés seulement 11 cas observés sur 25 ans. Les différents orthopédistes interrogés ne parlent que de quelques cas dans leur expérience. Néanmoins dans la littérature, toutes les grandes séries proviennent de centres orthopédiques. Il est vrai que les séries de chordomes sacrés publiés ne sont pas considérables, même lorsqu’elles sont très étalées dans le temps : Bergh et al. [245] 39 cas du rachis dont 30 sacrés sur 30 ans ; Fuchs et al. [414] 52 cas en 21 ans ; Stacchiotti et al. [350] rapportent 108 chordomes provenant de 2 centres en 28 ans ; Hsieh et al. [415] 20 cas de chordomes du rachis mobile et du sacrum sur 5 ans ; Ruggieri et al. [416] 56 cas sur 30 ans et Clarke et al. [417] 36 cas sur 4 centres en 5 ans. Au mieux cela représente 2 cas observés par centre et par an. L’âge moyen est d’environ 55 ans dans les séries citées plus haut. Il existe en général une prédominance masculine : 34 contre 18 pour Fuchs et al. ; 32 contre 24 pour Ruggieri ; 91 pour 47 femmes pour Stacchiotti. Néanmoins, Bergh et al. comptent 22 femmes pour 17 hommes. La symptomatologie révélatrice est le plus souvent une douleur locale, parfois augmentée par la pression (position assise). Il peut exister aussi des signes de radiculopathie déficitaire du nerf sciatique ou des troubles sphinctériens. Le délai diagnostique est souvent long : 27 mois pour la série de la Mayo Clinic [414] avec des extrêmes de 1 à 180 mois ; 2 ans en moyenne pour la revue de la littérature de Sciubba et al. [418] et même 3 ans pour Moojen et al. [419]. Les tumeurs sont souvent découvertes à un stade avancé ; Stacchiotti et Fuchs donnent un diamètre moyen de 9 cm au moment du diagnostic avec des extrêmes de 6 à plus de 15 cm. La limite supérieure qui conditionne la possibilité d’avoir ou non des troubles sphinctériens en pré- et postopératoire est variable selon les séries, voir Tableau 14.
Tableau 13 Survie globale (survival) et sans la maladie (disease free) comparée selon le mode de radiothérapie. Global survial and disease free time comparing the type of radiotheray used.
Proton Beam Gammaknife Carbon Ion RT fractionnée
Nombre
5-year survival (%)
272 64 106 75
76,7 74,8 88,5 77,4
D’après Di Maio et al. [403].
± ± ± ±
4,5 7,4 5,9 8,6
5-year disease free (%) 57 41,9 72,9 58,4
± ± ± ±
4,8 7,3 6,9 9,9
La limite supérieure en S3 telle que la donne Ruggieri correspond à la limite de résection avec (> S3) ou sans (< S3) troubles sphinctériens. L’ensemble des auteurs considèrent en effet que S3 est le niveau critique. Si S3 est conservé, peu ou pas de troubles sphinctériens sont observés. Bergh et al. indiquent que si S2 est lésé, il y a 8 chances sur 10 que survienne un problème de sphincter anal pouvant aller jusqu’à imposer une colostomie. Il en a réalisé 11 sur 30 cas de chordomes sacrés dont 9 sont également secondaires à une résection rectale. Pour la vessie, si S3 est intact, il n’observe aucun trouble ou alors a minima. Si la résection remonte jusqu’à S3 inclus, 5 malades ont un problème «majeur» dont une sonde à demeure et 1 un problème «mineur». Au-dessus de S3, 18 patients ont un problème «majeur» dont 7 sondes à demeure et 1 n’a qu’un problème «mineur». Sciubba donne les mêmes limites entre S2 et S3. Une résection caudale par rapport à S3 donne parfois des problèmes d’érection. Au-dessus les problèmes d’érection s’associent très fréquemment aux problèmes sphinctériens. C’est aussi ce que mentionne Biagini et al. [421]. Pour Stener et Gunterberg [422], une continence fécale et urinaire n’est possible que si au moins une des deux racines S2 est préservée. Les chordomes sacrés n’ont aucune particularité radiologique que ce soit en Scanner et en IRM. Un certain nombre d’auteurs proposent une biopsie à l’aiguille avant la résection chirurgicale. Ils la considèrent comme utile pour la stratégie, fiable dans ses résultats et sans risque si elle est faite sur le tracé probable de l’incision chirurgicale ultérieure. Sciubba indique une fiabilité de 92 à 96 %. Bergh et al. font systématiquement une biopsie à l’aiguille fine et contre-indique formellement les biopsies larges et encore plus celles faites en transrectal. Il semble que la culture de la biopsie soit surtout le fait des centres orthopédiques y compris en France. Dans le diagnostic des tumeurs osseuses primitives ou secondaires, la biopsie aspiration à l’aiguille fine donne d’excellents résultats pour Bommer et al. [423] avec seulement 10 faux négatifs sur 450 biopsies et 0,2 % de faux positifs. La stratégie thérapeutique est chirurgicale dans toutes les séries qui toutes insistent sur l’intérêt d’une résection complète et si
Tableau 14 Limite supérieure d’extension des chordomes sacrés par série. Upper limit of the extent of the chordoma by series.
Bergh et al. [245] Ruggieri et al. [416] Clarke et al. [417] Fuchs et al. [414] Samson et al. [420] Total
L5
S1
S2
6
16
2 2 0 10
8 8 2 34
4 > S337 0 24 2 30
S3 4 9 10 8 31
S4
S5
0 < S319 12 7 5 24
0
> S3 : 111 ; ≤ S3 : 81.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
5 1 1 7
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
possible en bloc. Les deux seuls facteurs pronostiques qui ressortent de toutes les séries sont parfois le volume tumoral mais toujours les marges de résection. La résection large (wide margin), en général en bloc, est systématiquement opposée aux résections marginales et intra-lésionnelles. Ceci revient à dire que les troubles sphinctériens sont le prix à payer pour obtenir une survie sans récidive. Pour réaliser une résection large et en bloc, il est le plus souvent proposé un abord postérieur pour les chordomes ne dépassant pas S3. En revanche, un abord combiné antérieur et postérieur est utilisé pour ceux dépassant S3. Certains (Fuchs) considèrent que même audessous de S3, l’abord combiné est préférable. Sa série, observée sur 20 ans, est divisée en deux périodes de 10 ans ; dans la deuxième décade, un plus grand nombre d’abords combinés sont réalisés avec de meilleurs résultats en termes de survie et de récidive. À l’inverse, McLoughlin et al. [424] et Clarke et al. [417] décrivent une technique chirurgicale avec un abord uniquement postérieur, permettant une résection en bloc quelle que soit la limite supérieure (Fig. 54A et B). Ces résections en bloc sont impressionnantes et sont parfois complétées par une reconstruction osseuse entre les deux ailes iliaques. Néanmoins, la majorité des chirurgiens n’en réalise pas et pour autant n’observe que peu de problèmes de solidité et de stabilité. Des fractures de fatigue sont rapportées 6 fois sur 30 interventions par Bergh et al. [245] alors qu’il ne fait jamais de reconstruction malgré 22 chordomes remontant au-delà de S2, et 3 fois sur 52 interventions par Fuchs et al. [414] avec 34 chordomes atteignant S2 ou S1. L’essentiel semble être de préserver les articulations sacro-iliaques. Dans le cas contraire une reconstruction lombaire est nécessaire [425–429,579,581]. D’autres complications sont également à craindre et notamment les problèmes de cicatrice et d’infections ; 17 sur 52 pour Fuchs et al. [414] ; 37 sur 56 pour Ruggieri et al. [416], et 9 sur 36 pour Clarke et al. [417]. Ruggieri et al. reprennent 82 patients porteurs de tumeurs du sacrum dont 55 chordomes et 27 tumeurs à cellules géantes (TCG). Dans cette série, les chordomes sont réséqués en bloc alors que les TCG ont une exérèse intralésionnelle. Aucune infection postopératoire n’est observée dans les TCG ; en revanche 23 des 55 chordomes en présentent une nécessitant une reprise chirurgicale. L’infection survient le plus souvent dans le mois suivant l’intervention mais 7 n’apparaissent qu’entre 1 et 6 mois. Le germe en cause est en règle, un entérocoque, Escherichia coli ou Pseudomonas aeruginosa. Les complications vasculaires sont assez rares (2 lésions des veines iliaques pour Ruggieri). Ce sont néanmoins des interventions souvent hémorragiques pour lesquelles il a même été proposé en peropératoire, une interruption transitoire de l’aorte abdominale par ballonnet [430] ; d’autres réalisent une embolisation préopératoire [431,432]. La récidive, quel que soit le type de traitement (résection en bloc ou non), est inéluctable. Cependant, après une résection large, elles sont généralement plus tardives. Jeanrot et al. [413] observent 9 récidives sur 11 patients survenues entre 5 mois et 8 ans. Seuls deux malades ont eu une résection en bloc et ce sont ceux qui ont eu la récidive la plus tardive (8 ans). Ruggieri dans sa revue de littérature indique que le risque de récidive locale est de 5 à 17 % après chirurgie large alors qu’il varie de 71 à 81 % en cas de résection marginale ou intra-lésionnelle ; par ailleurs il mentionne un allongement du délai entre chirurgie et récidive. Bergh et al. réalisent 23 résections larges et observe 4 récidives et 6 décès par métastase, alors que 13 des 16 résections marginales ou intra-lésionnelles récidivent et 4 décèdent. En revanche, le taux de métastases est similaire (26 et 31 %). Fuchs et al. rapportent une seule récidive sur 21 résections complètes et, en revanche, 22 sur 31 résections « inadéquates ». Dans presque toutes les séries, le facteur pronostique qui ressort avec le plus d’évidence est la qualité de la résection. Seul Samson
49
et al. [420] indiquent que pour eux, seule la taille du chordome joue un rôle. La plupart des auteurs n’utilisent pas la radiothérapie lorsque la résection a été large, et la réserve pour les résections incomplètes ou les récidives. Il est généralement considéré que la radiothérapie apporte quelque chose dans ces deux indications. Bergh et al. par exemple rapportent 3 cas de chirurgie intra-lésionnelle suivie de radiothérapie avec des récidives à 2,7, 6,5 et 9,2 ans. La limite supérieure du chordome n’est jamais un facteur pronostique. En revanche, il est souvent mentionné que les malades primaires ont une meilleure évolution que les patients transférés après une première chirurgie dans un autre centre [245,433]. Le tableau suivant récapitule les principales données des plus grandes séries de la littérature (survie, récidive, résection) (Tableau 15). 19.3. Les chordomes du rachis mobile Les séries de chordomes du rachis mobile sont beaucoup moins nombreuses que celle du sacrum et encore moins de la base du crâne, même si l’on prend en compte les publications orthopédiques. Comme pour les localisations sacrées, on pourrait douter de leur réelle fréquence quel que soit le chiffre retenu qui va de 13 à 30 % selon les auteurs. La réalité semble être autour de 15 %. Il y a sans doute plusieurs explications à cela dont 2 principales. L’une tient au fait que les localisations lombaires sont souvent regroupées avec celles du sacrum, et de la même fac¸on, les localisations de la charnière craniocervicale incluant le clivus inférieur sont regroupées soit avec celles de la base du crâne soit avec celles du rachis cervical. Une série relativement importante (37 cas de 1994 à 2008) regroupe même 9 chordomes sacrococcygiens et 28 chordomes cervicaux [436]. Il est donc difficile d’isoler les chordomes lombaires et cervicaux. L’autre explication est lié à la prise en charge des lésions vertébrales par de nombreux centres neurochirurgicaux ou orthopédiques différents contrairement aux autres localisations plus souvent concentrées dans des centres «experts» : orthopédiques pour les chordomes sacrés et neurochirurgicaux pour ceux de la base du crâne. L’expérience de chaque centre est donc souvent trop limitée pour justifier une publication ne portant que sur les chordomes. Ainsi l’équipe du Queen Square à Londres [437] rapporte 97 cas de la charnière craniocervicale incluant le rachis cervical supérieur et la partie basse du clivus observés dans 2 centres sur une période de 25 ans (1982–2007) ; Carpentier et al. [438] et Carpentier et al. [313] publient une série de 36 cas observés à Lariboisière sur 11 ans dont 28 de la charnière (Clivus, C1, C2) et seulement 8 du reste du rachis cervical ; Bjornsson et al. [439] présente la série de la Mayo Clinic comprenant 40 cas observés sur 57 ans (1933–1990). Sundaresan et al. [440] colligent en 27 ans (1949–1976) 54 chordomes dont 18 du rachis mobile. Stacchiotti et al. [433] rapportent 138 chordomes sacrés et spinaux colligés dans deux centres entre 1980 et 2008 dont seulement 21 lombaires et 9 cervico-thoraciques. Toutes les séries, sauf 2, ne comportant que des chordomes du rachis mobile ne dépassent pas 15 patients : Wang et al. [441] : 14 cervicaux en 19 ans ; Barrenechea et al. [442] : 7 cervicaux en 14 ans ; Klekamp et Samii [443] : 9 cervicaux en 17 ans ; Murali et al. [444] : 8 cervicaux. Les deux séries les plus importantes sont celles de Bjornsson et al. [439] qui compte 40 cas (19 cervicaux, 14 lombaires et 7 thoraciques) mais sur 57 ans et celle de Boriani et al. [445] avec 52 cas (15 cervicaux, 7 thoraciques et 30 lombaires) là encore sur près de 50 ans (1954–2002). Leur hétérogénéité est donc évidente. Il n’y a pas de véritables séries sur le rachis lombaire encore moins sur le rachis thoracique. Pour ce dernier seulement 30 cas ont pu être répertoriés depuis 1902 par Fontes et O’Toole [446] en 2012. La plupart des publications sont des «case reports» ; 12 sont ainsi des cas isolés et 18 proviennent de séries
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 50
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 54. A. Exérèse monobloc d’un chordome du sacrum de L5 à S3. B. Schéma de la technique d’exérèse monobloc par abord postérieur. A. En bloc resection of a sacral chordoma from L5 to S3. B. Scheme of the en bloc resection technique by a posterior approach. D’après McLoughlin et al. [424] ; publié avec l’autorisation de Wolters Kluwer.
mélangeant toutes les localisations du rachis mobile soit un total de 146 chordomes. La localisation thoracique représenterait donc 12 % du rachis mobile et autour de 1 % de la totalité des chordomes. Il est encore plus difficile de faire une évaluation des chordomes lombaires et par voie de conséquence de celle des chordomes cervicaux. Bjornsson et al. présentent 40 chordomes dont 19 cervicaux (47,5 %), 14 lombaires (35 %) et 7 thoraciques (17,5 %) ; Boriani et al. sur 52 chordomes : 15 cervicaux (29 %), 30 lombaires (57,5 %) et 7 thoraciques (13,5 %) ; pour Bergh et al. : 39 chordomes dont 30 sacrés, 5 cervicaux et 1 thoracique ; pour Stacchiotti : 108 sacrés, 21 lombaires et 9 cervico-thoraciques. Wellinger [447–449] collige dans une revue de littérature (dont la publication de Leman
et al. [450] en 1965), 148 cas du rachis mobile ; parmi ces 148 cas, 60 sont cervicaux (40 %), 32 thoraciques (21,6 %) et 56 lombaires (38,4 %). Sundaresan et al. [440] publient une série personnelle de 54 cas pris en charge de 1949 à 1976, dont 36 sacrés, 11 lombaires, 2 thoraciques et seulement 5 cervicaux. Finalement c’est l’étude coopérative franc¸aise de Fuentes et Benezech [294] qui paraît la plus fiable pour apprécier la répartition des chordomes en tout cas en milieu neurochirurgical. Ils collectent 206 tumeurs primitives du rachis incluant 14 chordomes sacrés et 23 du rachis mobile dont 10 cervicaux (5 sous-occipitaux), 2 thoraciques et 11 lombaires soit respectivement 43,5, 8,7 et 47,8 %. Il paraît raisonnable de conserver l’idée que les cervicaux et
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
51
Tableau 15 Résultats des principales séries de chordomes du sacrum. Results from the principal series of chordoma of the sacrum.
Samson et al. [420] n = 21 Cheng et al. [434] n = 23 Jeanrot et al. [413] n = 11 Bergh et al. [245] n = 39 (30 S) Baratti et al. [435] n = 28 Fuchs et al. [414] n = 52 Stacchiotti et al. [433] n = 138 (108 S) Ruggieri et al. [416] n = 56
Récidive
Meta
DcD
19 %
19 %
19 %
OS 5A
OS 10A
DFS 5A
DFS 10A
Résection large
77 %
50 %
11 (52 %)
86 %
49 %
58 %
22 %
7 (30 %)
0%
2 (18 %)
81 %
27 %
63 %
64 %
18 %
18 %
40 % 6 ans 60 %
30 % 6,2 ans
25 %
84 %
64 %
36 %
88 %
49 %
60 % 8 ans 60,6 %
24 %
11 (39 %)
44 %
31 %
75 %
52 %
59 %
46 %
21 (40 %)
42 %
32 %
36 % 7,8 A 50 %
78 %
54 %
48 %
26 %
48 (35 %)
46 %
30 %
97 %
71 %
65 %
52 %
31 (60 %)
31 % 9,5 A
23 (59 %)
DcD : décédé ; OS : overall survival (à 5 ans et 10 ans : 0S 5A et 0S 10A) ; DFS : disease free survival (à 5 ans et 10 ans : DFS 5A et DFS 10A) ; Resect : résection ; S : sacrum pour les deux séries de Stacchiotti et al. [433] et Bergh et al. [245] qui comptent aussi des chordomes du rachis. DcD: death; OS5A: overall survival at 5 years; OS10A: overall survival at 10 years; DFS5A: disease free survival at 5 years; DFS10A: disease free survival at 10 years; resec: resection; S: sacrum for the 2 series of Stacchiotti et al. [433] and Bergh et al. [245] which include also chordomas of the mobile spine.
lombaires sont prédominants et à peu près équivalents avec environ 40 % chacun alors que le rachis thoracique ne compte que pour 15 %. Les chordomes du rachis lombaire sont plus souvent observés par les orthopédistes (moins de signes neurologiques) et ceux du rachis cervical par les neurochirurgiens. Il n’y a pas de vraie différence avec les autres chordomes concernant l’âge et le sexe : prédominance masculine peut-être plus marquée : 37 hommes et 15 femmes pour Boriani et al. [445] mais 14 hommes et 14 femmes sur les 28 chordomes cervicaux de Zhou ; âge moyen un peu plus jeune (de 34,4 à 59 ans). Le délai diagnostique moyen varie de 6 mois (Wang [441]) à 14 mois [439]. La symptomatologie est longtemps limitée à des douleurs locales plus souvent que radiculaires. Les signes déficitaires n’apparaissent que tardivement. Au moment du diagnostic, la douleur locale reste prépondérante (100 % pour Boriani et al., 93 % pour Wang et 86 % pour Choi) ; la douleur radiculaire s’observe dans environ 50 % des cas mais seulement dans 11 % pour Boriani et al. et les signes de myélopathie, le plus souvent débutants varient de 18 à 71 % (31 % pour Boriani et al.). Pour les localisations cervicales hautes (charnière craniocervicale), s’ajoute souvent à ces symptômes, une obstruction pharyngée avec dysphagie et dysphonie. La tumeur n’intéresse en général qu’une seule vertèbre ; c’est le cas dans 85 % des cas de l’étude radiologique de de Bruïne et Kroon [451] portant sur 14 patients (3 cervicaux, 4 thoraciques et 7 lombaires). Dans la revue des 30 cas du rachis thoraciques, seuls deux cas sont pluri-vertébraux Les chordomes lombaires sont également souvent monovertéral (hormis les formes lombosacrées). Les chordomes cervicaux paraissent plus souvent pluri-vertébraux ; dans la série de Barrenechea et al., 4 concernent 2 vertèbres, 3 s’étendent sur 3 niveaux et 1 sur quatre niveaux ; dans celle de Zhou, 11 sont monovertébraux, 9 bivertébraux, 5 trivertébraux, 2 quadrivertébraux et un s’étendait du clivus à C7. La chirurgie fait de plus en plus souvent appel à des résections en bloc, en particulier pour les formes monovertébrales. D’ailleurs beaucoup parmi les publications récentes sur les chordomes du rachis concernent les techniques en général combinées (abords antérieur et postérieur) d’exérèse monobloc. Pour le rachis cervical : [452–460]. On peut ajouter Massimiliano et Giulio [461] en 2011 qui rapportent l’exérèse en bloc d’un chordome cervicothoracique étendu sur 6 niveaux.
Pour le rachis thoracique et lombaire : [462–469]. Néanmoins, une série plus importante est celle de Boriani et al. qui mentionne 18 exérèses en bloc sur les 52 chordomes du rachis observés de 1954 à 2001 et surtout réalisées dans la période récente. Tous les auteurs qui publient sur ce sujet suggèrent que l’exérèse en bloc est sans doute préférable car elle donnerait de meilleurs résultats en termes de survie et de récidives. Pour autant, compte tenu de la rareté des séries et de leur petit nombre, la supériorité de l’exérèse monobloc sur l’exérèse par morcellement extra capsulaire (au-delà des limites tumorales) n’est pas vraiment démontrée. Quoiqu’il en soit, l’exérèse large (et peut-être monobloc) paraît supérieure à l’exérèse intra-lésionnelle incomplète ; ainsi dans la série de Boriani et al., 12 des 18 résections en bloc sont sans récidive à 8 ans en moyenne (de 48 à 155 mois) ; les 6 autres qui, soit avaient été opérés préalablement dans un autre centre, soit avaient des limites d’exérèse contaminées, ont récidivé et l’un est décédé. Les 16 exérèses intra-lésionnelles mais extracapsulaires ont toutes récidivé sauf 4. Les 14 autres, ayant eu soit une exérèse par morcellement intracapsulaire avec ou sans radiothérapie soit une radiothérapie seule, ont tous récidivé en moins de deux ans et sont décédés ensuite plus ou moins rapidement. Dans la série de Boriani et al. [445], il y a au total 32 récidives soit 66 %, 19 fois avant 2 ans et 30 fois avant 5 ans ; la récidive s’observe dans 100 % des cas entre 18 et 20 mois s’il s’agit de chirurgie palliative intra-lésionnelle ou de radiothérapie seule (I) ; dans 75 % à 30 mois pour les exérèses extracapsulaires suivies de radiothérapie (II) ; dans 50 % à 51 mois pour les exérèses en bloc mais contaminées suivies de radiothérapie (III) et dans 20 % entre 56 et 94 mois pour les exérèses larges et en bloc (IV). Les malades sont décédés suivant les mêmes modalités, 11 fois sur 14 (I), 8 fois sur 16 (II) et 1 fois sur 18 (III et IV). Par contre, il y a peu de métastases, une dans les tissus mous, 4 dans les os et 13 dans les poumons, soit un total de 18 métastases mais sans que l’on sache s’il y avait des métastases multiples chez certains malades. Elles surviennent dans un délai variant de 1 à 119 mois et toujours après des exérèses intra-lésionnelles sauf une observée après exérèse en bloc. Cloyd et al. [457] font une revue de littérature des tumeurs cervicales réséquées en bloc et retrouve 18 cas dont 12 chordomes localisés de C2 à C7 et envahissant une ou deux vertèbres. Ils indiquent un taux de survie sans maladie de 73,5 % à 5 ans pour ces patients. Trois patients sont vivants et présentent la maladie, 2 sont décédés de la maladie et les 13 autres sont vivants sans
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 52
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
signe de maladie avec un suivi allant de 12 à 149 mois (en moyenne 47 mois). Dans la série de Zhou (37 cas sacrés et cervicaux), si on extrait les 28 cervicaux, tous ont eu une exérèse intra-lésionnelle plus ou moins complète dont 15 suivis de radiothérapie ; 15 sont des patients primaires, les autres ayant déjà été opérés de une à 4 fois dans un autre centre. Le suivi moyen est de 43 mois (6–196). Une seule métastase est observée. On compte 12 décès liés à la maladie sauf un postopératoire, 4 perdus de vue, 3 vivants avec la maladie et 8 vivants sans maladie. L’analyse statistique est faite en combinant les 9 chordomes sacrés et fait ressortir en univarié que les facteurs de mauvais pronostic sont les limites d’exérèse inadéquates, une intervention précédente dans un autre centre et l’extension sur plusieurs vertèbres. En analyse multivariée, seules les limites d’exérèse et l’extension tumorale sont des facteurs de mauvais pronostic indépendants auxquels il faut ajouter l’atteinte du rachis cervical haut (16 des 28 chordomes cervicaux). Ce dernier facteur avait déjà été souligné par notre équipe [154]. Il semble donc important de faire une exérèse la plus complète possible et de préférence monobloc. En revanche, en cas de récidive l’exérèse en bloc ne paraît pas justifiée de même que lorsque l’extension tumorale est trop importante. Boriani et al. considèrent qu’il est préférable dans ces cas de chercher à faire une exérèse par morcellement mais extracapsulaire suivie de radiothérapie ; néanmoins, ils soulignent que ce type d’exérèse par morcellement n’est pas idéal au vu de 5 récidives sur 6 patients traités en récidive et de 5 récidives sur 8 exérèses en bloc mais contaminées. Pour eux, une exérèse en bloc contaminée n’est pas meilleure qu’une exérèse intra-lésionnelle mais extra capsulaire avec un risque chirurgical moindre. À titre d’indication et pour souligner la lourdeur des exérèses en bloc, dans sa revue de littérature des exérèses en bloc au niveau cervical, Cloyd et al. indiquent des durées opératoires allant de 6 à 17 heures et des pertes sanguines de 600 à 8700 mL. Pour discuter des modalités d’exérèses, la plupart des auteurs orthopédiques s’appuie sur une classification appelée WBB (Weinstein-Boriani-Biagini [549]) qui segmente la vertèbre en secteurs radiaires tout autour de la vertèbre et concentriques de la surface vers la profondeur avec un item particulier pour l’artère vertébrale ; l’item D, le plus profond, correspond à l’atteinte de la dure-mère qui doit alors être réséquée pour faire une exérèse complète. Boriani [445] est une fois de plus la seule série (n = 52) à donner ces détails : atteinte de toute la vertèbre dans 10 cas, du seul corps vertébral dans 18 cas, du corps et d’un pédicule dans 10 cas, du corps et de deux pédicules dans 12 cas et de l’arc postérieur dans 2 cas. L’extension se fait jusqu’à la dure-mère dans 39 cas. La plupart des chordomes du rachis mobile sont localisés sur le corps vertébral, les pédicules et les massifs articulaires. Néanmoins quelques cas localisés à l’arc postérieur ont été rapportés : 2 cas dans la série de Boriani et al. [445], un cas par Chadha et al. [470] en 2005 et un autre par Kamal et al. [471] en 1984. Une autre classification proposée par Enneking et al. [472] permet de comparer les chordomes, assimilés aux sarcomes de bas grade, aux autres sarcomes de bas (I) et de haut (II) grade et selon qu’ils restent intra- (A) ou extra- (B) compartimentaux ou ont une extension à distance régionale ou métastatique (III). La Fig. 55 montre ce que seraient idéalement les différents types d’exérèse ; ceci paraît éventuellement applicable sur les membres, exceptionnellement sur le rachis, jamais au niveau du crâne. Les courbes de survie qui sont données par Enneking et al. ne paraissent pas non plus adaptées aux chordomes qui sont classés dans les grades IA (13,5 %), IB (82,5 %) ou III (4 %) et devraient donc avoir un bien meilleur pronostic selon cette classification. Cette revue des séries de chordomes permet de penser que l’exérèse la plus complète possible est le but à atteindre ; elle doit être faite en bloc lorsque c’est raisonnablement possible sinon par morcellement mais extra capsulaire. L’exérèse en bloc est de moins en moins envisageable lorsque l’on prend les localisations de bas en haut,
c’est-à-dire du sacrum où elle est fréquemment possible à la base du crâne où elle ne l’est quasiment jamais ; elle est assez souvent raisonnable en lombaire (chordome limité à une partie d’une seule vertèbre) mais rarement en cervical (chordome pluri-vertébral et étendu dans et hors des vertèbres) (Tableaux 16 et 17). À titre anecdotique mais néanmoins intéressant, il faut mentionner le cas rapporté par Radl et al. [484] d’un homme de 24 ans présentant un chordome au niveau de C2 mesurant 2,5 × 2 × 4 cm révélé par des paresthésies des mains et du thorax puis des troubles sphinctériens. Deux biopsies percutanées sont réalisées mais non contributives puis une troisième à ciel ouvert par hémi-laminectomie de C1 confirmant le diagnostic de chordome. Le patient est traité par dexamethasone avant une intervention d’exérèse mais présente de la fièvre. Quand il est opéré, on trouve un abcès à E. Coli qui est drainé. Il est traité par Ciprofloxacine pendant 3 semaines permettant la guérison de l’infection. Un premier contrôle IRM à 2 semaines montre la disparition complète de la tumeur ; ceci sera confirmé par d’autres contrôles IRM, le dernier à 24 mois. Aucune image résiduelle n’est visible. Les auteurs spéculent sur l’effet immuno-thérapeutique de l’infection produisant des cytokines voire sur celui des stéroïdes administrés au total pendant 12 semaines ou même de l’antibiothérapie.
20. Analyse de la série Lariboisière De 1992 à 2012, soit sur une période de 20 ans, 135 patients porteurs de chordomes (CH) ont été pris en charge à Lariboisière. En fait, ce sont 136 CH qui ont été traités car l’un des patients a présenté une deuxième localisation cervicale en C5, 22 ans après une localisation à la charnière craniocervicale (CCC), ce qui exclut pratiquement la possibilité d’une métastase. Cette série comprend 4 localisations principales : • la base du crâne (B) incluant essentiellement la région sellaire et caverneuse ainsi que les 2/3 supérieurs du clivus avec des extensions variables latéralement vers le rocher et la fosse temporale, en avant vers le sinus sphénoïdal et le pharynx et en arrière vers le tronc cérébral et le diencéphale (n = 58) ; • la charnière craniocervicale (CCC) comprenant le 1/3 inférieur du clivus et les deux premières vertèbres cervicales, là encore avec des extensions variables vers le foramen jugulaire, le pharynx et la jonction bulbo-médullaire (n = 47) ; • le rachis mobile mais notre série ne comprend que des localisations cervicales (RC) à l’exception de deux CH lombaires regroupés avec les CH sacrococcygiens (n = 23) ; • la région lombosacrée (RLS) (n = 8). L’analyse a été faite pour chacune des localisations, mais aussi, pour certains items, en regroupant soit toutes les localisations (en excluant cependant les CH RLS car trop peu nombreux et trop particuliers), soit seulement certaines localisations, par exemple : CCC et RC ou CCC et B. Dans tous les groupes, quelle que soit la localisation, certains patients ont été pris en charge directement à Lariboisière, d’autres après un geste effectué dans un autre centre. Dans ce dernier cas, soit le geste était une simple biopsie ou une exérèse partielle réalisée moins de 6 mois avant son transfert à Lariboisière et le patient était également considéré comme primaire ; soit le geste était une exérèse quelle que soit l’importance, mais datant de plus de 6 mois (le délai moyen varie de 25 à 40 mois selon les localisations) avec une progression tumorale, et le patient était alors considéré comme secondaire. Le Tableau 18 détaille les modalités (primaire ou secondaire) de prise en charge selon les localisations.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
53
Fig. 55. A. Définition des différents types d’exérèse d’un sarcome des parties molles. B. Définition des différents types d’exérèse d’un sarcome osseux. C. Probabilité de survie du chordome et des sarcomes selon leur type et leur extension. A. Definition of the different modalities of resection of soft tissues sarcomas. B. Definition of the different modalities of resection of osseous sarcomas. C. Survival probability of chordoma and sarcomas according to type and extension. C : d’après Enneking et al. [472] ; publié avec l’autorisation de Wolters Kluwer.
Tableau 16 Principales données des chordomes du rachis mobile. Principal results on the chordoma of the rachis mobile. P
n
Âge
Res
Rec
Murali et al. [444] Bjornsson et al. [439]
1971–1981 1933–1990
8C 40 :7 T 19 C,14 L
47 56
– SubT
5/8
Klekamp et Samii [443] Carpentier et al. [313]
1971–1994 1989–2000
9C 36 (14 Rec)
45 39,6
Boriani et al. [445]
1954–2001
59
35 %
66 %
Barrenechea et al. [442]
1992–2006
52 :30 L 7 T, 15 C 7C
34,4
6/7
30 %
Choi et al. [437] Wang et al. [441]
1982–2007 1989–2006
97 C + CCJA 19 C + CCJA
54
0S5A
RFS5A
57 %
Suivi 0–46 A
63 % DcD 42 % DcD À 5 ans 100 % 58 %
Meta
80 % 1aire 50 % 2aire 50 %
55 % 85,7 %
5%
70 % 1aire 0 % 2aire 23 % à 8A
0
1–11 A
18
3–155 M
70 % à 2A
30 %
50 %
0
23 M 7–169 50,4 M 58,6 M 8–120
P : période d’observation ; n : nombre de cas ; Res : résection complète ; Rec : récidive ; OS5A : survie à 5 ans ; RFS5A : sans évolution à 5 ans ; Meta : métastase ; 1aire : malade primaire ; 2aire : malade en récidive ; C : cervical ; T : thoracique ; L : lombaire ; CCJA : charnière craniocervicale ; SubT : exérèse subtotale. P: study period; n: number of cases; Rec: recurrence; OS5A: overall survival at 5 years; RFS 5A: recurrence free survival at 5 years; Meta: metastasis; 1aire: primary; 2aire: secondary; C: cervical; T: thoracic; L: lumbar; CCJA: cranio-cervical junction; SubT: subtotal.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
54 Tableau 17 Principales données des chordomes thoraciques. Principal results on thoracic chordoma.
Buraczewski et Rudowski [473] Levowitz et al. [474] Sundaresan et al. [440] Schwarz et al. [475] Cotler et al. [476] De Bruine et Kroon [451] Ahrendt et Wesselhoeft [477] Bjornsson et al. [439] Taki et al. [478] Murphy et al. [479] Bergh et al. [245] Topsakal et al. [480] Smolders et al. [192] Boriani et al. [445] Delgado et al. [481] Wang et al. [482] Cho et al. [483] Fontes et O’Toole [446]
Période
n total rachis
n thoracique
Âge/sexe
Niveau
1957 1966 1979 1985 1983 1988 1992 1993 1996 1998 2000 2002 2003 2006 2008 2008 2009 2012
1 1 18 1 14 1 2 40 1 1 12 1 10 52 1 1 1 1
1 1 2 1 4 1 2 6 1 1 1 1 1 7 1 1 1 1
14/F 39/F
T4 T2
15/F
T3
68/F 37/2 M 6 M/1 M 25/F 59/M 40/M 44/F
T7 T4
Le début de la maladie a été considéré au moment du diagnostic (qu’il soit fait à Lariboisière ou non). Il a été envisagé de le considérer au début des symptômes mais, si pour la plupart des patients, le délai diagnostique ne dépasse pas quelques mois, pour un nombre non négligeable d’entre eux, il est de plusieurs années (délai le plus long : 213 mois soit près de 18 ans pour les CH B, 47 mois pour les CH CCC et 84 mois pour les CH RC). Ces délais ont été vérifiés et semblent authentiques ; ils correspondent à des patients négligents ou ayant des difficultés de prise en charge du fait de leur origine géographique, mais aussi à des patients présentant des symptômes peu invalidants ou transitoires (diplopie). La qualité de l’exérèse a été appréciée lors de la première prise en charge (que ce soit à Lariboisière ou dans un autre centre). Cette première exérèse a pu être réalisée en un ou plusieurs temps chirurgicaux et même en un ou plusieurs centres. Pour uniformiser et surtout simplifier l’analyse qui autrement conduirait à de multiples sous-groupes de petite taille, la radiothérapie a été considérée de fac¸on univoque quel que soit le moment où elle a été effectuée lors de la prise en charge ; le plus souvent après la première exérèse et en général après une exérèse aussi complète que possible. Elle a le plus souvent été réalisée à l’aide de protons isolément ou en combinaison avec des photons (n = 76), mais parfois sous la forme d’une radiothérapie conventionnelle (n = 17) ou d’une radiochirurgie (Cyberknife ou Gammaknife) (n = 7). 20.1. Chordomes de la base du crane On compte 58 patients (25 femmes, 33 hommes, sexe ratio M/F = 1,32), âgés de 46,4 ± 17 ans (extrêmes de 8 à 74 ans). Le symptôme initial le plus fréquent est une diplopie (n = 43) par atteinte d’un nerf oculomoteur (l’abducens le plus souvent).
46/M 30/M 9/M 89/M
T2 T8 T1 + T12 T4 T7
T4 T3 T10
Cette diplopie est fréquemment transitoire et ne devient définitive qu’après un ou plusieurs épisodes. Le deuxième symptôme sont les céphalées (n = 19), puis viennent les troubles visuels (acuité ou champ visuel) n = 15, les déficits d’autres nerfs crâniens : V = 6, VII = 2, VIII = 6, Nerfs mixtes = 6 ; une obstruction nasale est rapportée 5 fois, un trouble endocrinien 3 fois et un déficit moteur 4 fois. Lorsque le patient est pris en charge à Lariboisière, que ce soit en première ou deuxième intention, la diplopie est quasi constante (n = 54), avec 35 atteintes du VI dont 2 bilatérales, 14 du III et 5 du IV ; les céphalées sont notables 23 fois. On retrouve les autres atteintes avec la même fréquence avec néanmoins un peu plus d’obstruction nasale (n = 8) et de troubles endocriniens n = 10 sans doute du fait des patients en récidive. Le délai diagnostique moyen est de 11,2 ± 35 mois, avec des extrêmes allant de 0 à 213 mois (17,7 ans). Le CH était purement extradural chez 21 patients et s’étendait en intradural chez 37 autres (64 %) L’exérèse (lors de la première prise en charge) a été partielle dans 24 % des cas, subtotale dans 47 % et totale dans 29 %. Les résidus tumoraux lors d’exérèse incomplète étaient le plus souvent situés au niveau du sinus caverneux (n = 30) et devant le tronc cérébral (n = 6). L’exérèse a été réalisée 39 fois en un temps et un seul abord chirurgical, 3 fois avec deux temps, 2 fois avec 3 temps et une fois 4 temps ; l’endoscopie endonasale a été utilisée 26 fois ; enfin deux fixations craniocervicales ont été nécessaires. À noter que 18 patients ont subi un test d’occlusion de la carotide interne préopératoire dont 13 étaient bien tolérés et conduisant à 5 occlusions préventives. La mortalité opératoire est nulle ; la morbidité postopératoire inclut 2 complications ischémiques liées à des perforantes sur des
Tableau 18 Les modalités de prise en charge. The types of treatment. Prise en charge
Primaire Direct Complément Sous-total Secondaire Total
Total
52 35 87 (64 %) 49 (36 %) 136
Répartition selon la localisation Base
CCC
RC
RLS
24 20 44 (77 %) 14 (23 %) 58
16 10 26 (55 %) 21 (45 %) 47
8 2 10 (43 %) 13 (57 %) 23
4 3 7 (87,5 %) 1 (12,5 %) 8
CCC : charnière craniocervicale ; RC : localisations cervicales ; RLS : région lombosacrée. CCC: cranio-cervical junction; RC: cervical spine; RLS: lumbo-sacral spine.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
patients en récidive et 10 méningites. Il a fallu mettre en place 6 dérivations ventriculaires externes et 9 internes. Deux patients ont nécessité une trachéotomie transitoire. Une réintervention a été nécessaire chez 4 patients pour un hématome extradural (1 cas), une fuite de LCR (2 cas) et un épistaxis (1 cas) et il faut ajouter une embolisation d’hémostase. Douze patients ont séjourné en réanimation de 1 à 20 jours. La durée d’hospitalisation a été en moyenne de 26 ± 25 jours. Une radiothérapie complémentaire a été réalisée dans 79 % des cas ; 12 patients n’ont eu aucune radiothérapie. Parmi les patients irradiés, 93 % ont rec¸u des protons, 5 % une radiothérapie conventionnelle et 2 % une radiochirurgie. Au contrôle réalisé 3 à 6 mois après la chirurgie, la symptomatologie s’est le plus souvent nettement améliorée puisqu’il ne reste plus que 11 paralysies oculomotrices, 6 troubles visuels, 5 déficits endocriniens, 2 atteintes du V, une seule atteinte des nerfs mixtes et une atteinte du facial. Treize patients sont asymptomatiques. Le suivi à long terme est de 78 ± 79 mois avec 22 décès soit 39 %, une seule métastase à 5 ans et 21 récidives (37 %). Le délai moyen d’apparition d’une récidive est de 79 ± 88 mois. Le délai moyen du décès est de 94 ± 85 mois et celui de la survie sans progression de 64 ±71 mois. Une récidive est observée dans 66,5 % des cas après exérèse partielle, dans 30,7 % des cas après exérèse subtotale et dans 25 % des cas après exérèse totale. Le décès est observé dans 50 % des cas après exérèse partielle, dans 42 % des cas après exérèse subtotale et dans 19 % des cas après exérèse totale. Sur 40 patients analysables, 27 ont un résidu stable ou pas de résidu en IRM lors du dernier contrôle alors que 13 sont en progression tumorale. 20.2. Chordomes de la charnière craniocervicale Ce groupe comprend 47 patients (18 femmes, 29 hommes, sex-ratio M/F = 1,61) âgés de 36 ± 16 ans avec des extrêmes de 11 à 70 ans. Les symptômes initiaux les plus fréquents sont les douleurs locales (n = 42) et l’atteinte des nerfs mixtes (n = 17) et on note une obstruction nasale 9 fois et des troubles moteurs 2 fois. À l’arrivée à Lariboisière, sont observées 28 atteintes du XII (7 bilatérales), 10 du XI (2 bilatérales), 14 du X (1 bilatéral), 11 du IX (1 bilatéral) ; les autres atteintes nerveuses sont plus rares : diplopie : 5 cas ; V : 1 cas ; VII : 2 cas ; VIII : 2 cas. Une obstruction nasale est rapportée 16 fois et des cervicalgies 29 fois. À l’examen on retrouve 5 déficits moteurs et 9 troubles sensitifs divers. Aucun trouble sphinctérien n’est observé. Le délai diagnostique est de 9,7 ± 13 mois avec des extrêmes allant de 0 à 47 mois. La moitié des CH de la CCC sont extraduraux (n = 24) et 23 ont une extension intradurale. L’exérèse a été partielle dans 29 % des cas, subtotale dans 48 % et totale dans 23 %. Chez 35 patients un seul abord a été effectué alors que 2 ont été nécessaires chez 6 patients, 3 chez 4 patients et 5 ou 6 une fois chacun. L’endoscopie endonasale a été utilisée 5 fois Dix-huit tests de clampage de l’artère vertébrale, tous bien tolérés, ont été effectués mais aucun clampage préopératoire. Néanmoins, l’artère vertébrale a été sacrifiée 6 fois en cours d’intervention. Une fixation a été réalisée dans 60 % des cas : craniocervicale chez 25 patients, antérieure chez 3 autres. Ces fixations ont été effectuées 3 fois avant l’exérèse, 12 fois après et 13 fois simultanément. Il n’y a pas de mortalité opératoire. La morbidité comprend 8 problèmes de cicatrice, 5 méningites, 5 troubles de déglutition, 2 paralysies du XII, 4 Claude Bernard-Horner, 5 déficits moteurs et une plaie de l’œsophage. Douze trachéotomies et 7 gastrostomies ont été nécessaires. Enfin, il faut signaler une embolie pulmonaire. Une réintervention a du être réalisée chez 6 patients pour différents problèmes : une rupture de l’artère vertébrale, un saignement
55
pharyngé, deux infections locales, une collection liquidienne et une fuite de LCR. Une dérivation ventriculaire externe a été mise en place 14 fois en per- ou postopératoire et deux dérivations internes. Dix-sept patients ont du faire un séjour en réanimation, 9 de moins de 3 jours, 3 de 3 à 15 jours et 3 de plus de 15 jours. La durée d’hospitalisation moyenne est de 35,1 ± 37 jours avec des extrêmes allant de 5 à 180 jours. Une radiothérapie a été réalisée chez 38 patients (85,7 %) dont 26 par protons (68,4 %), 2 par radiochirurgie et 8 par radiothérapie standard. Le contrôle effectué entre 3 à 6 mois plus tard retrouve une atteinte persistante des nerfs mixtes IX et X chez 15 patients, 6 paralysies du XII, une du XI, 2 paralysies faciales et une atteinte oculomotrice. Cinq patients se plaignent de douleurs locales. Des métastases sont observées chez 8 patients : cutanées (n = 2), pulmonaires (n = 2), ganglionnaires (n = 5), musculaire (n = 1), tentorielle (n = 1) et rachidienne (n = 1). Une intervention pour exérèse de ces métastases a été réalisée chez 7 patients. Deux essaimages ont eu lieu : un sur la queue de cheval et un dans les fosses nasales Le suivi moyen est de 74 ± 57 mois avec 26 décès (59 %) et 26 récidives (59 %). Le délai moyen de survenue des métastases est de 58,5 ± 73 mois, celui des récidives est de 37 ± 34 mois et celui du décès de 62,5 ± 38,5 mois. La survie sans progression est de 46,5 ± 48 mois. Une exérèse partielle est suivie d’une récidive chez 85,7 % des patients et du décès chez 69 %. Une exérèse subtotale conduit à 57 % de récidives et 62 % de décès, une exérèse totale s’associe à 30 % de récidives et 30 % de décès. Un résidu stable ou une absence de résidu sur l’IRM du dernier contrôle est observé chez 54,5 % des patients alors qu’une progression tumorale existe dans 45,5 % des cas.
20.3. Chordomes du rachis cervical On compte 23 patients (10 femmes, 13 hommes, sexe ratio M/F = 1,3), âgés de 43,8 ± 14,8 ans (extrêmes : 13 et 67 ans). Le symptôme initial le plus fréquent est une douleur locale souvent associée à une raideur cervicale (n = 18). Des signes de myélopathie sont présents 7 fois, des signes radiculaires 7 fois également, des paresthésies 3 fois, des troubles de la déglutition ou de la voix 3 fois ; enfin une masse cervicale est notée une fois. Lors de la présentation à Lariboisière (de première ou seconde intention), le malade présente 22 fois des douleurs locales, 10 fois des signes de myélopathie, 8 fois des signes radiculaires, 11 fois des manifestations sensitives variables, des troubles sphinctériens une fois, une dysphonie ou une dysphagie 2 fois et enfin une masse cervicale une fois. Le délai diagnostique est de 10,1 ± 18,5 mois avec des extrêmes de 0 à 84 mois (7 ans). Le CH avait 5 fois sur 23 une extension intradurale (22 %). Il n’intéresse qu’une vertèbre dans 3 cas, deux vertèbres dans 7 cas, trois vertèbres dans 8 cas, quatre vertèbres dans 3 cas, cinq vertèbres dans 1 cas et six vertèbres dans un autre cas. Environ la moitié des CH C sont situés sous C4 (n = 12) et l’autre moitié est localisée entre C4 et C2. L’exérèse lors de la première prise en charge a été partielle dans 10 % des cas, subtotale dans 54 % et totale dans 36 %. La plupart des exérèses réalisées à Lariboisière l’ont été en un temps (21/23). Seules deux exérèses ont été réalisées en 2 temps. Parmi les exérèses effectuées en un temps, trois ont utilisé 2 voies d’abord et une 3 voies d’abord. Parmi 10 artériographies, 4 tests de clampage de l’artère vertébrale ont été effectués sans occlusion, tous bien tolérés. Néanmoins, 5 artères vertébrales ont été sacrifiées en peropératoire.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 56
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Une racine nerveuse a du être sacrifiée 4 fois (1 racine C3, une racine C4 et 2 racines C5), auxquelles il faut ajouter un nerf récurrent. Dix fixations ont été réalisées, 6 antérieures, 4 postérieures dont une craniocervicale, 8 fois dans le même temps opératoire et 2 fois, 3 et 15 jours après l’exérèse. La mortalité opératoire est nulle. Chez 6 patients, on a observé des complications : 1 infection, 1 méningocèle, 1 méningite, 1 problème de vis, 1 Claude Bernard-Horner et 2 dysphonies. Une seule dérivation externe, internalisée ensuite a été posée. Deux trachéotomies ont été nécessaires, retirées 1 mois et 1,5 mois plus tard. Trois patients (les deux patients ayant eu une trachéotomie et un patient présentant une myasthénie) ont séjourné en réanimation. La durée d’hospitalisation a été en moyenne de 18,4 jours (6 à 104 jours). Une radiothérapie complémentaire a été réalisée dans 15 cas (79 %), 9 fois (60 %) par protonthérapie, 5 fois par radiothérapie conventionnelle et une fois par Cyberknife. Lors du contrôle à 3–6 mois, on retrouve essentiellement 5 cas de douleurs locales, 2 dysphonies, une myélopathie et une douleur de désafférentation. Le suivi à long terme est de 80 ± 61 mois avec 10 décès (45 %), 6 métastases (27 %) et 14 récidives (64 %). Les métastases sont ganglionnaires (4 fois), pulmonaire (1 fois) et sous-cutanée (1 fois). Le délai moyen d’apparition des récidives est de 53 ± 43 mois ; celui d’apparition d’une métastase de 31 ± 21 mois et d’un décès de 84 ± 53 mois. La durée moyenne de survie sans progression tumorale est de 49,5 ± 46 mois. Après exérèse partielle on observe une récidive dans 50 % des cas et un décès dans 100 %. Après exérèse subtotale, la récidive est présente dans 66,5 % des cas et le décès dans 58 %. L’exérèse totale s’accompagne d’un taux de récidive de 50 % et de décès de 12,5 %. Sur 18 patients analysables, 14 ont un résidu stable ou pas de résidu en IRM lors du dernier contrôle et 4 sont en progression tumorale. 20.4. Chordomes lombosacrés La série ne comporte que 8 CH lombosacrés (2 femmes, 6 hommes) d’âge moyen : 57,9 ans (extrêmes 40–77 ans). Le symptôme initial est 5 fois une douleur locale (parfois une coccygodynie), une fois une radiculalgie, une fois une masse palpable et une fois un déficit radiculaire. À l’arrivée à Lariboisière, on note 1 déficit moteur, 7 troubles sensitifs, 4 radiculalgies, 3 troubles sphinctériens. Il y a deux localisations lombaires (en L2 pour l’une et L3 pour l’autre), et 6 localisations sacrées ; 4 s’étendent du coccyx à S1 (1 cas), à S2 (2 cas), à S3 (1 cas) ; les deux autres vont de S3 à S5 et de S4 à S5 ; il n’y a aucune extension intradurale. Le CH envahit toujours l’arc antérieur du rachis et s’étend sur l’arc postérieur 6 fois. Il y a 6 extensions extra-rachidiennes dont 4 antérieures vers le pelvis (rectum). Le délai diagnostique est de 13,2 ± 16 mois (extrêmes 1 à 45 mois). Toutes les exérèses sont totales (sauf une partielle), 7 réalisées en un temps et une en 2 temps : 6 par abord postérieur, 1 par abord antérieur (L2) et 1 par double abord antérieur et postérieur (L3). Il y a eu deux exérèses monobloc (en L3 et S3-coccyx). Les 2 CH lombaires ont également eu une fixation. Aucune complication opératoire n’a été observée mais deux patients ont nécessité une reprise chirurgicale, une fois pour déplacement de la greffe osseuse et une fois pour un hématome. La durée d’hospitalisation est de 13 jours en moyenne (de 6 à 21 jours). Les 8 patients ont été irradiés, 3 par radiothérapie standard, 3 par protonthérapie, et 2 par Cyberknife. Le contrôle neurologique à distance montre la persistance d’un déficit moteur, de 2 troubles sphinctériens et de 3 radiculalgies.
Le suivi moyen est de 54,5 ± 44 mois avec des extrêmes de 8 à 115 mois. Il n’y a ni décès ni métastase dans le suivi de ces CH ; une seule récidive a été observée à 96 mois chez le seul patient n’ayant pas eu une exérèse complète. La survie sans progression est de 52 ± 40,5 mois (extrêmes : 8 et 109 mois). Sur 7 patients contrôlés à distance, 6 n’ont aucun résidu visible en IRM et 1 a un résidu stable. 20.5. Analyse comparative des groupes 20.5.1. Délai diagnostique moyen Le délai diagnostique moyen des différents groupes est très comparable, autour de 10 mois avec cependant des écarts considérables d’un patient à l’autre. Certains patients ont été diagnostiqués très rapidement, voire en urgence le jour même de l’installation du premier symptôme ; d’autres ne se sont présentés que de nombreuses années après, et ce quel que soit le groupe considéré, le maximum étant plus de 17 ans. Ceci suppose qu’au moins certains CH ont une évolution très lente, ne provoquant une aggravation clinique que très progressivement. 20.5.2. Délai de suivi moyen Le délai de suivi moyen (du diagnostic au dernier contrôle ou au décès) est également très peu différent d’un groupe à l’autre, de 74 à 80 mois, là encore avec des extrêmes très éloignés, mais confirmant l’homogénéité de la série et la grande variation d’évolutivité d’un CH à l’autre (Tableau 19). 20.5.3. Délais sans progression, de décès, de métastase et de récidive L’analyse des délais sans progression, de décès, de métastase et de récidive fait ressortir un meilleur pronostic des CH de la Base avec des délais plus longs pour tous les items. De même, le nombre de décès, de métastase ou de récidive est nettement moindre pour les CH de la Base du crâne que pour les CH de la CCC ou du RC. Inversement, ce sont les données des CH de la CCC qui sont les plus mauvaises. En fait sur la base de ces données, les CH de la CCC se comparent plutôt aux CH du RC qu’à ceux de la Base. Lorsque l’on regroupe toutes les localisations, le délai moyen sans progression est de 4 ans et demi, le délai de décès de 6 ans et demi, celui des métastases de 4 ans et celui des récidives de 4 ans et demi. Environ un malade sur deux récidive et/ou décède pendant les 6 ans et demi du suivi moyen et 15 % présentent une métastase. L’analyse de la qualité d’exérèse indique clairement qu’une exérèse complète s’associe à un bien meilleur pronostic qu’une exérèse incomplète, même subtotale (Tableau 20). Sur l’ensemble de la série, une exérèse totale s’associe à 20,5 % de décès et 28 % de récidive contre 52,5 et 47,5 % après exérèse subtotale et 63 et 75 % après exérèse partielle. Cette différence est encore plus nette si on ne considère que les CH de la Base. La répartition dans les différents groupes selon l’exérèse (partielle, subtotale et totale) est assez proche avec environ 25 % d’exérèse partielle ou totale et 50 % d’exérèse subtotale. Seuls les CH du RC ont une proportion plus faible d’exérèse partielle (10 %) et plus forte d’exérèse totale (36 %). On peut se poser la question de l’intérêt d’une radiothérapie secondaire et en particulier de la protonthérapie considérée comme le traitement de choix, avec, comme corollaire, la question de savoir si une exérèse subtotale peut être compensée par rapport à une exérèse totale en y adjoignant une protonthérapie. En fait, il semble bien que la radiothérapie par protons améliore la survie des patients puisqu’une exérèse totale suivie d’une protonthérapie est associée à une mortalité de seulement 7 % contre 100 % avec une radiothérapie standard et 66,5 % sans radiothérapie. De même, le pourcentage de récidive après exérèse totale et protons est de 26 % contre 100 % après radiothérapie standard et 66,5 % sans radiothérapie
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
57
Tableau 19 Principales données évolutives des différents groupes de chordomes. Principal evoluative results from the different groups of chordoma. Delai (mois)
Répartition selon la localisation RC n = 23
CCC n = 47
Base n = 58
CCC + RC n = 70
CCC + base n = 105
CCC + base + RC n = 128
Diagnostic Suivi
10,1 80
9,7 74
11,2 78
9,8 76
10,6 76,5
10,5 77
Sans progression Décès Métastase Récidive
49,5
46,5
64
48
56
54,5
84 31 53
62,5 58,5 37
94 79
68 47,5 43
78 58,5 56
78,5 48 55,5
Nombre décès Nombre métastase Nombre récidive
10 (45 %) 6 (27 %)
26 (59 %) 10 (23 %)
22 (39 %) 1 (2 %)
36 (54,5 %) 16 (24 %)
48 (47,5 %) 11 (10,8 %)
58 (47 %) 17 (14 %)
14 (64 %)
26 (59 %)
21 (37 %)
40 (60,5 %)
47 (46,5 %)
61 (49,5 %)
CCC : charnière craniocervicale ; RC : localisations cervicales. Délai diagnostique : date du premier symptôme–date du diagnostic ; délai de suivi : date du diagnostic–date du dernier contrôle ou du décès ; délai sans progression : date du diagnostic–date de récidive ou métastase ou dernier contrôle ; délai de décès : date du diagnostic–date du décès ; délai de métastase : date du diagnostic–date de métastase ; délai de récidive : date du diagnostic–date de récidive. CCC: cranio-cervical junction; RC: cervical spine; délai diagnostic: time between first symptom and diagnosis; délai de survie: time between diagnosis and last follow-up or death; délai sans progression: time between diagnosis and recurrence or metastasis or last control; délai de décès: time between diagnosis and death; délai de métastase: time between diagnosis and metastasis; délai de récidive: time between diagnosis and recurrence.
Tableau 20 Qualité d’exérèse. Excision quality. Type d’exérèse
Répartition selon la localisation RC (%)
CCC (%)
Base (%)
CCC + RC (%)
CCC + base (%)
CCC + base + RC (%)
DcD/partielle DcD/SubT DcD/totale
100 58 12,5
69 62 30
50 42 19
73 60,5 22
60 51 23
63 52,5 20,5
REC/partielle REC/SubT REC/totale
50 66,5 50
85,7 57 30
66,5 30,7 25
29 48 23
24 47 29
n partielle n SubT n totale
10 54 36
75 47,5 28 22,7 50 27
22,5 49 28
CCC : charnière craniocervicale ; RC : localisations cervicales ; pourcentage de patients décédés après exérèse partielle : DcD/partielle, après exérèse subtotale : DcD/SubT et après exérèse totale : DcD/Totale ; pourcentage de récidives après exérèse partielle : REC/partielle, après exérèse subtotale : REC/SubT, et après exérèse totale : REC/Totale ; n partielle : nombre d’exérèse partielle ; n SubT : nombre d’exérèse subtotale ; n totale : nombre d’exérèse totale. CCC: cranio-cervical junction; RC: cervical spine; DCD/partielle: percentage of death after partial resection; DCD/SubT: percentage of death after partial resection; DCD/totale: percentage of death after total resection; REC/partielle: percentage of death after partial resection; REC/SubT: percentage of death after subtotal resection; REC/totale: percentage of death after total resection; n partielle: number of partial resection; n SubT: number of subtotal resection; n totale: number of total resection.
Cependant, le faible nombre de patients rend l’utilisation de ces résultats très fragile : 27 pour la protonthérapie, 3 pour la radiothérapie standard et 3 pour l’absence de radiothérapie. Après exérèse subtotale, les résultats sont très voisins quelle que soit la modalité de radiothérapie utilisée. La mortalité est de 50 % avec protons, 37 % après radiothérapie standard et 54 % sans radiothérapie ; la récidive s’observe dans 50 % après protons, 37 % après radiothérapie standard et 54 % sans radiothérapie. Là encore le nombre de patients : 38 avec protons, 8 avec radiothérapie standard et 11 sans radiothérapie, rend les résultats discutables (Tableau 21). On peut inverser l’analyse en comparant l’ensemble des patients ayant eu des protons : le taux de décès est de 7 % en cas d’exérèse totale contre 50 % en cas d’exérèse subtotale et celui de récidive de 26 % contre 50 %. En reprenant tous les patients n’ayant pas eu de protons, le taux de décès est de 83 % (5/6 patients) après exérèse totale et 47 % (9/19 patients) après exérèse subtotale ; les taux de récidive sont exactement les mêmes : 83 % (5/6 patients) et 47 % (9/19 patients). La réserve sur le petit nombre de patients dans chacun des groupes n’ayant pas eu de protons s’applique ici encore Finalement, les protons semblent bien améliorer les résultats en termes de mortalité et de récidive chez les patients ayant eu une
exérèse complète. Par contre, lorsque l’exérèse est subtotale, les résultats sont identiques (autour de 50 % de mortalité et de récidives) quel que soit le type de radiothérapie proposée voire en l’absence de radiothérapie. Faut-il conclure qu’il existe un volume résiduel minimal très faible au-delà duquel les protons ne sont pas efficaces ?
Tableau 21 Résultats selon la qualité de l’exérèse (partielle, subtotale ou totale) et le type de radiothérapie réalisée (protonthérapie, radiothérapie standard et sans radiothérapie). Results on excision quality (partial, subtotal, or total) and the type of radiotherapy used. Exérèse+
Nombre
RAS
Récidive
Décès
Totale + proton SubTotale + proton Totale + standard SubTotale + standard Totale ss RxTT SubTotale ss RxTT
27 38 3 8 3 11
70 % 37 % 0/3 37 % 1/3 36 %
26 % 50 % 3/3 37 % 2/3 54 %
7% 50 % 3/3 37 % 2/3 54 %
Ss RxTT : sans radiothérapie ; RAS : rien à signaler. ssRxTT: no radiotherapy; RAS: free of progression.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
58
A
B
C
D
E
F
Fig. 56. Courbe A : courbe actuarielle de survie globale et sans progression pour l’ensemble de la série. Courbe B : courbe actuarielle de survie globale et sans progression des CH de la base et du groupe CH du rachis cervical et charnière craniocervicale. Courbe C : courbe actuarielle de survie globale et sans progression pour l’ensemble de la série, selon que les patients sont plus ou moins âgés que la médiane (44 ans). Courbe D : courbes actuarielles pour les CH de la base du crâne de survie globale (ligne supérieure) et sans progression (ligne inférieure) en fonction (de gauche à droite) de la résection complète ou non, de la prise en charge primaire ou secondaire, d’une protonthérapie ou non et de l’âge. Courbe E : courbes actuarielles pour les CH du rachis cervical et de la charnière craniocervicale regroupés, de survie globale (ligne supérieure) et de survie sans progression (ligne inférieure) en fonction (de gauche à droite) de la résection totale ou non, de la prise en charge primaire ou secondaire, d’une protonthérapie ou non et de l’âge. Courbe F : courbe actuarielle de survie globale et sans progression pour l’ensemble de la série selon que la prise en charge a été primaire ou secondaire. Courbe G : courbe actuarielle de survie globale et sans progression pour l’ensemble de la série selon qu’une protonthérapie a été réalisée ou non. Courbe H : courbe actuarielle de survie globale et sans progression pour l’ensemble de la série en fonction de l’exérèse (totale ou non totale). Courbe I : courbe actuarielle de survie globale et sans progression sur l’ensemble de la série selon qu’a été réalisée soit une résection incomplète seule, soit une résection incomplète associée à une protonthérapie, soit une résection totale avec protons.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
59
Fig. 56. (Suite )
Ces données basées sur des moyennes de fréquences et de délai d’apparition, et comportant souvent des écarts-types importants, demandent à être confirmées par des courbes actuarielles. 20.6. Analyse des courbes actuarielles 20.6.1. Taux de survie globale et sans progression Si l’on considère l’ensemble de la série, la courbe de survie globale (courbe A) comporte deux parties. La première durant les 4 premières années montre une chute rapide du nombre de survivants (40 %) ; la deuxième qui s’étend de 4 ans à plus de 20 ans est horizontale. Ceci confirme l’existence de CH présentant une évolutivité très différente ; certains sont très agressifs entraînant le décès quelle que soit la qualité de la prise en charge et les autres beaucoup moins. À l’appui de cette affirmation, on peut
mentionner l’exemple, dans notre série, d’un patient opéré et non radiothérapé, récidivant 11 ans plus tard et d’un autre opéré et radiothérapé récidivant après 21 ans. C’est également ce que l’on observe sur la courbe actuarielle de survie sans progression de la maladie (Fig. 56, courbe A) avec, là encore, une cassure, certes moins marquée, à 7 ans alors qu’il reste 30 % des patients qui n’ont pas récidivé. La deuxième partie de la courbe présente une pente beaucoup plus faible mais ne s’horizontalise pas complètement. Si on sépare les CH de la base du groupe des CH du Rachis cervical et de la charnière craniocervicale, la courbe de survie globale (Fig. 56, courbe B) n’est pas significativement différente (p : 0,45). En revanche, la survie sans progression (courbe B) l’est nettement (p = 0,0053). Ceci semble bien confirmer le meilleur pronostic des CH de la base du crâne.
A. Actuarial curve of global survival and without progression for all the series. B. Actuarial curve of global survival and without progression for the groups basal CH and cervical rachis CH, and craniocervical hinge. C. Actuarial curve of global survival and without progression for all the series, depending on whether the patient is older or younger that the median age (44). D. Actuarial curves of global survival for the group CH of the base of the skull (upper line) and without progression (lower line) as a function (from left to right) of the resection, complete or not, primary or secondary support with proton therapy or not, and age. E. Actuarial curves of global survival for groups with CH of the cervical rachis, and of the craniocervical hinge (upper line) and survival without progression (lower line) as a function (from left to right) of resection, total or not, primary or secondary support with proton therapy or not, and age. F. Actuarial curve of global survival and without progression for all of the series according to whether the treatment has been primary or secondary. G. Actuarial curve of global survival and without progression for all the series according to whether or not proton therapy was used or not. H. Actuarial curve of global survival and without progression for all the series as a function of excision (total or non-total). I. Actuarial curve of global survival and without progression for all the series according to whether an incomplete resection was performed, or an incomplete section associated with proton therapy, or a total resection with protons.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 60
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Différents paramètres ont ensuite été analysés en courbe actuarielle : l’âge supérieur ou inférieur à la médiane, le fait que la prise en charge ait été primaire ou secondaire, le type de résection (complète ou non) et le traitement par protonthérapie ou non ; cela a été fait dans trois cohortes : • l’ensemble de la série ; • les CH de la base du crâne ; • le groupe des CH du rachis cervical et de la charnière craniocervicale regroupés. 20.6.2. Âge Considérant l’âge, avec une médiane à 44 ans pour l’ensemble de la série (Fig. 56, courbe C), 47 ans pour les CH de la base (Fig. 56, courbe D) et 38 ans pour ceux du RC et de la CCC (Fig. 56, courbe E), on ne retrouve aucune différence significative que ce soit en termes de survie globale ou de survie sans progression. Tous les p sont supérieurs à 0,15. 20.6.3. Prise en charge primaire ou secondaire Pour l’ensemble de la série, la prise en charge primaire ou secondaire n’influence pas le taux de survie globale (Fig. 56, courbe F) (p = 0,9927) ; en revanche, la survie sans progression (courbe F) est très nettement modifiée (p = 0,0001). Pour les CH de la base et pour le groupe CH RC + CH CCC, l’influence de cette prise en charge est également significative, là encore uniquement pour la survie sans progression : respectivement p = 0,0440 et 0,0052. Inversement, la survie globale n’est pas significativement différente : respectivement p = 0,6892 et 0,9841 (Fig. 56, courbes D et E). Ceci confirme qu’un malade en récidive (prise en charge secondaire) voit son pronostic en termes de récidive amélioré par une prise en charge agressive : exérèse radicale et protonthérapie chaque fois que cela est possible. Le troisième paramètre étudié concerne l’association de la chirurgie à une protonthérapie. Pour l’ensemble de la série, le fait d’associer une protonthérapie à l’exérèse chirurgicale plutôt qu’à une autre forme de radiothérapie ou de n’en faire aucune, améliore significativement le taux de survie globale (p = 0,05), mais pas la survie sans progression (p = 0,29) (Fig. 56, courbe G). Dans le groupe de CH de la Base, elle améliore le taux de survie globale et sans progression : respectivement p = 0,0464 et 0,0346 alors qu’elle ne modifie ni l’un ni l’autre dans le groupe CH du RC et de la CCC : respectivement p = 0,1770 et 0,6569 (Fig. 56, courbes D et E). Il est difficile de tirer des enseignements de ces courbes actuarielles concernant ce paramètre « Protons » 20.6.4. Qualité d’exérèse Le quatrième paramètre est celui de la qualité de l’exérèse, totale ou non. Pour ce paramètre, la résection totale améliore la survie globale et sans progression pour l’ensemble de la série (Fig. 56, courbe H), respectivement p = 0,0020 et 0,0012, et pour le groupe RC et CCC, respectivement 0,0064 et 0,0021 (Fig. 56, courbe E) alors que ce n’est pas le cas dans les CH de la base, respectivement p = 0,115 et 0,199 (Fig. 56, courbe D). Néanmoins, les courbes pour les CH de la base sont très nettement disjointes avec à 5 ans une différence très marquée ; c’est la survenue de nombreux événements dans les 20 premiers mois qui expliquent la non-significativité. Ceci peut s’interpréter comme l’indication qu’exérèse totale ou non, les CH agressifs vont récidiver et décéder rapidement ; inversement l’exérèse totale permet une plus longue survie des autres CH. Il est par contre difficile de comprendre pourquoi la résection totale serait efficace sur les autres CH (du RC et de la CCC). Quoiqu’il en soit, le paramètre résection totale est comme cela est signalé dans
toutes les séries publiées, un facteur déterminant du pronostic des CH. Si l’on couple les deux derniers facteurs : protonthérapie et exérèse totale, on confirme clairement l’intérêt d’associer ces deux paramètres ; l’exérèse incomplète même associée à la protonthérapie n’obtient pas des résultats comparables (Fig. 56, courbe I). L’adjonction de protons à une exérèse incomplète n’apporte aucune amélioration significative du taux de survie globale (p = 0,19) et sans progression (p = 0,96) ; en revanche, la résection totale avec protons est supérieure à celle incomplète avec protons pour la survie globale (p = 0,012) et celle sans progression (p = 0,001). La survie globale est de 40 et 28 % en cas d’exérèse incomplète avec et sans proton et de 70 % en cas d’exérèse complète avec les mêmes valeurs à 5 et 10 ans La survie sans progression est de 30 % en cas d’exérèse incomplète (avec ou sans proton) à 5 ans et de 15 à 30 % à 10 ans alors qu’elle est de 80 % et de 60 % respectivement à 5 et 10 ans en cas d’exérèse complète.
21. Les chordomes de l’enfant (K. Beccaria, S. Puget, C. Sainte-Rose) 21.1. Revue de littérature 21.1.1. Épidémiologie Le chordome de l’enfant est une tumeur particulièrement rare puisqu’il représente moins de 1 % des tumeurs intracrâniennes dans cette tranche d’âge [303] et moins de 5 % des chordomes tous âges confondus [64,303,485,486]. L’âge moyen de survenue d’un chordome chez l’enfant se situe autour de 10 ans, le plus jeune cas décrit étant celui d’un nouveauné avec une tumeur du clivus [487]. Dans une revue de la littérature datant de 1987 sur les chordomes pédiatriques craniorachidiens (< 20 ans), l’âge moyen au diagnostic était de 8,2 ans (extrêmes : naissance–19 ans) [301]. Pour Coffin et al. [300], la majorité des cas de chordomes du sujet jeune surviendrait dans les 10 premières années de vie (83 % des cas de leur série). Benk et al. [321] rapportent un âge moyen de 12,6 ans, moins d’un tiers ayant moins de 10 ans (5/18 enfants). Dans sa revue des cas de chordomes pris en charge à la Mayo Clinic entre 1910 et 2006, Ridenour et al. [298] observent un pic d’incidence chez les sujets de moins de 25 ans situé entre 12 et 16 ans. Enfin, deux séries plus récentes de chordomes intracrâniens ont un pic d’incidence entre les deux premières décades : dans une revue de la littérature de 79 cas, Borba et al. [299] retrouve un pic d’incidence à environ 10 ans (121 mois), alors que l’âge moyen des 73 enfants traités dans la série de Hoch et al. [304] est de 9,7 ans. À partir de notre propre revue de la littérature, nous avons observé un âge moyen de 8,8 ans chez 111 enfants atteints de chordomes du clivus, de 8,6 ans chez 25 enfants atteints de chordomes vertébraux (cervicaux, thoraciques ou lombaires) et de 4,7 ans chez 20 enfants atteints de chordomes sacrococcygiens. Alors que chez l’adulte, les chordomes intracrâniens surviennent à un âge plus jeune que les chordomes sacrococcygiens [6,64,288], il semble que chez l’enfant, la tendance soit inversée et que les chordomes sacrococcygiens concernent plus fréquemment les enfants les plus jeunes. Le sex-ratio des chordomes pédiatriques est proche de 1. C’est le cas pour la revue de Sibley et al. [301] sur 74 cas toutes localisations confondues. Dans la série de Borba et al., toujours toutes localisations confondues, le sex-ratio est de 1,6 en faveur des filles. Par ailleurs, s’agissant des chordomes intracrâniens, on retrouve 58 % de patients de sexe féminin dans la série de 73 cas de Hoch et al. [304], alors que dans leur revue de la littérature, Borba et al. rapportent 54 % de garc¸ons.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
61
Tableau 22 Cas de chordomes pédiatriques extra-squelettiques. Cases of extra-skeletal paediatric chordoma. Auteur, année
Âge
Localisation
Traitement
Évolution
Durée de suivi
Jain et al. [492] Tao et al. [493] Berdal et Myhre [494] Yoneoka et al. [504] Dow et al. [80] Chang et al. [57] Figueiredo et al. [81] Horton et al. [496] Bianchi et al. [497] Jallo et al. [498] Zhou et al. [499] Sebag et al. [110] Clemons et al. [500] Stratt et Steiner. [501] Niida et al. [502] Kombogiorgas et al. [503]
NC 15 mois 10 ans 15 ans 9 ans 9 ans 18 ans 3,5 ans NC 13 ans 11 ans
Région glutéale Sinus paranasaux Ethmoïde, sinus maxillaire gauche Os temporal Cérébelleux droit Prépontique Pinéale + métastases abdominales Pré-sacré + métastases pulmonaires Pré-vertébral cervical Épidural C5-T1 Paravertébral C2-C5
NC Exérèse totale Exérèse partielle Exérèse partielle Exérèse totale Exérèse totale Aucun Chimiothérapie Exérèse totale + radiothérapie Exérèse partielle Exérèse partielle
NC RC MS NC RC RC Décès Décès RC MS MP
NC 3 ans 1 an 11,9 ans 1,2 ans 1 an – 2 mois 5 ans 3 ans 8 mois
14 ans 14 ans 5 ans 4 ans
Médiastin postéro-supérieure Pré-vertébral T3-T4 Rétroclival Rétroclival + foramens jugulaires et magnum
NC Exérèse totale Exérèse totale + radiothérapie Chimiothérapie (ifosfamide + doxorubicine)
NC NC RC NC
NC NC 1 an NC
NC : non communiqué ; RC : rémission complète ; MS : maladie stable ; MP : maladie progressive. NC: not communicated; RC: complete remission; MS: stable illness; MP: progressive illness.
21.1.2. Localisations anatomiques Contrairement à ce qu’avanc¸ait Sassin et Chutorian [488], pour qui les localisations sacrococcygiennes étaient les plus fréquentes chez l’enfant, les localisations intracrâniennes seraient majoritaires avec la répartition anatomique suivante chez les sujets de moins de 20 ans : 54 % en sphéno-occipital, 23 % sur la colonne mobile et 22 % en sacrococcygien [301]. Cette prédominance des localisations basi-crâniennes chez l’enfant est confirmée par d’autres auteurs : 100 % (12/12) dans la série de Wold et Laws [303], 50 % (6/12) pour Coffin et al. [300], et 100 % (2/2 enfants sur une série de 44 cas) pour Cummings et al. [489]. Les rares localisations au rachis mobile, 2 fois moins fréquentes que les localisations sacrées, sont essentiellement situées au niveau cervical (C2-C4), beaucoup plus rarement en lombaire ou en dorsal [490,491]. Au vu de l’ensemble des données disponibles chez l’enfant et chez l’adulte, il semblerait donc que les localisations intracrâniennes diminuent avec l’âge alors que les localisations sacrococcygiennes augmentent parallèlement. Outre ces localisations squelettiques classiques, des localisations extrasquelettiques de chordomes ont aussi été décrites chez l’enfant. Jain et al. [492] ont rapporté un cas de chordome de la région glutéale. Tao et al. [493] ont rapporté un cas de chordome des sinus paranasaux chez un enfant de 15 mois. Berdal et Myhre [494] ont rapporté également un cas de chordome de l’éthmoïde et du sinus maxillaire chez une enfant de 10 ans, sans envahissement sphénoïdal. Dans la série de chordomes de la base du crâne de Yoneoka et al. [495] est rapporté le cas d’un garc¸on de 15 ans présentant un chordome de l’os temporal opéré et radiothérapé et survivant à presque 12 ans du traitement. Il existe également 3 cas de chordomes intraduraux publiés chez l’enfant : 1 cas de chordome cérébelleux chez une fille de 9 ans [80], 1 cas de chordome prépontique chez 1 garc¸on de 9 ans [57] et 1 cas de chordome de la région pinéale chez un adolescent de 18 ans [81]. Les 2 premiers cas ont évolué favorablement à 14 et 12 mois de l’exérèse chirurgicale complète. Le troisième cas est particulier en ce sens qu’il s’agissait d’un enfant opéré et radiothérapé initialement pour un germinome de la région pinéale ; 16 ans plus tard, l’apparition d’une lésion abdominale sur le trajet d’une DVP avec récidive de la lésion primitive en région pinéale a fait réaliser une biopsie abdominale qui a conduit à corriger le diagnostic initial en faveur d’un chordome. Enfin, un certain nombre de cas ont été publiés présentant des chordomes développés en région paravertébrale ou para-clivale, sans envahissement osseux associé. Horton et al. [496] ont rapporté un cas de chordome pré-sacré métastatique et Bianchi et al. [497] un cas de chordome pré-vertébral cervical en région rétro-styloïdienne. Jallo et al. [498] ont publié un cas de chordome épidural C5-T1 avec érosion osseuse et élargissement
des foramen intervertébraux chez une enfant de 13 ans, et Zhou et al. [499] un cas de chordome C2-C5 érodant les foramens intervertébraux sans envahissement osseux évident chez une enfant de 11 ans. Sebag [110] a décrit un cas de chordome lombaire en sablier sans lyse ni envahissement osseux associé. Certains auteurs rapportent des cas de chordomes médiastinaux postérieurs : un chordome du médiastin postéro-supérieur chez une enfant de 14 ans [500] et un chordome pré-vertébral T3-T4 avec érosion vertébrale antérieure chez une enfant du même âge [501]. Deux cas de chordomes rétroclivaux sans envahissement clival objectivé à l’imagerie ou en peropératoire ont aussi été publiés. L’un chez un enfant de 5 ans est situé en arrière du clivus, sans envahissement de ce dernier ; [502]. L’autre un enfant de 4 ans avait un chordome rétroclival envahissant les foramens jugulaire et magnum et associé à des métastases vertébrale, falcorielle et pulmonaires [503] (Tableau 22). 21.1.3. Métastases Une grande variabilité d’incidence est retrouvée chez l’enfant en fonction des séries. Toutes localisations confondues, Ridenour et al. [298] et Coffin et al. [300] retrouvent respectivement 8,6 % (3/35, suivi moyen de 129 mois) et 58 % (7/12) de métastases cliniques ; dans sa revue de la littérature, Sibley et al. [301] retrouvent 23 % (17/74) de métastases chez les sujets de moins de 20 ans. Dans une série ne comprenant que des chordomes clivaux et cervicaux, Benk et al. [321] rapportent 3 cas de chordomes métastatiques sur 18, soit 17 %. Même si les chiffres semblent assez similaires à ceux retrouvés chez l’adulte, certains auteurs s’accordent à penser que les chordomes ont une plus grande tendance à métastaser chez l’enfant que chez l’adulte. Cela serait particulièrement vrai chez les enfants de moins de 5 ans par opposition au reste de la population pédiatrique [299,505,506]. Matsumoto et al. décrivent le cas d’un nourrisson de 4 mois, présentant un chordome du clivus et décédé 2 mois après le diagnostic, chez qui l’autopsie a retrouvé des emboles tumoraux dans les artères pulmonaires ainsi que deux localisations métastatiques surrénaliennes. Ils reprennent par ailleurs les 35 cas de chordomes d’enfants et adolescents de moins de 16 ans décrits dans la littérature, parmi lesquels 8 avaient moins de 5 ans. Quatre de ces 8 enfants avaient été autopsiés, et dans chaque cas (4/4), des métastases à distance avaient été retrouvées à l’autopsie : métastases pulmonaires (4/4), cardiaque (1/4) et surrénalienne (1/4). Kaneko et al. [506] rapportent le cas d’une enfant de 4 ans atteinte d’un chordome du clivus et décédée 9 mois après le diagnostic ; l’autopsie a permis de mettre en évidence de multiples métastases durales, osseuses (crâne, sternum, humérus, vertèbres),
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
62
Tableau 23 Incidence et délai de survenue des métastases (revue de la littérature). Incidence and delay for the occurrence of metastasis (literature review).
Intracrâniens (n = 119) Sacrococcygiens (n = 20) Rachis mobile (n = 35)
M+
M−
NP
M+ au diagnostic
M+ secondaires
25 (21 %) 11 (55 %) 10 (28,6 %)
60 (50,4 %) 7 (35 %) 11 (31,4 %)
34 (28,6 %) 2 (10 %) 14 (40 %)
6 (5 %) 5 (25 %) 1 (2,9 %)
5 (4,2 %) 3 (15 %) 3 (8,6 %)
Délai moyen (min–max) 3,2 mois (0–18 mois) 1,4 mois (0–6 mois) 4,3 mois (0–9 mois)
M+ : métastatique ; M− : non métastatique ; NP : non précisé. M+: metastatic; M−: non-metastatic; NP: not supplied.
pulmonaires bilatérales et hépatiques. En reprenant les cas de chordomes du clivus chez les enfants de moins de 5 ans publiés dans la littérature, les auteurs font remarquer que sur les 11 cas décrits, 7 enfants (soit 63 %) avaient présenté des métastases à distance, principalement pulmonaires. Enfin, Borba et al. [299], dans sa revue des chordomes intracrâniens de l’enfant, évaluent à 57,9 % le taux de métastases dans la population de moins de 5 ans, contre seulement 8,5 % chez les patients de 5 à 20 ans. On note par ailleurs que les chordomes sacrococcygiens et du rachis mobile sont plus à risque de métastaser que les chordomes intracrâniens. Dans la série de Ridenour et al. [298], 40 % des chordomes sacrococcygiens ont développé des métastases, contre 14 % des chordomes du rachis mobile et aucun chordome sphéno-occipital. Dans notre propre revue des chordomes de l’enfant, l’incidence des métastases est de 55 % pour les chordomes sacrococcygiens avec un délai moyen de survenue de 1,4 mois, 21 % pour les chordomes intracrâniens avec un délai moyen de survenue de 3,2 mois (Tableau 23). La dissémination métastatique se fait essentiellement par voie hématogène, particulièrement via les sinus duraux pour les chordomes du clivus [507], et les veines pré-sacrées pour les chordomes sacrococcygiens. Ces derniers auraient d’ailleurs une plus grande tendance à métastaser que les premiers, du fait très probablement de la richesse des plexus veineux environnants. La dissémination métastatique via le LCS a également été décrite, soit par les voies d’écoulement naturelles [265,506] ou par le biais d’une dérivation ventriculaire [81]. Sen considère que le risque de greffe métastatique sur la voie d’abord est non négligeable, même si nous n’avons pas retrouvé de cas pédiatrique clairement décrit dans la littérature. Un cas a cependant été observé dans la série de chordomes de Necker (non publié) : il s’agissait d’une enfant de 14 ans présentant un chordome s’étendant du clivus à C2. Une exérèse subtotale par voie transorale-transpalatine a initialement été réalisée nécessitant une prise de greffon graisseux abdominal pour la fermeture de la voie d’abord. Dix mois après la chirurgie, la patiente a développé une masse abdominale au niveau de la prise de greffe initiale. L’examen anatomopathologique de cette masse était en faveur d’un chordome. Les instruments utilisés lors de la première chirurgie ayant été les mêmes pour l’exérèse du chordome clival et pour la prise de greffon graisseux abdominal, cette lésion secondaire doit sans nul doute être considérée comme une greffe iatrogène de la tumeur clivale primitive. Le principal site de greffe métastatique est le poumon [299–301] ; lorsque des métastases sont retrouvées, rares sont les cas décrits où le poumon n’est pas concerné [81,265,300,508–511]. Selon Borba et al., le poumon serait concerné dans 78,5 % des cas de chordomes intracrâniens métastatiques. Les sinus duraux seraient une source non négligeable d’emboles tumoraux pulmonaires chez l’enfant [507,512]. Viennent ensuite les localisations osseuses [506,511], ganglionnaires (cervicales, inguinales, sus-claviculaires) [300,301,507,511], cutanées [506,513], hépatiques [321,506,513] et, de manière plus anecdotique cérébrales et médullaires, rénales [513], méningées [265,506], cardiaques [513,514], pleurales [301] et surrénaliennes [300,505]. Il n’est pas rare que les métastases soient déjà présentes au diagnostic de la maladie ; sinon, leur
développement survient en général dans les mois suivant le diagnostic, contrairement à ce que l’on voit généralement chez l’adulte. Ainsi, dans notre propre revue de la littérature, 25 % des patients atteints de chordomes sacrococcygiens sont décrits comme étant métastatiques lors du diagnostic de la maladie, contre 5 % pour les chordomes intracrâniens et 2,9 % pour les chordomes du rachis mobile ; lorsque les métastases sont diagnostiquées au cours de l’évolution de la maladie, elles surviennent en moyenne 1,4 mois après le diagnostic pour les chordomes sacrococcygiens, 3,2 mois pour les chordomes intracrâniens, et 4,3 mois pour les chordomes du rachis mobile (Tableau 2). On note des extrêmes pouvant aller jusqu’à 6, 9 et 18 mois pour les chordomes sacrococcygiens, du rachis mobile et intracrânien respectivement. Chambers et Schwinn [244] ont mis en évidence une relation entre l’incidence des métastases et les récurrences locales. Selon Benk et al. [321], cette relation est applicable à la population pédiatrique ; dans leur série, 3 patients ont développé des métastases, associées dans 2 cas à une récurrence locale. 21.1.4. Clinique Coffin et al. écrivaient en 1993 : Unusual clinical presentations are the rule rather than the exception in young patients. Cependant, chacune des localisations de chordomes donne lieu à une symptomatologie clinique assez caractéristique même si non spécifique, en rapport avec une invasion tumorale locale. L’atteinte des paires crâniennes est le principal mode de révélation des chordomes de la base du crâne, présente dans environ 60 % des cas [321,505]. La VIe paire crânienne est la plus fréquemment concernée [299], probablement du fait de la proximité du VI au clivus, son point d’entrée dans le sinus caverneux se situant juste au-dessous du processus clinoïde postérieur [515]. La fréquence des céphalées est d’au moins 40 % des cas [299,505], éventuellement intégrées dans un syndrome d’hypertension intracrânienne (HTIC) dans 28 % des cas [505]. Selon les mêmes auteurs, l’atteinte des voies longues avec syndrome pyramidal est de 36 % des cas. Une fois de plus il semblerait que deux sous-groupes d’âge puissent être distingués au sein de la population pédiatrique [505,516]. Les enfants de moins de 5 ans présentent en effet plus fréquemment un syndrome d’hypertension intracrânienne (72 %) ou une atteinte des voies longues (43 %) que les enfants plus âgés (12,5 % pour chaque type de symptôme), alors que le mode de présentation le plus fréquent chez les enfants de plus de 5 ans comprend la diplopie et les céphalées isolées (55 et 42 % respectivement). Certains chordomes s’étendent du clivus au rachis cervical au travers du Foramen Magnum et se présentent avec une symptomatologie très riche comprenant nerfs crâniens, atteintes des voies longues, HIC, obstruction nasopharyngée, et torticolis ([516] : 2 enfants de 3 ans ; [487] : 1 nouveau-né ; [505] : 1 enfant de 4 mois). Nolte décrit pour ces formes des extensions supérieures, inférieures, antérieures et postérieures. Ces formes se voient principalement chez les jeunes enfants ce que confirment Matsumoto et al. pour qui 75 % des chordomes avant 5 ans ont cette extension. Il n’est pas rare chez l’enfant que les chordomes sacrococcygiens se révèlent par l’apparition rapidement progressive d’une masse sous-cutanée, éventuellement ulcérée [517–519] ; en cas
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
de développement antérieur dans l’espace pré-sacré, la tumeur peut atteindre des tailles importantes avant d’être diagnostiquée, du fait de l’espace libre dans lequel elle peut se développer. Des douleurs sont très fréquemment associées, représentant parfois le symptôme principal. Il peut s’agir de douleurs périnéales ou de radiculalgies [519,520]. Les troubles digestifs et urinaires ne sont pas rares, à type de constipation ou d’incontinence anale, de troubles mictionnels ou d’incontinence urinaire. Ils ont une origine neurologique par compression et/ou envahissement des racines de la queue de cheval, mais aussi mécanique, par compression directe des voies digestives et urinaires par la masse pré-sacrée [517,521]. L’atteinte des racines de la queue de cheval peut aussi donner lieu à une anesthésie en selle et/ou à des troubles sensitifs des membres inférieurs. Au niveau du rachis mobile, la symptomatologie prédominante dépend de l’orientation du développement de la tumeur. Dans la majorité des cas, un développement postérieur de la lésion est responsable d’une compression médullaire ou des racines de la queue de cheval [106,300,485,491,522,523]. Le développement antérieur de la lésion peut être responsable de troubles respiratoires et/ou dysphagiques dans les cas de localisations cervicales ou thoraciques [524] ; Coffin et al. rapportent un cas de chordome thoracique développé en T12 révélé par une paraplégie et un hémothorax. D’une manière plus générale, les douleurs sont fréquentes, souvent insidieuses et d’intensité progressive. Leur étiologie est mixte : déplacement des tissus mous, destruction osseuse, compression radiculaire, augmentation de la mobilité de segments vertébraux devenus instables [524]. La raideur et/ou la déformation rachidienne(s) sont également rapportées par plusieurs auteurs [300,522,525,526]. On notera enfin que les traumatismes directs de la région sacrococcygienne ou vertébrale seraient d’après certains auteurs un facteur favorisant le développement des chordomes dans ces localisations ; plusieurs cas ont ainsi été décrits d’enfants développant un chordome sacrococcygien [510,520,527] ou vertébral [522] dans les semaines suivant une ou plusieurs chutes avec traumatisme postérieur. Dans la série de chordomes vertébraux et sacrococcygiens tous âges confondus de Rosenquist et al., 7 patients sur 16 avaient ainsi présenté un traumatisme dans les semaines précédant le diagnostic de la maladie [527]. Les auteurs rapprochent facilement cette observation des travaux originaux de Ribbert [18] (Section 1). 21.1.5. Anatomopathologie On retrouve chez l’enfant les mêmes formes histologiques de chordomes que chez l’adulte. Même si l’existence de certaines reste débattue [528], quatre formes principales sont classiquement décrites : classiques, chondroïdes, atypiques et dédifférenciés. Il est cependant difficile d’évaluer avec précision l’incidence de chacune des formes histologiques dans la population pédiatrique, d’une part, du fait de critères diagnostiques histologiques et de modes de description variables d’une étude à l’autre, d’autre part, du fait du peu de séries disponibles chez l’enfant. Même si certains auteurs insistent sur le fait que les chordomes de l’enfant sont caractérisés par un plus grand pléomorphisme que les chordomes de l’adulte [300,505], on peut noter cependant que dans les plus grandes séries pédiatriques, les formes « classiques » sont majoritaires : 89 % dans la série de Benk et al. [321], 58 % dans les séries de Wold et Laws [303] et de Hoch et al. [304], et 57 % dans la série de Ridenour et al. [298]. La revue de la littérature proposée par Borba et al. [299] en 1996 à propos des chordomes intracrâniens des sujets de moins de 20 ans confirme cette observation puisque les formes classiques représentent 64,6 % des 79 cas décrits ; d’après cette même revue, les formes atypiques concernent 22,4 % des cas, et les formes chondroïdes 13,5 % des cas. Les enfants de moins de 5 ans se distinguent du reste de la population pédiatrique : 35 % des sujets de moins de 5 ans présentent une forme
63
classique, et 65 % une forme atypique, alors que parmi les sujets de plus de 5 ans, 78,7 % présentent une forme classique, 4,2 % une forme atypique et 17,1 % une forme chondroïde. D’ailleurs, il est intéressant de noter que dans les séries de Wold et Laws [303] et de Benk et al. [321], au sein desquelles l’âge moyen des sujets est respectivement de 13,6 ans et 12,7 ans, ne sont décrites que des formes classiques (58 % et 89 % respectivement) et chondroïdes (42 et 11 % respectivement). À l’inverse, dans la série de Coffin et al. [300], dans laquelle l’âge moyen des patients est de 6 ans, seules des formes atypiques à contingent sarcomatoïde sont décrites (50 %, âge moyen 46 mois) en plus des formes classiques (50 %, âge moyen 89 mois). Par ailleurs, dans la série de Hoch et al. [304], on trouve des formes classiques (58 %), chondroïdes (23 %), cellulaires (11 %) et peu différenciées (8 %) au sein d’un groupe de patients dont l’âge moyen est de 9,7 ans. Il semble donc bien que l’incidence des différents types histologiques soit dépendante de l’âge du patient, avec une prédominance de formes atypiques chez les sujets les plus jeunes. 21.1.6. Traitement La prise en charge thérapeutique des chordomes repose sur une stratégie associant chirurgie et radiothérapie complémentaire ; la chimiothérapie n’a pas encore sa place en pratique courante. 21.1.6.1. Chirurgie. Comme chez l’adulte, tous les auteurs s’accordent depuis longtemps sur le fait qu’une exérèse chirurgicale la plus large possible doit être réalisée en première intention [243,303,319,321,529,530]. D’ailleurs, même si la différence n’est pas statistiquement significative, Ridenour et al. [298] observent dans leur série, une meilleure survie après exérèse totale versus exérèse partielle (p = 0,374). Étant donné le caractère agressif de ces tumeurs, l’objectif de la chirurgie doit être une exérèse aussi complète que possible, au besoin en plusieurs temps [531]. Pour ce faire, les voies d’abord sont souvent différentes d’un geste à l’autre, s’adaptant à la localisation et à l’extension tumorale. Pendant longtemps, les localisations habituelles des chordomes ont souvent obligé les chirurgiens à se contenter d’une exérèse partielle [532] du fait de la proximité de structures nerveuses (nerfs crâniens, tronc cérébral, moelle spinale, racines sacrées) ou vasculaires (carotides, tronc basilaire). Récemment, les techniques d’imagerie moderne, de neuronavigation, de microchirurgie et de l’endoscopie ont permis aux chirurgiens d’être de plus en plus agressifs et d’obtenir de meilleures exérèses que dans le passé, même si les exérèses incomplètes restent fréquentes dans les principales séries pédiatriques publiées (Tableau 24). Les voies d’abord utilisées ne diffèrent pas de celles de l’adulte avec parfois des combinaisons d’abords chirurgicaux en un ou plusieurs temps [106,526]. Une fixation rachidienne est parfois nécessaire en cas de destruction osseuse trop importante avec instabilité [106,518,524,526,527]. Pour les chordomes sacrés, la discussion porte surtout sur l’intérêt et la possibilité de réaliser une exérèse en bloc [519]. 21.1.6.2. Radiothérapie. Bien que les chordomes soient considérés comme des tumeurs relativement radiorésistantes, l’utilisation de la radiothérapie à fortes doses semble permettre un certain degré de contrôle tumoral et très tôt, la plupart des auteurs ont conseillé l’association d’une irradiation complémentaire à la chirurgie d’exérèse [64,485,533,534]. Seule la série de Wold et Laws [303] donne une idée des résultats à long terme de cette attitude thérapeutique sur une population exclusivement pédiatrique de 12 patients, d’âge moyen de 13,6 ans, présentant des chordomes intracrâniens (clivaux ou de la région sellaire). Tous les patients ont été traités par chirurgie première, radicale ou partielle ; une radiothérapie conventionnelle a été associée chez 10 d’entre eux. Le délai moyen de suivi était de 67 mois (1 à 252 mois). Au cours
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 64
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Tableau 24 Type d’exérèse (biopsie/incomplète/complète/NP : non précisé) en fonction de la localisation du chordome dans les principales séries pédiatriques de la littérature. Type of excision (biopsy/incomplete/complete/NP: not supplied) as a function of the localisation of the chordoma in the principal paediatric series reported in the literature.
Wold et Laws [303], (n = 11) Coffin et al. [300], (n = 11)
Benk et al. [321], (n = 18) Ridenour et al. [298], (n = 20)
Localisation
Biopsie
Incomplète
Complète
NP
Intracrâniens Intracrâniens Cervicaux Thoraciques Lombaires Sacrococcygiens Intracrâniens Cervicaux Intracrâniens Rachis mobile Sacrococcygiens
2 1 0 0 0 1 0 0 1 0 1
3 2 1 1 1 0 15 3 12 1 1
4 3 0 0 0 0 0 0 1 3 0
2 0 1 0 0 0 0 0 0 0 0
du suivi, deux patients sont décédés d’une progression de la maladie après 26 et 44 mois et deux autres patients de causes non liées au chordome. Tous les patients vivants lors du dernier contrôle avaient bénéficié d’une ou plusieurs chirurgies suivie(s) de radiothérapie. La chirurgie avait été radicale pour 4 d’entre eux, partielle pour 2 ; la qualité de l’exérèse n’était pas précisée pour les deux derniers. Parmi les survivants, 2 patients opérés de chordomes latéro-sellaires ont eu à distance un pan-hypopituitarisme pour l’un, une obésité et une épilepsie séquellaire pour l’autre ; les autres patients étaient décrits comme allant « bien » ou étant « améliorés ». À plus grande échelle, l’intérêt de l’association chirurgie et radiothérapie dans la population pédiatrique semble confirmé par Borba et al. [299] qui dans leur revue de la littérature des chordomes intracrâniens, affirment que l’association d’une exérèse chirurgicale, qu’elle soit partielle ou totale, suivie d’une radiothérapie (type non précisé) offre un meilleur pronostic que l’exérèse chirurgicale seule (p = 0,00446). La radiothérapie chez l’enfant en pleine croissance a cependant ses limites, du fait des complications qu’elle peut entraîner [535]. Dans ce contexte, la protonthérapie s’est imposée peu à peu comme la technique d’irradiation de référence [322,324]. Elle permet en effet l’application de hautes doses de radiations ionisantes, mais de fac¸on plus ciblée avec une réduction d’un facteur 2 à 3 de la dose délivrée aux structures voisines saines (encéphale, hypophyse, cochlée. . .) [536]. Dans les séries pédiatriques les plus récentes, la protonthérapie est d’ailleurs la technique préférentiellement utilisée, avec de bons résultats à long terme. Dans la série publiée par Hoch et al. [304], issue entre autres du Massachusetts General Hospital, 73 enfants ont été traités pour des chordomes de la base du crâne par chirurgie première, puis irradiation complémentaire systématique par protons. L’âge moyen au diagnostic était de 9,7 ans (1–18 ans). Le taux de survie globale était de 81 % avec un suivi moyen de 7,25 ans (1–21 ans). Les auteurs considèrent que le pronostic est donc meilleur que dans les séries adultes où il varie de 23 à 66 % [537,538], et est de 55 % à 5 ans dans une série de patients adultes également traités au Massachusetts General Hospital [539]. Ils expliquent cette différence notamment par une meilleure efficacité de la protonthérapie chez les sujets jeunes. Dans la série de Benk et al. [321], 18 cas de chordomes de la base du crâne et cervicaux ont été traités par une ou deux procédures chirurgicales suivies systématiquement d’une irradiation fractionnée mixte par photons et protons. Dans 8 cas, deux gestes chirurgicaux ont été réalisés avant irradiation afin de réduire au maximum le volume tumoral ; pour les 18 cas, l’exérèse chirurgicale était considérée comme incomplète au moment de l’irradiation. Les taux de survie globale et sans progression à 5 ans étaient respectivement de 68 et 63 %. Les auteurs considèrent la morbidité de la technique acceptable ; 2 patients ont présenté un déficit en hormone de croissance nécessitant une substitution, 1 patient a développé une nécrose du lobe temporal asymptomatique et 3 patients une hypoacousie unilatérale.
21.1.6.3. Chimiothérapie. Comme chez l’adulte, l’utilisation de la chimiothérapie dans la prise en charge des chordomes pédiatriques est encore anecdotique, et on dénombre seulement une vingtaine d’enfants traités par chimiothérapie dans la littérature [240,300,303,321,369,507,513,540,541]. Certains auteurs considèrent que la chimiothérapie des sarcomes peut être utilisée pour les chordomes, notamment en cas de forme histologique indifférenciée [285,513]. La molécule la plus souvent utilisée est l’ifosfamide, en association fréquente avec l’étoposide [507,541] ou la doxorubicine [369,541]. L’indication de traitement par chimiothérapie diffère selon les auteurs, mais est le plus souvent une option de dernière intention lorsque les traitements classiques (chirurgie et radiothérapie) ne sont plus possibles ou inefficaces [240,300,303,321]. À l’inverse, des enfants très jeunes ont été traités par chimiothérapie première en cas de lésions considérées comme inopérables et métastatiques d’emblée, dont le diagnostic avait été fait par biopsie [300,369,507,513,528]. Enfin autre attitude, dans la série de 6 cas de chordomes du clivus publiée par Dhall et al. [541], la chimiothérapie faisait partie intégrante du traitement de première intention. En cas de résection partielle, la chimiothérapie était indiquée comme traitement adjuvant de première intention, associée à une radiothérapie en cas de chordome indifférencié. En cas d’exérèse subtotale, seule la radiothérapie était indiquée en traitement adjuvant de première intention ; une chimiothérapie était proposée en cas de récidive évolutive. Le protocole de chimiothérapie de première ligne associait ifosfamide et étoposide. Un patient de 2 ans a eu une exérèse subtotale première d’un chordome, suivie de radiothérapie conventionnelle ; une chimiothérapie par ifosfamide et étoposide a été réalisée après récidive tumorale locale et l’enfant est vivant avec un résidu stable après 13 ans de recul. Deux enfants de 11 mois et 7 ans ont eu une exérèse partielle première de chordomes avec chimiothérapie concomitante par ifosfamide et étoposide ; tous les deux sont vivants avec un résidu tumoral stable après 9 ans de recul. Pour deux enfants de 5 et 8 ans, une exérèse partielle première de chordomes indifférenciés a été réalisée, suivie d’un traitement concomitant mixte par chimiothérapie et radiothérapie. L’un est vivant avec un résidu tumoral stable à 6 ans. Pour l’autre, du fait d’une récidive évolutive, l’enfant a été réopéré avec une chimiothérapie adjuvante par ifosfamide et doxorubicine, puis glivec et celebrex ; il a développé secondairement une leucémie aigüe myéloïde et est décédé d’un saignement intracrânien avec une maladie évolutive à un peu plus de 3 ans du diagnostic. Un adolescent de 15 ans a refusé tout traitement complémentaire après chirurgie d’exérèse partielle ; il est décédé 1,5 ans après le diagnostic. Les résultats sont encourageants puisque sur les 5 enfants ayant rec¸u un traitement complémentaire, 4 sont encore en vie avec un résidu stable lors du dernier contrôle, entre 6 et 13 ans après le diagnostic ; on note que les deux enfants traités par chirurgie et chimiothérapie
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
sans radiothérapie sont tous les deux en vie avec un résidu stable après 9 ans de recul. Dhall et al. [541] concluent que la chimiothérapie, notamment l’association ifosfamide-étoposide, peut être discutée comme traitement adjuvant en cas de résidu tumoral après chirurgie. Au vu des différents cas décrits ci-dessus, le choix de l’ifosfamide en première ligne, en association avec la doxorubicine ou l’étoposide semble intéressant et prometteur, puisque, à l’exception d’un cas, tous les sujets traités par ces associations en première ligne ont montré une réponse tumorale et sont pour la plupart encore vivants au dernier contrôle. Le patient décrit par Scimeca et al. [369] a nettement répondu cliniquement et radiologiquement à l’association ifosfamide et doxorubicine ; il est décédé secondairement après modification de la chimiothérapie du fait de la toxicité cardiaque cumulative de la doxorubicine. Enfin, le patient rapporté par Auger et al. [507] est décédé malgré l’association ifosfamide et étoposide ; outre le fait qu’il s’agissait d’une tumeur très invasive localement, il faut surtout noter que l’enfant est décédé d’une défaillance respiratoire et que de multiples emboles tumoraux pulmonaires associés à des plages d’infarctus ont été retrouvés à l’autopsie. Dans le traitement de chordomes sacrococcygiens, les résultats de la chimiothérapie ne sont pas plus probants [302,519,542]. 21.1.7. Facteurs pronostiques Il est admis que le pronostic des chordomes est globalement meilleur chez l’enfant que chez l’adulte ; c’est ce qu’avancent Wold et Laws [303] et Hoch et al. [304] qui rapportent des taux de survie de 50 et 81 % respectivement, sur des périodes de suivi allant de 1 mois à 21 ans. Cependant, cette affirmation doit être nuancée car le pronostic chez l’enfant dépend de l’âge avec une évolution plus péjorative chez les très jeunes enfants, notamment avant l’âge de 5 ans [299,300,322,505,506,543]. L’incidence des métastases au diagnostic est également très élevée dans cette tranche d’âge. En dehors de quelques cas, la plupart de ces enfants décèdent effectivement dans les 18 mois qui suivent le diagnostic malgré les traitements par chirurgie, radiothérapie et/ou chimiothérapie [300,301,369,488,505–507,511,514,516,540,544]. L’évolution plus rapide et agressive des chordomes chez les enfants en bas âge, peut entre autres s’expliquer par la plus grande fréquence des formes histologiques atypiques chez les moins de 5 ans [300,304]. Dans la série de Ridenour et al. [298], le taux de mortalité des formes atypiques et dédifférenciées est de 67 %, contre 27 % en moyenne pour les formes conventionnelles et chondroïdes. Dans la série de Hoch et al. [304], les taux de mortalité des formes conventionnelles, chondroïdes et faiblement différenciées étaient respectivement de 14, 18 et 83 % pour un suivi moyen de 7,25 ans. Dans la série de Coffin et al. [300], les 6 patients présentant des formes atypiques de chordomes sont décédés au cours du suivi, entre 3 semaines et 6 mois après le diagnostic ; 4/6 ont présenté des métastases au cours de l’évolution de leur maladie. Enfin, une revue de la littérature des chordomes intracrâniens des sujets de moins de 20 ans corrobore ces résultats puisque la mortalité était respectivement de 23,1, 37,5 et 100 % pour les formes conventionnelles, chondroïdes et atypiques. Parmi les enfants avec des formes classiques, 2 étaient encore en vie lors du dernier contrôle, l’un à 3 ans du diagnostic sans signe de maladie évolutive, l’autre à 1 an, en récidive ; quatre patients étaient décédés, à des délais de 4,5 ans, 4 ans, 2 mois et non précisé dans 1 cas. Par ailleurs, les formes chondroïdes pédiatriques ne sont pas de meilleur pronostic que les formes conventionnelles [243,303,545]. Ainsi, le type histologique n’est pas un facteur pronostique dans la série de 18 patients de Benk et al. [321] qui ne comprenait que des formes conventionnelles et chondroïdes. Cependant, dans la série de Ridenour et al. [298], le taux de mortalité des formes conventionnelles est significativement moins élevé que pour les autres formes (20 % pour les conventionnels, 33 % pour les chondroïdes) et la durée de survie
65
est significativement plus élevée pour les formes conventionnelles (119 mois contre 26 pour les formes chondroïdes). La localisation primitive du chordome semble chez l’enfant être un élément pronostique. En effet, il semble que les localisations intracrâniennes soient de meilleur pronostic que les localisations du rachis mobile, elles-mêmes de meilleur pronostic que les localisations sacrococcygiennes. Benk et al. [321] ont publié une série de 18 chordomes intracrâniens et cervicaux. Dans la limite du nombre de patients décrits, les localisations cervicales (n = 3) étaient de moins bon pronostic que les localisations intracrâniennes (n = 15). En effet, 2/3 patients avec chordomes cervicaux étaient décédés à l’issue du suivi, l’une à 6 mois du diagnostic avec une récidive locale et des métastases pulmonaires, l’autre à 7 mois du diagnostic avec des métastases pulmonaires, hépatiques et osseuses. Le troisième patient était vivant à 100 mois de recul. À l’inverse, seuls 2/15 patients avec localisations intracrâniennes sont décédés au cours du suivi, toutes les deux à 39 mois du diagnostic du fait d’une progression tumorale locale. Dans la série de Ridenour et al. [298], les 3 cas de métastases observées l’ont été chez des patients atteints de chordomes du rachis mobile (n = 1, 1/7 soit 14 % dans cette localisation), ou de chordomes sacro coccygiens (n = 2, 2/5 soit 40 % dans cette localisation) ; aucune métastase n’a été observée chez les patients atteints de chordomes sphéno-occipitaux. D’un point de vue histologique, les localisations rachidiennes étaient aussi plus agressives que les localisations intracrâniennes : 100 % des chordomes sacrococcygiens étaient atypiques (5/5), 29 % des chordomes du rachis mobile étaient dits dédifférenciés (n = 2/7 contre 5/7 conventionnels) et parmi les chordomes sphéno-occipitaux, 22 % étaient dédifférenciés ou atypiques (n = 1/23 dédifférencié et n = 4/23 atypiques, contre 3/23 chondroïdes et 15/23 conventionnels). Cela se traduisait par une mortalité variable selon les localisations : 35 % (8/23) en sphéno-occipital après un délai moyen de 68 mois, 14 % (1/7) pour le rachis mobile après un délai moyen de 40 mois (avec 2/7 perdus de vue), et 80 % (4/5) en sacro coccygien après un délai moyen de 76 mois (et 1/5 perdu de vue). Enfin, on peut citer la série de Coffin au sein de laquelle 6 enfants étaient atteints de chordomes extracrâniens : 1 cas de chordome lombaire décédé à 6 mois du diagnostic avec des métastases péritonéales, 1 cas de chordome pré-sacré décédé à 2 mois avec des métastases pulmonaires, 2 cas de chordomes thoraciques décédé à 4 ans sans métastases pour l’un, et avec des métastases multiples pour l’autre, et 2 cas de chordomes cervicaux décédés avec des métastases. À l’inverse, parmi les localisations intracrâniennes, 2 enfants étaient encore en vie à 3 ans et 1 an, les autres étant décédés à 3 semaines et 3 mois avec des métastases pour les uns, et à 6 mois et 4,5 ans du diagnostic sans métastases pour les autres. 21.2. Série Necker–Lariboisière Une analyse rétrospective de la série de chordomes pédiatriques opérés à Necker et Lariboisière durant la période 1976–2010 a été Tableau 25 Signes cliniques au diagnostic. Clinical signs at diagnosis. Signes cliniques
Nombre (%)
Céphalées Douleur rachis Raideur rachidienne Torticolis Atteinte nerf oculomoteur Atteinte nerfs mixtes Déficit moteur Syndrome cérébelleux Radiculalgie Malaise
10 (32,3) 14 (45,2) 5 (16) 7 (22,6) 9 (29) 6 (19,3) 7 (22,6) 3 (9,7) 5 (16,1) 2 (6,5)
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
Localisation
Signes au diagnostic
Histo
Exerèses (nombre)
RT (dose, CGE)
Séquelles
Statut final
Suivi
1
13,5
F
C2-C4
Chordome
1
Protons (74)
Paresthésies MSG
RC
10 ans 3 mois
2
4
M
Clivus-C2
Cervicalgies, parésie MSG, radiculalgies C5C6C7 G, torticolis Troubles de l’équilibre et de la marche
Chordome
3
Photons (34,2) + protons (34,2)
RC
10 ans 10 mois
3
5
M
Clivus-C2
Boiterie, torticolis douloureux, parésie MI et MS
C. chondroïde
3
Photons (34,2) + protons (34,2)
Raideur cervicale, hypoesthésie V2, hypoacousie G, déficit somatotrope Hémiparésie G, scoliose dorso-lombaire, déficits somatotrope et thyréotrope Raideur cervicale, XII Dt, asymétrie voile du palais Aucune NA
RC
9 ans 2 mois
MS
3 ans 7 mois
RC DcD
8 ans 4 mois 0 ans 10 mois
4
8,5
M
Clivus-C2
Raideur cervicale, AEG, voix nasillarde
Chordome
3
Photons (34,2) + protons (34,2)
5 6
10,5 11,5
F M
C2-C5 C1-C3
Chordome Chordome
2 3
Protons (74) Photons (NC)
7
11,5
F
Clivus-C2
Hémiparésie G Céphalées, torticolis, radiculalgie Céphalées, malaises
Chordome
3
Photons (34) + protons (36)
8
11
M
C2-C4
Cervicalgies
Chordome
2
9
12
M
Clivus-C2
Chordome
2
10
13
F
Clivus
Cervicalgies, XII G, voussure du palais Céphalées
Chordome
3
11
14,5
M
Clivus-C2
C. chondroïde
2
12
14,5
F
Clivus-C2
Chordome
1
13
14
M
Clivus-C2
Cervicalgies, raideur cervicale, céphalées Troubles de déglutition, dysphonie, diplopie (VI, IX, X, XII G), parésie MSG HTIC
Photons (39,6) + protons (27) Photons (39,7) + protons (28,8) Photons (34,2) + protons (36) Photons (34,2) + protons (36) Photons (55 clivus + 50 C1C2)
Chordome
2
14
16
M
Charnière
C. chondroïde
4
15 16
8 10,5
M F
Clivus-C5 Clivus
Torticolis douloureux, XII Dt Rhinolalie et apnées Céphalées, VI G
Chordome Chordome typique
4 1
Photons (46) + protons (26) Photons (45) + protons (26) Photons Protons (68)
17
5,5
M
C7-T2
Chordome
2
18
3,5
M
Clivus-C2
Chordome atypique
F
Clivus
M M
Clivus Clivus
19
20 21
14
4,5 7,5
Cornage, ADP cervicales Torticolis douloureux, VI G Céphalées, III Dt
VI bilatéral Torticolis douloureux, céphalées, syndromes cérébelleux, déficit moteur, troubles sphinctériens
XII G, retard de croissance, hypoacousie, parésie CV G XII et XI G, CBH G
MS
6 ans 11 mois
DcD
1 an 8 mois
NA
DcD
2 ans 7 mois
V1 G
RC
9 ans 6 mois
NA
DcD
4 ans 3 mois
NA
DcD
2 ans
VI, VIII G, déficit somatotrope NA
MS
7 ans 2 mois
DcD
3 ans 1 mois
MS RC
2 ans 5 mois 5 ans 4 mois
NA
VI Dt, raideur cervicale Pan-hypopituitarisme substitué Aucune
RC
0 ans 11 mois
1
NA
NA
DcD
0 ans 4 mois
Chordome
2
11 ans 10 mois
1 3
BAV G, pan-hypopituitarisme, hypoacousie Dte, NA NA
MS
Chordome atypique Chordome
Radiochir (18) + photons (37,8) + protons (33,2) NA Photons (50)
DcD DcD
0 ans 0 mois 19 ans 11 mois
ARTICLE IN PRESS
Sexe
G Model
Âge (ans)
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
CVas
NEUCHI-612; No. of Pages 78
66
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
Tableau 26 Récapitulatif de la série de Necker–Lariboisière. Summary of the Necker–Lariboisière series.
G Model
NEUCHI-612; No. of Pages 78
Âge (ans)
Sexe
Localisation
Signes au diagnostic
Histo
Exerèses (nombre)
RT (dose, CGE)
Séquelles
Statut final
Suivi
22
7
M
Clivus-C3
Chordome
4
Photons (55,8)
IX, X G
RC
3 ans 3 mois
23
13
M
Clivus
Cervicalgies et raideur cervicale Diplopie
Chordome
1
Aucune
RC
17 ans 6 mois
24
12,5
M
Clivus-C2
Chordome
3
XII Dt
MS
5 ans 8 mois
25
5,5
F
Clivus-C2
HTIC avec atrophie optique, syndromes pyramidal et cérébelleux, déficit moteur Douleurs, VI
Photons (40) + protons (20) Photons (55)
Chordome
3
NC
MS
11 ans
26 27
8 16,5
F M
Clivus Charnière
Céphalées, VI VI, XII G
Chordome Chordome
2 4
Paralysie oculomotrice NA
MS DcD
5 ans 4 mois 3 ans 9 mois
28
18
M
Clivus
V2, VI Dt
C. chondroïde
2
NC
R
1 an 4 mois
29
17,5
M
Clivus
Diplopie (VI Dt)
Chordome
1
Aucune
R
13 ans 8 mois
30
15
F
Charnière
XII Dt, hémiparésie G
Chordome
2
Photons (34) + protons (34) Radiochirurgie (40) Photons (NC) + protons (NC) Photons (36) + protons (36) Protons (45) + photons (22) Photons (60)
MS
8 ans
31
17
F
Charnière
VI, IX, X, XI, XII G, cervicalgies, masse rétro-auriculaire G, hypoesthésie C2
Chordome
3
NC
Nerfs mixtes, déficit moteur Paralysie oculomotrice, nerfs mixtes, déficit moteur, troubles sphinctériens
MS
3 ans 1 mois
ADP : adénopathies ; CGE : Cobalt Gray Equivalent ; DcD : décédé de la maladie ; Dt : droit ; G : gauche ; MS : maladie stable ; NA : non applicable ; NC : non connu ; R : rémission ; RC : rémission complète. ADP: lymphadenopathy; CGE: Cobalt Gray Equivalent; DcD: death; Dt: right; G: left; MS: stable illness; NA: not applicable; NC: unknown; R: remission; RC: complete remission.
ARTICLE IN PRESS
CVas
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
Tableau 26 (Suite )
67
G Model NEUCHI-612; No. of Pages 78 68
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 57. Survie sans progression (A) et survie globale (B) de la série de chordomes pédiatriques. Survival without progression (A) and global survival (B) for the series of paediatric chordoma.
réalisée. Les données cliniques, radiologiques, histologiques, les traitements et résultats ont été revus à partir des dossiers des enfants. Trente et un enfants âges de 3,7 à 18 ans (médiane 12 ans), avec une prédominance de garc¸ons (20 M/11F), ont été pris en charge pour cette pathologie. Les signes cliniques présents au diagnostic sont résumés dans le Tableau 25. Les chordomes étaient localisés au niveau du clivus (n = 9), étendus du clivus au rachis cervical (n = 13), localisés à la charnière (n = 4) et situés au niveau du rachis cervical (n = 5). Aucun patient n’avait de métastase au diagnostic. La prise en charge des patients et les résultats sont résumés dans le Tableau 26.
21.2.1. Chirurgie Huit patients ont d’abord eu une biopsie de leur lésion puis une exérèse aussi complète que possible en 1 (3 patients), 2 (3 patients) ou 3 temps (2 patients). Pour les 23 autres patients, l’exérèse chirurgicale a été maximale après une chirurgie (8 patients) ou après plusieurs temps (2 pour 7 patients ; 3 pour 7 patients et 4 pour 1 patient). On note 5 exérèses complètes et 26 incomplètes avant radiothérapie. Le chordome était intradural (48,1 % des cas), extradural (44,4 % des cas) ou à la fois intra- et extradural (7,4 % des cas). Les extensions de ces tumeurs aussi bien vers l’avant qu’en direction des angles pontocerébelleux ont dans la majorité des cas conduit à combiner les approches qui ont été multiples : transorale, trans-sphénoïdale, trans-faciale, antéro-latérale, voie de l’artère vertébrale, rétrosigmoide et abords du rachis antérieur et postérieur. On note une augmentation de l’utilisation de l’endoscope ces dix dernières années. En postopératoire, 8 enfants ont eu une trachéostomie et 4 une gastrostomie. Celles-ci ont toutes été transitoires avec des médianes de temps de 75 jours pour la trachéostomie (de 7 jours à 28 mois) et de 7 mois pour la gastrostomie (de 4 à 10 mois). Un traitement orthopédique par orthèse a concerné 8 enfants et 12 ont eu une ostéosynthèse. Parmi eux, 4 enfants ont eu les deux systèmes de contention.
21.2.2. Résultats histologiques Sur le plan histologique, 25 enfants avaient un chordome classique, 4 un chordome chondroïde et 2 atypiques/peu différenciés.
21.2.3. Traitements complémentaires La radiothérapie a été faite après une exérèse maximale (en un ou plusieurs temps) dont le but était de mettre à distance la tumeur résiduelle et le tronc cérébral et les structures vasculaires de proximité, afin de minimiser les séquelles de la radiothérapie. Tous les enfants ont été irradiés sauf 2 qui sont décédés avant l’irradiation. Deux enfants ont été traités par radiochirurgie, 10 par protonthérapie, 7 par irradiation aux photons et 10 par une combinaison photons/protons. Un seul patient a eu de la chimiothérapie associée à la radiothérapie en traitement adjuvant car le diagnostic initial avait été celui de neurinome malin. 21.2.4. Devenir Avec un suivi médian de 5,7 ans, la survie globale et la survie sans progression à 15 ans sont respectivement de 63 et 54,3 % (Fig. 57A et B). Durant le suivi, 11 enfants ont eu des progressions de résidu après la radiothérapie. Six ont été réopérés et 2 enfants sont toujours vivants. Trois enfants n’ont eu aucun traitement et sont décédés après une évolution rapide de la maladie et deux ont eu de la chimiothérapie, sans efficacité. Pour l’un d’eux, la chimiothérapie a été donnée pour une évolution pluri-métastatique. On note pour un enfant l’apparition d’une greffe de chordome au niveau abdominal après prélèvement de graisse faite avec les mêmes instruments que ceux utilisés pour l’exérèse. Il a été réopéré au niveau abdominal. On comptabilise 11 décès dans cette série : 2 enfants sont décédés avant même d’avoir rec¸u de la radiothérapie, tous les deux avaient des chordomes atypiques peu différenciés (un enfant est décédé en périopératoire et le second 4 mois après le diagnostic, en cours de chimiothérapie) ; les 9 autres enfants décédés ont comme point commun d’avoir eu une récidive après l’irradiation. Le fait de récidiver après radiothérapie est un facteur de mauvais pronostic puisque seulement 2 enfants sont vivants après récidive post radiothérapie. L’une a été réopérée puis réirradiée, avec un résidu stable depuis 10 ans, l’autre a été réopérée mais le recul est inférieur à 6 mois. 21.2.5. Facteurs pronostiques Il existe une relation statistiquement significative entre le type histologique et la survie sans récidive (p < 0,001, log rank) et la survie globale (p < 0,001, log rank), le plus mauvais pronostic étant lié aux formes atypiques/peu différenciées, le meilleur pour les formes classiques et un pronostic intermédiaire pour les formes chondroïdes (Fig. 58 A et B). L’analyse de la localisation (clivus, clivus étendu et rachis) retrouve une tendance sans que celle-ci soit statistiquement significative avec un meilleur pronostique pour les
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
69
Fig. 58. Survie sans progression (A) et survie globale (B) de la série de chordomes pédiatriques en fonction du type histologique Survival without progression (A) and global survival (B) for the series of paediatric chordoma as a function of their histology.
Fig. 59. Survie sans progression (A) et survie globale (B) de la série de chordomes pédiatriques en fonction de la qualité de l’exérèse. Survival without progression (A) and global survival (B) for the series of paediatric chordoma as a function of the type of excision.
clivus et un pronostic plus péjoratif pour les rachis. De même, on note une nette différence sur la survie globale pour les patients en exérèse complète avant radiothérapie versus ceux en exérèse incomplète (Fig. 59). Cependant, la différence n’est pas statistiquement significative du fait du petit nombre de patient en exérèse complète. Le sexe et l’âge au diagnostic (inferieur ou supérieur à la médiane) ne sont pas des facteurs pronostiques dans cette série. 22. Conclusions Nos connaissances sur les chordomes ont certes beaucoup progressé mais il reste encore de nombreuses questions auxquelles nous ne savons toujours pas répondre. Les entités notochordales sont multiples et sont maintenant mieux définies. L’immunohistologie (cytokératines et brachyurie) permet de différencier ce qui est dérivé de la notochorde de ce qui ne l’est pas en particulier les chondrosarcomes et les parachordomes. L’histoire naturelle de chaque chordome n’est pas prévisible. Il existe certainement des formes de chordomes très agressifs et d’autres qui le sont beaucoup moins mais il n’existe à ce jour aucun critère permettant de les différencier et donc aucun moyen d’adapter la stratégie thérapeutique en fonction de cette agressivité. La localisation semble avoir une certaine influence sur l’évolutivité tumorale avec un meilleur pronostic des chordomes de
la base du crâne et un moins bon pour ceux de la charnière craniocervicale. L’âge a peu d’influence hormis chez les rares chordomes de l’enfant de moins de 5 ans. Si l’on exclut les formes dédifférenciées, aucun critère histologique n’a de valeur pronostique et les formes chondroides n’ont pas une évolution plus favorable que les formes conventionnelles. L’exérèse complète, voire monobloc, réalisée en première intention, reste donc certainement le facteur pronostique principal. Plusieurs interventions utilisant différentes voies d’abord peuvent s’avérer nécessaires. En cas de récidive, cette exigence sur la qualité de l’exérèse paraît moins utile à moins qu’elle ne survienne que tardivement. Une exérèse aussi complète sera généralement moins facilement réalisable et les traitements complémentaires limités. L’adjonction d’une radiothérapie sous la forme de protons semble apporter un bénéfice sur l’absence de progression tumorale et sur la survie mais cela ne paraît pas certains pour tous les chordomes ; là encore manque un paramètre d’agressivité qui permettrait d’adapter la dose et sa répartition (zones hypoxiques) à chacun des chordomes. De grands espoirs peuvent être fondés sur la biologie moléculaire et la thérapie ciblée mais nous n’en sommes qu’aux débuts des essais thérapeutiques. Il semble que là encore il faudra apprendre à moduler ces traitements systémiques en fonction de chacun des chordomes.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 70
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Déclaration d’intérêts Les auteurs déclarent ne pas avoir de conflits d’intérêts en relation avec cet article.
Références [1] Luschka H. Die Altersveranderungen der Zwischenwirbelknorpel. Virchows Arch (Path Anat) 1859;9:311–27. [2] Klebs E. Virchows Arch Path Anat 1864;31:396 [Cité par Wright D. 1967]. [3] Linck A. Beitr Path Anat 1909;46:573 [Cité par Wright D. 1967]. [4] Stewart MJ. Malignant sacrococcygeal chordome. J Pathol Bacteriol 1922;25:40–62. [5] Fabricius-Moller J. Hosp Italstidende 1919;62:849 [Cité par Wright D. 1967]. [6] Mabrey RE. Chordomas: a study of 150 cases. Amer J Cancer 1935;25:501 [Cité par Wright D. 1967]. [7] Harvey WF, Dawson EK. Edinb Med J 1941;48:713 [cité par Wright D. 1967]. [8] Faust DB, Gilmore HR, Mudgett CS, et al. Ann intern Med 1944;21:678 [Cité par Wright D. 1967]. [9] Utne JR, Pugh DG. The roentgenologic aspects of chordoma. Am J Roentgenol Radium Ther Nucl Med 1955;74(4):593–608. [10] Muller H. Ueber das Vorkommen von Resten der Chorda dorsalis bei Menschen nach der Geburt und uber ihr Verhaltniss zu den Gallertgeschwulsten am Clivus. Zeitschrift Ration Medic 1858;2:202–29. [11] Mosgrove J. Persistence of the notochord in the human subject. J Anat 1891;25:386–9. [12] Taylor JR. Persistence of the notochordal canal in vertebrae. J Anat 1972;111(Pt 2):211–7. [13] Cotten A, Deprez X, Lejeune JP, Chastanet P, Francke JP, Clarisse J. Persistence of the notochordal canal: plain film and CT findings. Neuroradiology 1995;37(4):308–10. [14] Christopherson LR, Rabin BM, Hallam DK, Russell EJ. Persistence of the notochordal canal: MR and plain film appearance. AJNR Am J Neuroradiol 1999;20(1):33–6. [15] Schmorl G. Über Chordaneste in den Wirbelkôrper. Zbl Chir 1928;37(55):2305–10. [16] Horwitz T. Chordal ectopia and its possible relationship to chordome. Arch Pathol 1941;31:354–62. [17] Spjut HJ, Luse SA. Chordoma: an electron microscopic study. Cancer 1964;17:643–56. [18] Ribbert H. Ueber die experimentelle Erzeugung einer Ecchondrosis physaliphora. Verh Dtsch Kongr Inn Med 1895;13:455–64. [19] Congdon CC. Proliferative lesions resembling chordoma following puncture of the nucleus pulposus in rabbits. J Natl Cancer Inst 1952;12:893–907. [20] Salisbury JR, Deverell MH, Cookson MJ, Whimster WF. Three dimensional reconstruction of human embryonic notochords: clue to the pathogenesis of chordoma. J Pathol 1993;171:59–62. [21] Peacok A. Observations on the postnatal structure of the intervertebral disc in man. J Anat 1952;86:162–79. [22] Ruggeri A. Ultrastructural histochemical and autoradiographic studies on the develoing chick notochord. Zeitschrift fur Anatomie und Entwicklungsgeschichte 1972;138:20–33. [23] Choi H. Response evaluation of gastrointestinal stromal tumors. Oncologist 2008;13(Suppl. 2):4–7. [24] Choi KS, Cohn MJ, Harfe BD. Identification of nucleus pulposus precursor cells and notochordal remnants in the mouse: implications for disk degeneration and chordoma formation. Dev Dyn 2008;237(12):3953–8. [25] Cappell DF. Chordoma of the vertebral column with three new cases. J Pathol Bact 1928;31:797–814. [26] Huber GC. On the relation of the corda dorsalis to the anlage of the pharyngeal bursa or median pharyngeal recess. Anat Rec 1912;6:373–404. [27] Linck A. Anat Hefte 1911;42:605 [Cité par Wright D. 1967]. [28] Bérard L, Dunet C, Peyron A. Les chordomes de la région sacrococcygienne et leur histogenèse. Bull Assoc Fr Etud Cancer 1922;11:28–66. [29] Leroux-Robert J, De Brux J. Chordomes craniaux-cervicaux (à propos de 4 nouveaux cas). Ann Otolaryngol 1962;79:663–79. [30] Ribbert H, Steiner H. Uber die Ecchondrosis physaliphora sphenooccipitalis. Zentralbl Allg Pathol Anat 1894;5:457–61. [31] Steward M, Burrow F. Ecchordosis physaliphora spheno-occipitalis. J Neurol Psychopathol 1923;4(15):218–20. [32] Wyatt RB, Schochet Jr SS, McCormick WF. Ecchordosis physaliphora. An electron microscopic study. J Neurosurg 1971;34(5):672–7. [33] Mehnert F, Beschorner R, Küker W, Hahn U, Nägele T. Retroclival ecchordosis physaliphora: MR imaging and review of the literature. AJNR Am J Neuroradiol 2004;25(10):1851–5. [34] Stam FC, Kamphorst W. Ecchordosis physaliphora as a cause of fatal pontine hemorrhage. Eur Neurol 1982;21(2):90–3. [35] Macdonald RL, Cusimano MD, Deck JH, Gullane PJ, Dolan EJ. Cerebrospinal fluid fistula secondary to ecchordosis physaliphora. Neurosurgery 1990;26(3):515–8 [discussion 518–9]. [36] Alli A, Clark M, Mansell NJ. Cerebrospinal fluid rhinorrhea secondary to ecchordosis physaliphora. Skull Base 2008;18(6):395–9.
[37] Feng K, Qiuhang Z, Qiuyi Q, et al. Transclival cerebrospinal fluid rhinorrhea as the initial presenting symptom of a tiny intradural chordoma. J Clin Neurosci 2010;17(8):1083–5. [38] Akimoto J, Takeda H, Hashimoto T, Haraoka J, Ito H. [A surgical case of ecchordosis physaliphora]. No Shinkei Geka 1996;24(11):1021–5. [39] Toda H, Kondo A, Iwasaki K. Neuroradiological characteristics of ecchordosis physaliphora. Case report and review of the literature. J Neurosurg 1998;89(5):830–4. [40] Ng SH, Ko SF, Wan YL, Tang LM, Ho YS. Cervical ecchordosis physaliphora: CT and MR features. Br J Radiol 1998;71(843):329–31. [41] Cha ST, Jarrahy R, Yong WH, Eby T, Shahinian HK. A rare symptomatic presentation of ecchordosis physaliphora and unique endoscope-assisted surgical management. Minim Invasive Neurosurg 2002;45(1):36–40. [42] Takeyama J, Hayashi T, Shirane R. Notochordal remnant-derived mass: ecchordosis physaliphora or chordoma? Pathology 2006;38(6): 599–600. [43] Ling SS, Sader C, Robbins P, Rajan GP. A case of giant ecchordosis physaliphora: a case report and literature review. Otol Neurotol 2007;28(7):931–3. [44] Fracasso T, Brinkmann B, Paulus W. Sudden death due to subarachnoid bleeding from ecchordosis physaliphora. Int J Legal Med 2008;122(3):225–7. [45] Rotondo M, Natale M, Mirone G, Cirillo M, Conforti R, Scuotto A. A rare symptomatic presentation of ecchordosis physaliphora: neuroradiological and surgical management. J Neurol Neurosurg Psychiatry 2007;78(6):647–9. [46] Alkan O, Yildirim T, Kizilkilic¸ O, Tan M, Cekinmez M. A case of ecchordosis physaliphora presenting with an intratumoral hemorrhage. Turk Neurosurg 2009;19(3):293–6. [47] Tashiro T, Fukuda T, Inoue Y, Nemoto Y, Shakudo M, Katsuyama J, et al. Intradural chordoma: case report and review of the literature. Neuroradiology 1994;36(4):313–5. [48] Mapstone TB, Kaufman B, Ratcheson RA. Intradural chordoma without bone involvement: nuclear magnetic resonance (NMR) appearance. Case report. J Neurosurg 1983;59(3):535–7. [49] Bergmann M, Abdalla Y, Neubauer U, Schildhaus HU, Probst-Cousin S. Primary intradural chordoma: report on three cases and review of the literature. Clin Neuropathol 2010;29(3):169–76. [50] Jiagang L, Yanhui L, Xueying S, Qing M. Intradural suprasellar chondroïd chordoma. J Clin Neurosci 2010;17:402–3. [51] Jiagang L, Yanhui L, Xueying S, Qing M. Intradural suprasellar chondroid chordoma. J Clin Neurosci 2010;17(3):402–3 [Epub 2010 Jan 13]. [52] Ito E, Saito K, Nagatani T, Ishiyama J, Terada K, Yoshida M, et al. Intradural cranial chordoma. World Neurosurg 2010;73(3):194–7. [53] Ciarpaglini R, Pasquini E, Mazzatenta D, Ambrosini-Spaltro A, Sciarretta V, Frank G. Intradural clival chordoma and ecchordosis physaliphora: a challenging differential diagnosis: case report. Neurosurgery 2009;64(2):E387–8 [discussion E388]. [54] Ramiro J, Ferreras B, Pérez Calvo JM, Zafra A. Thoracic intradural chordoma. Surg Neurol 1986;26(6):571–2. [55] Vaz RM, Pereira JC, Ramos U, Cruz CR. Intradural cervical chordoma without bone involvement. Case report. J Neurosurg 1995;82(4):650–3. [56] Gelabert-González M, Pintos-Martínez E, Caparrini-Escondrillas A, MartínezRumbo R. Intradural cervical chordoma. Case report. J Neurosurg Sci 1999;43(2):159–62. [57] Chang SW, Gore PA, Nakaji P, Rekate HL. Juvenile intradural chordoma: case report. Neurosurgery 2008;62(2):E525–6. [58] Kimmell KT, Dayoub H, Stolzenberg ED, Sincoff EH. Chordoma in the lateral medullary cistern in a patient with tuberous sclerosis: a case report and review of the literature. Surg Neurol Int 2010;1:13. [59] Bhat DI, Yasha M, Rojin A, Sampath S, Shankar SK. Intradural clival chordoma: a rare pathological entity. J Neurooncol 2010;96(2):287–90. [60] Ito E, Saito K, Okada T, Nagatani T, Nagasaka T. Long-term control of clival chordoma with initial aggressive surgical resection and gamma knife radiosurgery for recurrence. Acta Neurochir (Wien) 2010;152(1):57–67, discussion 67. [61] Bergmann M, et al. Primary intradural chordoma: report on three cases and review of the literature. Clin Neuropathol 2010;29(3):169–76. [62] Kim SK, Kim YH, Park CK, Kim MA, Park SH. Intracranial intradural chordoma presenting with intraventricular hemorrhage. Clin Neurol Neurosurg 2012;114(8):1189–92. [63] Barresi V, Caffo M, Alafaci C, Granata F, Tuccari G. Intradural chordoma of the Meckel’s cave: a challenging differential diagnosis. Neuropathology 2012;32(5):577–82. [64] Dahlin DC, Maccarty CS. Chordoma. Cancer 1952;5(6):1170–8. [65] Bartolini G. [Chordoma of the clivus as a cause of cerebral hemorrhage: anatomoclinical discussion of an autopsied case]. Boll Soc Ital Biol Sper 1974;50(12):912–8. [66] Mathews W, Wilson CB. Ectopic intrasellar chordoma. Case report. J Neurosurg 1974;40(2):260–3. [67] Vaquero J, Martinez R, Rossi E, Bravo G. Chordoma. Neurosurgery 1983;13(6):737–8. [68] Yuhi F, Asakura T, Tomosugi T, Kusumoto K, Awa H, Uetsuhara KA. Case of clival chordoma without bone destruction. No Shinkei Geka 1986;14(4):547–52. [69] Wolfe 3rd JT, Scheithauer BW. “Intradural Chordoma” or “Giant Ecchordosis Physaliphora”? Report of two cases. Clin Neuropathol 1987;6(3):98–103. [70] Katayama Y, Tsubokawa T, Hirasawa T, Takahata T, Nemoto N. Intradural extraosseous chordoma in the foramen magnum region. Case report. J Neurosurg 1991;75(6):976–9 [Review].
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
[71] Hardie RC. Magnetic resonance appearance of a rare intradural chordoma. Wis Med J 1992;91(11):627–8. [72] Wanibuchi M, Uede T, Ishiguro M, Tatewaki K, Kurokawa Y, Yoshida Y. A Case of suprasellar intradural chordoma. No Shinkei Geka 1994;22(3):269–72. [73] Nishigaya K, Kaneko M, Ohashi Y, Nukui H. Intradural retroclival chordoma without bone involvement: no tumor regrowth 5 years after operation. Case report. J Neurosurg 1998;88(4):764–8. [74] Korinth M, Schönrock L, Mayfrank L. Zentralbl Neurochir 1999;60(3):146–50. [75] Danilewicz B, Danilewicz M, Czepko R, Stachura K. Intradural clivus chordoma: surgical treatment with no tumor regrowth 12 years after surgery. Przegl Lek 2000;57(3):178–80. [76] Masui K, Kawai S, Yonezawa T, Fujimoto K, Nishi N. Intradural retroclival chordoma without bone involvement – case report. Neurol Med Chir (Tokyo) 2006;46(11):552–5. [77] Roberti F, Sekhar LN, Jones RV, Wright DC. Intradural cranial chordoma: a rare presentation of an uncommon tumor. Surgical experience and review of the literature. J Neurosurg 2007;106(2):270–4. [78] Warnick RE, Raisanen J, Kaczmar Jr T, Davis RL, Prados MD. Intradural chordoma of the tentorium cerebelli. Case report. J Neurosurg 1991;74(3): 508–11. [79] Commins D, Baran GA, Molleston M, Vollmer D. Hypothalamic chordoma. Case report. J Neurosurg 1994;81(1):130–2. [80] Dow GR, Robson DK, Jaspan T, Punt JA. Intradural cerebellar chordoma in a child: a case report and review of the literature. Childs Nerv Syst 2003;19(3):188–91. [81] Figueiredo EG, Tavares WM, Welling L, Rosemberg S, Teixeira MJ, et al. Ectopic pineal chordoma. Surg Neurol Int 2011;2:145. [82] Kyriakos M, Totty WG, Lenke LG. Giant vertebral notochordal rest: a lesion distinct from chordoma: discussion of an evolving concept. Am J Surg Pathol 2003;27(3):396–406. [83] Yamaguchi T, Yamato M, Saotome K. First histologically confirmed case of a classic chordoma arising in a precursor benign notochordal lesion: differential diagnosis of benign and malignant notochordal lesions. Skeletal Radiol 2002;31(7):413–8. [84] Ulich TR, Mirra JM. Ecchordosis physaliphora vertebralis. Clin Orthop Relat Res 1982;(163):282–9. [85] Yamaguchi T, Suzuki S, Ishiiwa H, Shimizu K, Ueda Y. Benign notochordal cell tumors: a comparative histological study of benign notochordal cell tumors, classic chordomas, and notochordal vestiges of fetal intervertebral discs. Am J Surg Pathol 2004;28(6):756–61. [86] Yamaguchi T, Suzuki S, Ishiiwa H, Ueda Y. Intraosseous benign notochordal cell tumours: overlooked precursors of classic chordomas? Histopathology 2004;44(6):597–602. [87] Darby AJ, Cassar-Pullicino VN, McCall IW, Jaffray DC. Vertebral intra-osseous chordoma or giant notochordal rest? Skeletal Radiol 1999;28(6):342–6. [88] Mirra JM, Brien EW. Giant notochordal hamartoma of intraosseous origin: a newly reported benign entity to be distinguished from chordoma. Report of two cases. Skeletal Radiol 2001;30(12):698–709. [89] Haasper C, Länger F, Rosenthal H, Knobloch K, Mössinger E, Krettek C, et al. Coccydynia due to a benign notochordal cell tumor. Spine (Phila Pa 1976) 2007;32(14):E394–6. [90] Yamaguchi T, Iwata J, Sugihara S, McCarthy Jr EF, Karita M, Murakami H, et al. Distinguishing benign notochordal cell tumors from vertebral chordoma. Skeletal Radiol 2008;37(4):291–9. [91] Deshpande V, Nielsen GP, Rosenthal DI, Rosenberg AE. Intraosseous benign notochord cell tumors (BNCT): further evidence supporting a relationship to chordoma. Am J Surg Pathol 2007;31(10):1573–7. [92] Yamaguchi T, Watanabe-Ishiiwa H, Suzuki S, Igarashi Y, Ueda Y. Incipient chordoma: a report of two cases of early-stage chordoma arising from benign notochordal cell tumors. Mod Pathol 2005;18(7):1005–10. [93] Nishiguchi T, Mochizuki K, Tsujio T, Nishita T, Inoue Y. Lumbar vertebral chordoma arising from an intraosseous benign notochordal cell tumour: radiological findings and histopathological description with a good clinical outcome. Br J Radiol 2010;83(987):e49–53. [94] Götz W, Kasper M, Fischer G, Herken R. Intermediate filament typing of the human embryonic and fetal notochord. Cell Tissue Res 1995;280(2):455–62. [95] Wang TJ, Shu SH, Lin CW, Chen LF, Lin TC, Chang Chien HS, et al. Thoracic chordoma: an unusual presentation of the spinal tumor. Am J Med Sci 2008;335(3):239–41. [96] Laskowski J. Pathology of tumors. In: Kolodziejska H, editor. Zarys Onkologii. Pzwl: Varsaw; 1955. p. 91–9. [97] Dabska M. Parachordoma: a new clinicopathologic entity. Cancer 1977;40(4):1586–92. [98] Ishida T, Oda H, Oka T, Imamura T, Machinami R. Parachordoma: an ultrastructural and immunohistochemical study. Virchows Arch A Pathol Anat Histopathol 1993;422(3):239–45. [99] Van Akkooi AC, Van Geel AN, Bessems JH, Den Bakker MA. Extra-axial chordoma. J Bone Joint Surg Br 2006;88(9):1232–4. [100] Clabeaux J, Hojnowski L, Valente A. Case report: parachordoma of soft tissues of the arm. Clin Orthop Relat Res 2008;466(5):1251–6. [101] Park SY, Kim SR, Choe YH, Lee KY, Park SJ, Lee HB, et al. Extra-axial chordoma presenting as a lung mass. Respiration 2009;77(2):219–23. [102] Strano S, Ouafi L, Baud M, Alifano M. Primary chordoma of the lung. Ann Thorac Surg 2010;89(1):302–3. [103] Shibuya J, Ichinose T, Kimitsuka G. Chordoma which was found as a solitary lung tumor. Kyobu Geka 2010;63(2):138–41.
71
[104] Kikuchi Y, Yamaguchi T, Kishi H, Azuhata K, Kimizuka G, Hiroshima K, et al. Pulmonary tumor with notochordal differentiation: report of 2 cases suggestive of benign notochordal cell tumor of extraosseous origin. Am J Surg Pathol 2011;35(8):1158–64. [105] Suster S, Moran CA. Chordomas of the mediastinum: clinicopathologic, immunohistochemical, and ultrastructural study of six cases presenting as posterior mediastinal masses. Hum Pathol 1995;26(12):1354–62. [106] Huang SM, Chen CC, Chiu PC, Lai PH, Ho JT, Tseng HH. Unusual presentation of posterior mediastinal chordoma in a 2-year-old boy. J Pediatr Hematol Oncol 2003;25(9):743–6. [107] Notsute D, Maruta K, Tanaka R, Yamaguchi E, Takahashi T, Ito K, et al. A case of primary posterior mediastinal chordoma. Nihon Kokyuki Gakkai Zasshi 2009;47(2):168–74. [108] Spivach A, Zanconati F, Tirabosco R, Falconieri G. Parachordoma of the gastric serosa: report of a myxoid mimicry in an unusual location. Int J Surg Pathol 2007;15(3):307–10. [109] Difrancesco LM, Davanzo Castillo CA, Temple WJ. Extra-axial chordoma. Arch Pathol Lab Med 2006;130(12):1871–4. [110] Sebag G, Dubois J, Beniaminovitz A, Lelouch-Tubiana A, Brunelle F. Extraosseous spinal chordoma: radiographic appearance. Ajnr Am J Neuroradiol 1993;14(1):205–7. [111] Las Heras F, Pritzker KP, Colgan TJ. Chordoma arising in a mature cystic teratoma of the ovary: a case report. Pathol Res Pract 2007;203(6):467–71 [Epub 2007 Apr 6]. [112] Riopelle JL. Teratoma of the ovary, with a segment of vertebral column and remnants of notochordal tissue: report of a case. Am J Pathol 1940;16(5):625–34. [113] Abe S, Imamura T, Harasawa A, Ishida T, Unno K, Tateishi A, et al. Parachordoma with multiple metastases. J Comput Assist Tomogr 2003;27(4):634–8. [114] Kinoshita G, Yasoshima H. Case report: fatal parachordoma. J Orthop Sci 2007;12:101–6. [115] Carstens PH. Chordoid tumor: a light, electron microscopic, and immunohistochemical study. Ultrastruct Pathol 1995;19(4):291–5. [116] De Comas AM, Penfornis P, Harris MR, Meyer MS, Pochampally RR. Derivation and characterization of an extra-axial chordoma cell line (each-1) from a scapular tumor. J Bone Joint Surg Am 2010;92(5):1231–40. [117] Suzuki H, Yamashiro K, Takeda H, Nojima T, Usui M. Extra-axial soft tissue chordoma of wrist. Pathol Res Pract 2011;207(5):327–31. [118] Miettinen M, Gannon FH, Lackman R. Chordomalike soft tissue sarcoma in the leg: a light and electron microscopic and immunohistochemical study. Ultrastruct Pathol 1992;16(5):577–86. [119] Limon J, Babinska M, Denis A, Rys J, Niezabitowski A. Parachordoma: a rare sarcoma with clonal chromosomal changes. Cancer Genet Cytogenet 1998;102(1):78–80. [120] Tirabosco R, Mangham DC, Rosenberg AE, Vujovic S, Bousdras K, Pizzolitto S, et al. Brachyury expression in extra-axial skeletal and soft tissue Chordomas: a marker that distinguishes chordoma from mixed tumor/Myoepithelioma/Parachordoma in soft tissue. Am J Surg Pathol 2008;32(4):572–80. [121] Kilpatrick SE, Limon J. Mixed Tumour/Myoepithelium/Parachordoma. In: Fischer CD, Unni KK, Mertens F, editors. World Health Organization classification of tumours: pathology and genetics of tumour of soft tissue and bone. Lyon France: Iarc Press; 2002. p. 198–9. [122] Eimoto T, Hashimoto K. Vacuolated meningioma. A light and electron microscopic study. Acta Pathol Jpn 1977;27(4):557–66. [123] Dahmen HG. Studies on mucous substances in myxomatous meningiomas. Acta Neuropathol (Berl) 1979;48:235–7. [124] Connors MH. Growth and maturation arrest, hypochromic anemia and hyperglobulinemia associated with a brain tumor. West J Med 1980;133: 160–3. [125] Kepes JJ, Chen WY, Connors MH, Vogel FS. “Chordoid” meningeal tumors in young individuals with peritumoral lymphoplasmacellular infiltrates causing systemic manifestations of the castleman syndrome. A report of seven cases. Cancer 1988;62(2):391–406. [126] Couce ME, Aker FV, Scheithauer BW. Chordoid meningioma: a clinicopathologic study of 42 cases. Am J Surg Pathol 2000;24(7):899–905. [127] Epari S, Sharma MC, Sarkar C, Garg A, Gupta A, Mehta VS. Chordoid meningioma. An uncommon variant of meningioma: a clinicopathologic study of 12 cases. J Neurooncol 2006;78(3):263–9. [128] Civit T, Taillandier L, Baylac F. Chordoid meningioma. J Neurosurg 1998;89(4):686–7. [129] Kozler P, Benes V, Netuka D, Kramár F, Hrabal P, Charvát F. Chordoid meningioma: presentation of two case reports, review of the literature, and plea for data standardisation. J Neurooncol 2008;88(1):115–20. [130] Nambiar A, Pillai A, Parmar C, Panikar D. Intraventricular chordoid meningioma in a child: fever of unknown origin, clinical course, and response to treatment. J Neurosurg Pediatr 2012;10(6):478–81. [131] Wilson JL, Ellis TL, Mott RT. Chordoid meningioma of the third ventricle: a case report and review of the literature. Clin Neuropathol 2011;30(2):70–4. [132] Hayashi T, Haba R, Kushida Y, Kadota K, Katsuki N, Bando K, et al. Cytopathologic features of orbital intraosseous chordoid meningioma: report of a case and distinction from other myxoid/mucoid tumors. Diagn Cytopathol 2010;38(11):818–21. [133] Zhao SL, Li Y, Tian XY, Li Z, Huang Q, Li B. Intraparenchymal cystic chordoid meningioma: a case report and review of the literature. Neuropathology 2011;31(6):648–53.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 72
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
[134] Xi S, Zhang Y, Lin S, Liang J, Zeng J, Wu Q. Intraparenchymal chordoid meningioma: a case report and review of the literature. Int J Surg Pathol 2012;20(6):600–5. ˜ [135] Rowsell C, Sirbovan J, Rosenblum MK, Perez-Ordonez B. Primary chordoid meningioma of lung. Virchows Arch 2005;446(3):333–7. [136] Tena-Suck ML, Collado-Ortìz MA, Salinas-Lara C, García-López R, Gelista N, Rembao-Bojorquez D. Chordoid Meningioma: a report of ten cases. J Neurooncol 2010;99(1):41–8. [137] Wanschitz J, Schmidbauer M, Maier H, Rossler K, Vorkapic P, Budka H. Suprasellar Meningioma with expression of glial fibrillary acidic protein: a peculiar variant. Acta Neuropathol 1995;90:539–44. [138] Brat DJ, Scheithauer BW, Staugaitis SM, Cortez SC, Brecher K, Burger PC. Third ventricular chordoid glioma: a distinct clinicopathologic entity. J Neuropathol Exp Neurol 1998;57(3):283–90. [139] Kurian KM, Summers DM, Statham PF, Smith C, Bell JE, Ironside JW. Third ventricular chordoid glioma: clinicopathological study of two cases with evidence for a poor clinical outcome despite low-grade histological features. Neuropathol Appl Neurobiol 2005;31(4):354–61. [140] Buccoliero AM, Caldarella A, Gallina P, Di Lorenzo N, Taddei A, Taddei GL. Chordoid glioma: clinicopathologic profile and differential diagnosis of an uncommon tumor. Arch Pathol Lab Med 2004;128(11):E141–5. [141] Ricoy JR, Lobato RD, Baez B, Cabello A, Martinez MA, Rodriguez G. Suprasellar chordoid glioma. Acta Neuropathol 2000;99:699–703. [142] Pasquier B, Peoc’h M, Morrison AL, Gay E, Pasquier D, Grand S, et al. Chordoid glioma of the third ventricle - a report of two new cases, with further evidence supporting an ependymal differentiation, and review of literature. Am J Surg Path 2002;26:1330–42. [143] Yang C, Schwab JH, Schoenfeld AJ, Hornicek FJ, Wood KB, Nielsen GP, et al. A novel target for treatment of chordoma: signal transducers and activators of transcription 3. Mol Cancer Ther 2009;8(9):2597–605. [144] Yang XR, Ng D, Alcorta DA, Liebsch NJ, Sheridan E, Li S, et al. T (Brachyury) gene duplication confers major susceptibility to familial chordoma. Nat Genet 2009;41(11):1176–8. [145] Vujovic S, Henderson S, Presneau N, Odell E, Jacques TS, Tirabosco R, et al. Brachyury, a crucial regulator of notochordal development, is a novel biomarker for chordomas. J Pathol 2006;209(2):157–65. [146] Jambhekar NA, Rekhi B, Thorat K, Dikshit R, Agrawal M, Puri A. Revisiting Chordoma with brachyury, a “New Age” marker: analysis of a validation study on 51 cases. Arch Pathol Lab Med 2010;134(8):1181–7. [147] Oakley GJ, Fuhrer K, Seethala RR. Brachyury, Sox-9, and Podoplanin, new markers in the skull base chordoma vs chondrosarcoma differential: a tissue microarray-based comparative analysis. Mod Pathol 2008;21(12):1461–9. [148] Kyriakos M. Benign notochordal lesions of the axial skeleton: a review and current appraisal. Skeletal Radiol 2011;40(9):1141–52. [149] Shen J, Li CD, Yang HL, Lu J, Zou TM, Wang DL, et al. Classic chordoma coexisting with benign notochordal cell rest demonstrating different immunohistological expression patterns of Brachyury and Galectin-3. J Clin Neurosci 2011;18(1):96–9. [150] Palena C, Polev DE, Tsang KY, et al. The human T-Box mesodermal transcription factor Brachyury is a candidate target for T-Cell-mediated cancer immunotherapy. Clin Cancer Res 2007;13:2471–8. [151] Sangoi AR, Karamchandani J, Lane B, Higgins JP, Rouse RV, Brooks JD, et al. Specificity of Brachyury in the distinction of chordoma from clear cell renal cell carcinoma and germ cell tumors: a study of 305 cases. Mod Pathol 2011;24(3):425–9. [152] Hsu W, Mohyeldin A, Shah SR, Ap Rhys CM, Johnson LF, Sedora-Roman NI, et al. Generation of chordoma cell line Jhc7 and the identification of brachyury as a novel molecular target. J Neurosurg 2011;115(4):760–9. [153] Presneau N, Shalaby A, Ye H, Pillay N, Halai D, Idowu B, et al. Role of the transcription factor T (Brachyury) in the pathogenesis of sporadic chordoma: a genetic and functional-based study. J Pathol 2011;223(3):327–35. [154] Yasuda M, Bresson D, Chibbaro S, Cornelius JF, Polivka M, Feuvret L, et al. Chordomas of the skull base and cervical spine: clinical outcomes associated with a multimodal surgical resection combined with proton-beam radiation in 40 patients. Neurosurg Rev 2012;35(2):171–82 [discussion 182–3]. [155] Holton JL, Steel T, Luxsuwong M, Crockard HA, Revesz T. Skull base chordomas: correlation of tumour doubling time with age, mitosis and Ki67 proliferation index. Neuropathol Appl Neurobiol 2000;26(6):497–503. [156] Lin JW, Lu CH, Lin WC, Wu YT, Huang YJ, Shih FY, et al. A clinicopathological study of the significance of the proportion of choroid morphology in chordoid meningioma. J Clin Neurosci 2012;19(6):836–43. [157] Vanhauwaert DJ, Clement F, Van Dorpe J, Deruytter MJ. Chordoid glioma of the third ventricle. Acta Neurochir (Wien) 2008;150(11):1183–91. [158] Gupta R, Rishi A, Suri V, Sharma MC, Gupta A, Garg A, et al. Sacral myxopapillary ependymoma with extensive osteolysis. J Neurooncol 2008;86(3):349–52. [159] Lee KJ, Min BW, Seo HJ, Cho CH. Subcutaneous sacrococcygeal myxopapillary ependymoma in asian female: a case report. J Clin Med Res 2012;4(1):61–3. [160] Lauer SR, Edgar MA, Gardner JM, Sebastian A, Weiss SW. Soft tissue chordomas: a clinicopathologic analysis of 11 cases. Am J Surg Pathol 2013;37(5):719–26. [161] Rekhi B, Sable M, Jambhekar NA. Virchows histopathological, immunohistochemical and molecular spectrum of myoepithelial tumours of soft tissues. Arch 2012;461(6):687–97. [162] Erdem E, et al. Comprehensive review of intracranial chordoma. Radiographics 2003;23(4):995–1009.
[163] Meyers SP, et al. Chordomas of the skull base: MR features. AJNR Am J Neuroradiol 1992;13(6):1627–36. [164] Goel A. Chordoma and chondrosarcoma: relationship to the internal carotid artery. Acta Neurochir (Wien) 1995;133(1–2):30–5. [165] Chisholm EJ, et al. Fused CT and angiography image guided surgery for endoscopic skull base procedures: how we do it. Clin Otolaryngol 2008;33(6):625–8. [166] Hwang PY, Ho CL. Neuronavigation using an image-guided endoscopic transnasal-sphenoethmoidal approach to clival chordomas. Neurosurgery 2007;61(5 Suppl. 2):212–7 [discussion 217–8]. [167] Sze G, et al. Chordomas: MR imaging. Radiology 1988;166(1 Pt 1):187–91. [168] Ikushima I, et al. Chordomas of the skull base: dynamic MRI. J Comput Assist Tomogr 1996;20(4):547–50. [169] Mohanty PP, et al. Primary chondroid chordoma of the petrous part of the temporal bone. Clin Oncol (R Coll Radiol) 2003;15(6):365–6. [170] Ginat DT, et al. Diffusion-weighted imaging for differentiating benign from malignant skull lesions and correlation with cell density. AJR Am J Roentgenol 2012;198(6):W597–601. [171] Ahmed SK, Murata H, Draf W. Clivus chordoma: is it enough to image the primary site? Skull Base 2010;20(2):111–3. [172] Eisen MD, et al. Use of preoperative MR to predict dural, perineural, and venous sinus invasion of skull base tumors. AJNR Am J Neuroradiol 1996;17(10):1937–45. [173] Fischbein NJ, Kaplan MJ, Holliday RA, Dillon WP. Recurrence of clival chordoma along the surgical pathway. AJNR Am J Neuroradiol 2000;21(3):578–83. [174] McPherson CM, Suki D, McCutcheon IE, Gokaslan ZL, Rhines LD, Mendel E. Metastatic disease from spinal chordoma: a 10-year experience. J Neurosurg Spine 2006;5(4):277–80. [175] Curtin HD, Chavali R. Imaging of the skull base. Radiol Clin North Am 1998;36(5):801–17, v-vi. [176] Nishiguchi T, et al. Differentiating benign notochordal cell tumors from chordomas: radiographic features on MRI, CT, and tomography. AJR Am J Roentgenol 2011;196(3):644–50. [177] Almefty K, Pravdenkova S, Colli BO, Al-Mefty O, Gokden M. Chordoma and chondrosarcoma: similar, but quite different, skull base tumors. Cancer 2007;110(11):2457–67. [178] Rosenberg AE, et al. Chondrosarcoma of the base of the skull: a clinicopathologic study of 200 cases with emphasis on its distinction from chordoma. Am J Surg Pathol 1999;23(11):1370–8. [179] Yeom KW, et al. Diffusion-Weighted MRI: distinction of skull base chordoma from chondrosarcoma. AJNR Am J Neuroradiol 2013;34(5):1056–61. [180] Neves F, et al. Head and neck paragangliomas: value of contrast-enhanced 3D MR angiography. AJNR Am J Neuroradiol 2008;29(5):883–9. [181] Gupta R, Khurana N, Singh S, Meher R. Primary chordoma of the nasal cavity: a rare site of presentation. Pathology 2007;39(2):273–5. [182] Yan ZY, Yang BT, Wang ZC, Xian JF, Li M. Primary chordoma in the nasal cavity and nasopharynx: CT and MR imaging findings. Ajnr Am J Neuroradiol 2010;31(2):246–50. [183] Dwivedi RC, Ojha BK, Mishra A, Youssefi P, Thway K, Hassan MS, et al. A rare case of jugular foramen chordoma with an unusual extension. Arch Otolaryngol Head Neck Surg 2011;137(5):513–6. [184] Lipper MH, Cail WS. Chordoma of the petrous bone. South Med J 1991;84(5):629–31. [185] Gerber S, et al. Imaging of sacral tumours. Skeletal Radiol 2008;37(4):277–89. [186] Thornton E, et al. Imaging features of primary and secondary malignant tumours of the sacrum. Br J Radiol 2012;85(1011):279–86. [187] Farsad K, et al. Sacral chordoma. Radiographics 2009;29(5):1525–30. [188] Deprez FC, Van Ruyssevelt C. MRI features of sacrococcygeal chordoma. JBRBTR 2009;92(5):262. [189] Martin C, McCarthy EF. Giant cell tumor of the sacrum and spine: series of 23 cases and a review of the literature. Iowa Orthop J 2010;30:69–75. [190] Shors SM, et al. Best cases from the AFIP: myxopapillary ependymoma of the sacrum. Radiographics 2006;26(Suppl 1):S111–6. [191] Sciubba DM, et al. Chordoma of the spinal column. Neurosurg Clin N Am 2008;19(1):5–15. [192] Smolders D, Wang X, Drevelengas A, Vanhoenacker F, De Schepper AM. Value of MRI in the diagnosis of non-clival, non-sacral chordoma. Skeletal Radiol 2003;32(6):343–50 [Epub 2003 Apr 26]. [193] Sartoretti-Schefer S, et al. Lumbar vertebral chordoma: diffusion-weighted imaging findings are helpful to narrow the differential diagnosis. A case report. Clin Imaging 2013;37(1):176–9. [194] Rodallec MH, et al. Diagnostic imaging of solitary tumors of the spine: what to do and say. Radiographics 2008;28(4):1019–41. [195] Laredo JD, Morvan G, Wybier M. Imagerie ostéo-articulaire. Paris: Flammarion; 1998. [196] Alexander J, et al. Vertebral hemangioma: an important differential in the evaluation of locally aggressive spinal lesions. Spine (Phila Pa 1976) 2010;35(18):E917–20. [197] Shankar J, et al. The usefulness of CT perfusion in differentiation between neoplastic and tuberculous disease of the spine. J Neuroimaging 2009;19(2):132–8. [198] Kendall BE. Cranial chordomas. Br J Radiol 1977;50(598):687–98. [199] Casali PG, Messina A, Stacchiotti S, Tamborini E, Crippa F, Gronchi A, et al. Imatinib mesylate in chordoma. Cancer 2004;101(9):2086–97. [200] Ma XM, Blenis J. Molecular mechanisms of mTOR-mediated translational control. Nat Rev Mol Cell Biol 2009;10:307–18.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
[201] McMaster ML, Goldstein AM, Parry DM. Clinical features distinguish childhood chordoma associated with tuberous sclerosis complex (TSC) from chordoma in the general paediatric population. J Med Genet 2011;48(7):444–9. [202] Franz DN, Leonard J, Tudor C, Chuck G, Care M, Sethuraman G, et al. Rapamycin causes regression of astrocytomas in tuberous sclerosis complex. Ann Neurol 2006;59(3):490–8. [203] Ranger A, Szymczak A. Do intracranial neoplasms differ in ollier disease and maffucci syndrome? an in-depth analysis of the literature. Neurosurgery 2009;65(6):1106–13 [discussion 1113–5. Review]. [204] Liu J, Hudkins PG, Swee RG, Unni KK. Bone sarcomas associated with Ollier’s disease. Cancer 1987;59(7):1376–85. [205] Weber W, Scott RJ. Case report: familial gastric cancer and chordoma in the same family. Hered Cancer Clin Pract 2005;3(2):81–4. [206] De Jesús-Monge WE, Torres EA, Báez VM, De Jesús O, Rivera L, GonzálezKeelan C. Crohn’s disease associated to chordoma: a case report. P R Health Sci J 2004;23(3):233–6. [207] Li ZS, Wei MQ, Fu X, Cheng H, Li Q. Chordoma coexisting with rathke’s cleft cyst: case report and literature review. Neuropathology 2011;31(1):66–70. [208] Arita-Melzer O, Medina H, Borsotto G, Gamboa A, Larriva-Sahd J, Trejo G, et al. An ectopic adrenocorticotropic hormone syndrome caused by a sacrococcygeal chordoma: report of a case with a slow progression. Endocr Pract 1998;4(1):37–40. [209] Lohman BD, Sarikaya B, McKinney AM, Hadi M. Not the typical Tornwaldt’s cyst this time? A nasopharyngeal cyst associated with canalis basilaris medianus. Br J Radiol 2011;84(1005):e169–71. [210] Wright D. Nasopharyngeal and cervical chordoma–some aspects of their development and treatment. J Laryngol Otol 1967;81(12):1337–55. [211] Batsakis JG, Kittleson AC. Chordomas: otorhinolaryngologic presentation and diagnosis. Arch Otolaryngol 1963;78:168–75. [212] Richter Jr HJ, Batsakis JG, Boles R. Chordomas: nasopharyngeal presentation and atypical long survival. Ann Otol Rhinol Laryngol 1975;84(3 Pt 1):327–32. [213] Shugar JM, Som PM, Krespi YP, Arnold LM, Som ML. Primary chordoma of the maxillary sinus. Laryngoscope 1980;90(11 Pt 1):1825–30. [214] Coppens JR, Ric Harnsberger H, Finn MA, Sharma P, Couldwell WT. Oronasopharyngeal chordomas. Acta Neurochir (Wien) 2009;151(8):901–7. [215] Loughran S, Badia L, Lund V. Primary chordoma of the ethmoid sinus. J Laryngol Otol 2000;114(8):627–9. [216] Scartozzi R, Couch M. Sciubba jchondroid chordoma of the nasal septum. Arch Otolaryngol Head Neck Surg 2003;129(2):244–6. [217] Lynn-Macrae A, Haines 3rd GK, Altman KW. Primary chordoma of the lateral nasal wall: case report and review. Ear Nose Throat J 2005;84(9):593–5. [218] Kitai R, Yoshida K, Kubota T, Sato K, Handa Y, Kasahara K, et al. Clival chordoma manifesting as nasal bleeding. A case report. Neuroradiology 2005;47(5):368–71. [219] Nguyen RP, Salzman KL, Stambuk HE, Ahuja AT, Harnsberger HR. Extraosseous chordoma of the nasopharynx. Ajnr Am J Neuroradiol 2009;30(4):803–7. [220] Singh G, Nakaji P, Chen F, Garrett M, Little A, Milligan J. Spontaneous debulking of middle fossa chordoma extension after transnasal petroclival biopsy–report of a case. Minim Invasive Neurosurg 2011;54(3):135–7 [Epub 2011 Aug 23]. [221] Kaufman BA, Francel PC, Roberts RL, Argemand E, Park TS, Dehner LP. Chondroid chordoma of the lateral skull base. Pediatr Neurosurg 1995;23(3):159–65. [222] Itoh T, Harada M, Ichikawa T, Shimoyamada K, Katayama N, Tsukune Y. A case of jugular foramen chordoma with extension to the neck: CT and MR findings. Radiat Med 2000;18(1):63–5. [223] Iwasaki S, Ito K, Takai Y, Morita A, Murofushi T. Chondroid chordoma at the jugular foramen causing retrolabyrinthine lesions in both the cochlear and vestibular branches of the eighth cranial nerve. Ann Otol Rhinol Laryngol 2004;113(1):82–6. [224] Oghalai JS, Leung MK, Jackler RK, McDermott MW. Transjugular craniotomy for the management of jugular foramen tumors with intracranial extension. Otol Neurotol 2004;25(4):570–9 [discussion 579]. [225] Huang Q, Wu H, Wang ZY, Yang J, Chen L, Jia H. Diagnosis and treatment of chordoma in the jugular foramen area: three cases report. Zhonghua Er Bi Yan Hou Tou Jing Wai Ke Za Zhi 2008;43(8):577–81. [226] Takei H, Rivera A, Suzuki H, Bahrami A, Powell SZ. Jugular foramen chordoid meningioma. Pathol Int 2006;56(7):397–401. [227] Yuh WT, Flickinger FW, Barloon TJ, Montgomery WJ. MR imaging of unusual chordomas. J Comput Assist Tomogr 1988;12(1):30–5. [228] Falcioni M, Taibah A, Caruso A, et al. Clival chordoma mimicking a trigeminal schwannoma. Otol Neurotol 2001;22(5):706–7. [229] Lu CY, Chai CY, Chiang IC. Chordoma mimicking the trigeminal schwannoma: a case report. Clin Imaging 2004;28(3):187–90. [230] Roche PH, Mercier P, Fournier HD. Temporopolar epidural transcavernous transpetrous approach. Technique and indications. Neurochirurgie 2007;53(1):23–31. [231] Bhadra AK, Casey AT. Familial chordoma. A report of two cases. J Bone Joint Surg Br 2006;88(5):634–6. [232] Miozzo M, Dalprà L, Riva P, Volontà M, Macciardi F, Pericotti S, et al. A tumor suppressor locus in familial and sporadic chordoma maps to 1p36. Int J Cancer 2000;87(1):68–72. [233] Kelley MJ, Korczak JF, Sheridan E, Yang X, Goldstein AM, Parry DM. Familial chordoma, a tumor of notochordal remnants, is linked to chromosome 7q33. Am J Hum Genet 2001;69(2):454–60.
73
[234] Stepanek J, Cataldo SA, Ebersold MJ, Lindor NM, Jenkins RB, Unni K, et al. Familial Chordoma with probable autosomal dominant inheritance. Am J Med Genet 1998;75(3):335–6. [235] Yang XR, Beerman M, Bergen AW, Parry DM, Sheridan E, Liebsch NJ, et al. Corroboration of a familial chordoma locus on chromosome 7q and evidence of genetic heterogeneity using single nucleotide polymorphisms (Snps). Int J Cancer 2005;116(3):487–91. [236] Kispert A, Herrmann BG. Immunohistochemical analysis of the Brachyury protein in wild-type and mutant mouse embryos. Dev Biol 1994;161(1):179–93. [237] Foote RF, Ablin G, Hall WMW. Chordoma in siblings. California Med 1958;88:383–6. [238] Enin IP. Chordoma of the nasopharynx in two members of a family. Vestn Otoinolaringol 1964;26:88–90. [239] Kerr WA, Allen KL, Haynes DR, Sellars SL. Letter: familial nasopharyngeal chordoma. S Afr Med J 1975;49(39):1584. [240] Chetty R, Levin CV, Kalan MR. Chordoma: a 20-year clinicopathologic review of the experience at Groote Schuur hospital, Cape Town. J Surg Oncol 1991;46(4):261–4. [241] Dalprà L, Malgara R, Miozzo M, Riva P, Volonte M, Larizza L, et al. First cytogenetic study of a recurrent familial chordoma of the clivus. Int J Cancer 1999;81(1):24–30. [242] Korczak JF, Kelley MJ, Allikian KA, Shah AA, Goldstein AM, Parry DM. Genomic screening for linkage in a family with autosomal dominant chordoma. Am J Hum Genet 1997;61(A400). [243] Heffelfinger MJ, Dahlin DC, Maccarty CS, Beabout JW. Chordomas and cartilaginous tumors at the skull base. Cancer 1973;32(2):410–20. [244] Chambers PW, Schwinn CP. Chordoma. A clinicopathologic study of metastasis. Am J Clin Pathol 1979;72(5):765–76. [245] Bergh P, Kindblom LG, Gunterberg B, Remotti F, Ryd W, Meis-Kindblom JM. Prognostic factors in chordoma of the sacrum and mobile spine: a study of 39 patients. Cancer 2000;88(9):2122–34. [246] Markwalder TM, Markwalder RV, Robert JL, Krneta A. Metastatic chordoma. Surg Neurol 1979;12(6):473–8. [247] Kamel MH, Lim C, Kelleher M, Aquilina K, Keohane C, Kaar G. Intracranial metastasis from a sacrococcygeal chordoma. Case report. J Neurosurg 2005;102(4):730–2. [248] Collins G.R., Essary L, Strauss J, Hino P, Cockerell CJ. Incidentally discovered distant cutaneous metastasis of sacral chordoma: a case with variation in s100 protein expression (compared to the primary tumor) and review of the literature. J Cutan Pathol 2012;39(6):637–43. [249] York JE, Kaczaraj A, Abi-Said D, Fuller GN, Skibber JM, Janjan NA, et al. Sacral chordoma: 40-year experience at a major cancer center. Neurosurgery 1999;44(1):74–9 [discussion 79–80]. [250] Kanthan R, Senger JL. Fine-needle aspiration cytology with histological correlation of chordoma metastatic to the lung: a diagnostic dilemma. Diagn Cytopathol 2011;39(12):927–32. [251] Azarpira N, Soluki S, Sepidbakht S, Mardani R. Humerus metastasis from a sacrococcygeal chordoma: a case report. J Med Case Rep 2010;4(1): 165. [252] Loehn B, Walvekar Rr, Harton A, Nuss D. Mandibular metastasis from a skull base chordoma: report of a case with review of literature. Skull Base 2009;19(5):363–8. [253] Zemmoura I, Ben Ismail M, Travers N, Jan M, Franc¸ois P. Maxillary surgical seeding of a clival chordoma. Br J Neurosurg 2012;26(1):102–3. [254] Rubin AI, Bagel J, Niedt G. Chordoma Cutis. J Am Acad Dermatol 2005;52(5 Suppl. 1):S105–8. [255] Dahlin DC. Bone tumours: general aspects and data on 6221 cases. 3rd Springfield: Charles C Thomas; 1978. [256] Chopra S, Frank SJ, Gu M. Cytologic diagnosis of chordoma in a peritoneal effusion: a case report. Acta Cytol 2010;54(3):341–4. [257] Oda Y, Takada R, Koitabashi K, Kurasawa T, Inoue T, Suzuki H, et al. Ohmiya Kisolated cardiac metastasis from sacral chordoma. Jpn Circ J 2000;64(8):627–30. [258] Delank KS, Kriegsmann J, Drees P, Eckardt A, Eysel P. Metastasizing chordoma of the lumbar spine. Eur Spine J 2002;11(2):167–71. [259] Zukerberg LR, Young RH. Chordoma metastatic to the ovary. Arch Pathol Lab Med 1990;114(2):208–10. [260] Tot T. Metastatic chordoma of the breast: an extremely rare lesion mimicking mucinous cancer. Apmis 2006;114(10):726–9. [261] Arnautovic´ KI, Al-Mefty O. Surgical seeding of chordomas. J Neurosurg 2001;95(5):798–803. [262] Fagundes MA, Hug EB, Liebsch NJ, Daly W, Efird J, Munzenrider JE, et al. Radiation therapy for chordomas of the base of skull and cervical spine: patterns of failure and outcome after relapse. Int J Radiat Oncol Biol Phys 1995;33(3):579–84. [263] Holzner H. Unusual metastasis of chordoma. Zentralbl Allg Pathol 1954;92(1–2):12–8. [264] Stough DR, Hartzog JT, Fisher RG. Unusual intradural spinal metastasis of a cranial chordoma. Case report. J Neurosurg 1971;34(4):560–2. [265] Plese JP, Borges JM, Nudelman M, Lefèvre AB, Sallum J. Unusual subarachnoid metastasis of an intracranial chordoma in infancy. Childs Brain 1978;4(4):251–6. [266] Marigil MA, Pardo-Mindan FJ, Joly M. Diagnosis of chordoma by cytologic examination of cerebrospinal fluid. Am J Clin Pathol 1983;80(3): 402–4.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 74
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
[267] Raffel C, Wright DC, Gutin PH, Wilson CB. Cranial chordomas: clinical presentation and results of operative and radiation therapy in twenty-six patients. Neurosurgery 1985;17(5):703–10. [268] Krol G, Sze G, Arbit E, Marcove R, Sundaresan N. Intradural metastases of chordoma. AJNR Am J Neuroradiol 1989;10(1):193–5. [269] Forsyth PA, Cascino TL, Shaw EG, Scheithauer BW, O’Fallon JR, Dozier JC, et al. Intracranial chordomas: a clinicopathological and prognostic study of 51 cases. J Neurosurg 1993;78(5):741–7. [270] Asano S, Kawahara N, Kirino T. Intradural spinal seeding of a clival chordoma. Acta Neurochir (Wien) 2003;145(7):599–603. [271] Champeaux K, San-Galli F, Eimer S, Liguoro D. Chordoma radicular metastasis following cerebrospinal fluid dissemination. Neurochirurgie 2008;54(1):41–5. [272] Martin MP, Olson S. Intradural drop metastasis of a clival chordoma. J Clin Neurosci 2009;16(8):1105–7. [273] Hanna SA, Tirabosco R, Amin A, Pollock RC, Skinner JA, Cannon SR, et al. Dedifferentiated chordoma: a report of four cases arising ‘de novo’. J Bone Joint Surg Br 2008;90(5):652–6. [274] Meis JM, Raymond AK, Evans HL, Charles RE, Giraldo AA. “Dedifferentiated” chordoma. A clinicopathologic and immunohistochemical study of three cases. Am J Surg Pathol 1987;11(7):516–25. [275] Dahlin DC. Chordoma. In: Dahlin’s bone tumors. General aspects and data on 11 087 cases. 5th Philadelphia: Lippincott-Raven; 1996. p. 291–306. [276] Morimitsu Y, Aoki T, Yokoyama K, Hashimoto H. Sarcomatoid chordoma: chordoma with a massive malignant spindle-cell component. Skeletal Radiol 2000;29(12):721–5. [277] Ikeda H, Honjo J, Sakurai H, Mitsuhashi N, Fukuda T, Niibe H. Dedifferentiated chordoma arising in irradiated sacral chordoma. Radiat Med 1997;15(2):109–11. [278] Hruban RH, May M, Marcove RC, Huvos AG. Lumbo-sacral chordoma with high-grade malignant cartilaginous and spindle cell components. Am J Surg Pathol 1990;14(4):384–9 [Review]. [279] Halpern J, Kopolovic J, Catane R. Malignant fibrous histiocytoma developing in irradiated sacral chordoma. Cancer 1984;53(12):2661–2. [280] Choi YJ, Kim TS. Malignant fibrous histiocytoma in chordoma– immunohistochemical evidence of transformation from chordoma to malignant fibrous histiocytoma. Yonsei Med J 1994;35(2):239–43. [281] Fukuda T, Aihara T, Ban S, Nakajima T, Machinami R. Sacrococcygeal chordoma with a malignant spindle cell component. A report of two autopsy cases with a review of the literature. Acta Pathol Jpn 1992;42(6):448–53. [282] Bisceglia M, D’Angelo VA, Guglielmi G, Dor DB, Pasquinelli G. Dedifferentiated chordoma of the thoracic spine with rhabdomyosarcomatous differentiation. Report of a case and review of the literature. Ann Diagn Pathol 2007;11(4):262–73. [283] MacSweeney F, Darby A, Saifuddin A. Dedifferentiated chondrosarcoma of the appendicular skeleton: MRI-pathological correlation. Skeletal Radiol 2003;32:671–8. [284] Saifuddin A, Mann BS, Mahroof S, et al. Dedifferentiated chondrosarcoma: use of MRI to guide needle biopsy. Clin Radiol 2004;59:268–72. [285] Fleming GF, Heimann PS, Stephens JK, Simon MA, Ferguson MK, Benjamin RS, et al. Dedifferentiated chordoma. Response to aggressive chemotherapy in two cases. Cancer 1993;72(3):714–8. [286] Mcmaster ML, Goldstein AM, Bromley CM, Ishibe N, Parry DM. Chordoma: incidence and survival patterns in the United States, 1973–1995. Cancer Causes Control 2001;12(1):1–11. [287] Dorfman HD, Czerniak B. Bone cancers. Cancer 1995;75(1 Suppl.):203–10. [288] Eriksson B, Gunterberg B, Kindblom LG. Chordoma. A clinicopathologic and prognostic study of a Swedish national series. Acta Orthop Scand 1981;52(1):49–58. [289] Mukherjee D, Chaichana KL, Adogwa O, Gokaslan Z, Aaronson O, Cheng JS, et al. Association of extent of local tumor invasion and survival in patients with malignant primary osseous spinal neoplasms from the surveillance, epidemiology, and end results (Seer) database. World Neurosurg 2011;76(6):580–5. [290] Mukherjee D, Chaichana KL, Gokaslan ZL, Aaronson O, Cheng JS, Mcgirt MJ. Survival of patients with malignant primary osseous spinal neoplasms: results from the surveillance, epidemiology, and end results (Seer) database from 1973 to 2003. J Neurosurg Spine 2011;14(2):143–50. [291] Healey JH, Lane JM. Chordoma: a critical review of diagnosis and treatment. Orthop Clin North Am 1989;20(3):417–26. [292] Gagliardi F, Boari N, Riva P, Mortini P. Current therapeutic options and novel molecular markers in skull base chordomas. Neurosurg Rev 2012;35(1):1–13 [discussion 13–4]. [293] Samii A, Gerganov Vm, Herold C, Hayashi N, Naka T, Mirzayan Mj, et al. Chordomas of the skull base: surgical management and outcome. J Neurosurg 2007;107(2):319–24. [294] Fuentes JM, Benezech J. Strategy of the surgical treatment of primary tumors of the spine. Neurochirurgie 1989;35(5):323–7, 352. [295] Kelley SP, Ashford RU, Rao AS, Dickson RA. Primary bone tumours of the spine: a 42-year survey from the Leeds regional bone tumour registry. Eur Spine J 2007;16(3):405–9. [296] Paavolainen P, Teppo L. Chordoma in Finland. Acta Orthop Scand 1976;47(1):46–51. [297] O’Neill P, Bell BA, Miller JD, Jacobson I, Guthrie W. Fifty years of experience with chordomas in southeast Scotland. Neurosurgery 1985;16(2): 166–70.
[298] Ridenour 3rd RV, Ahrens WA, Folpe AL, Miller DV. Clinical and histopathologic features of chordomas in children and young adults. Pediatr Dev Pathol 2010;13(1):9–17. [299] Borba LA, Al-Mefty O, Mrak RE, Suen J. Cranial chordomas in children and adolescents. J Neurosurg 1996;84(4):584–91 [Review]. [300] Coffin CM, Swanson PE, Wick MR, Dehner LP. Chordoma in childhood and adolescence. A clinicopathologic analysis of 12 cases. Arch Pathol Lab Med 1993;117(9):927–33. [301] Sibley RK, Day DL, Dehner LP, Trueworthy RC. Metastasizing chordoma in early childhood: a pathological and immunohistochemical study with review of the literature. Pediatr Pathol 1987;7(3):287–301. [302] Iwasa Y, Nakashima Y, Okajima H, Morishita S. Sacral chordoma in early childhood: clinicopathological and immunohistochemical study. Pediatr Dev Pathol 1998;1(5):420–6. [303] Wold LE, Laws Jr ER. Cranial chordomas in children and young adults. J Neurosurg 1983;59(6):1043–7. [304] Hoch BL, Nielsen GP, Liebsch NJ, Rosenberg AE. Base of skull chordomas in children and adolescents: a clinicopathologic study of 73 cases. Am J Surg Pathol 2006;30(7):811–8. [305] Walcott BP, Nahed BV, Mohyeldin A, Coumans J-V, Kahle KT, Ferreira MJ. Chordoma: current concepts, management, and future directions. Lancet Oncol 2012;13:e69–76. [306] Brada M, Pijls-Johannesma M, De Ruysscher D. Proton therapy in clinical practice: current clinical evidence. J Clin Oncol Off J Am Soc Clin Oncol 2007;25:965–70. [307] Schulz-Ertner D, Karger CP, Feuerhake A, Nikoghosyan A, Combs SE, Jäkel O, et al. Effectiveness of carbon ion radiotherapy in the treatment of skull-base chordomas. Int J Radiat Oncol Biol Phys 2007;68(2):449–57 [Epub 2007 Mar 23]. [308] Roy A, Chakrabarty A. Sacral and skull base chordoma: metastases or second primary? Br J Neurosurg 2000;14:597–8. [309] Watkins L, Khudados ES, Kaleoglu M, Revesz T, Sacares P, Crockard HA. Skull base chordomas: a review of 38 patients, 1958–88. Br J Neurosurg 1993;7:241–8. [310] Menezes AH, Gantz BJ, Traynelis VC, McCulloch TM. Cranial base chordomas. Clin Neurosurg 1997;44:491–509. [311] Noël G, Feuvret L, Calugaru V, Dhermain F, Mammar H, Haie-Méder C, et al. Chordomas of the base of the skull and upper cervical spine. One hundred patients irradiated by a 3D conformal technique combining photon and proton beams. Acta Oncol 2005;44(7):700–8. [312] Ares C, Hug EB, Lomax AJ, Bolsi A, Timmermann B, Rutz HP, et al. Effectiveness and safety of spot scanning proton radiation therapy for chordomas and chondrosarcomas of the skull base: first long-term report. Int J Radiat Oncol Biol Phys 2009;75:1111–8. [313] Carpentier A, Polivka M, Blanquet A, Lot G, George B. Suboccipital and cervical chordomas: the value of aggressive treatment at first presentation of the disease. J Neurosurg 2002;97(5):1070–7. [314] Magrini SM, Papi MG, Marletta F, Tomaselli S, Cellai E, Mungai V, et al. Chordoma-natural history, treatment and prognosis. The Florence Radiotherapy Department experience (1956–1990) and a critical review of the literature. Acta Oncol Stockh Swed 1992;31:847–51. [315] Romero J, Cardenes H, la Torre A, Valcarcel F, Magallon R, Regueiro C, et al. Chordoma: results of radiation therapy in eighteen patients. Radiother Oncol J Eur Soc Ther Radiol Oncol 1993;29:27–32. [316] Catton C, O’Sullivan B, Bell R, Laperriere N, Cummings B, Fornasier V, et al. Chordoma: long-term follow-up after radical photon irradiation. Radiother Oncol 1996;41:67–72. [317] Zorlu F, Gürkaynak M, Yildiz F, Oge K, Atahan IL. Conventional external radiotherapy in the management of clivus chordomas with overt residual disease. Neurol Sci Off J Ital Neurol Soc Ital Soc Clin Neurophysiol 2000;21:203–7. [318] Orecchia R, Zurlo A, Loasses A, Krengli M, Tosi G, Zurrida S, et al. Particle beam therapy (hadrontherapy): basis for interest and clinical experience. Eur J Cancer Oxf Engl 1990 1998;34:459–68. [319] Berson AM, Castro JR, Petti P, Phillips TL, Gauger GE, Gutin P, et al. Charged particle irradiation of chordoma and chondrosarcoma of the base of skull and cervical spine: The Lawrence Berkeley laboratory experience. Int J Radiat Oncol Biol Phys 1988;15(3):559–65. [320] Austin-Seymour M, Munzenrider J, Goitein M, Verhey L, Urie M, Gentry R, et al. Fractionated proton radiation therapy of chordoma and low-grade chondrosarcoma of the base of the skull. J Neurosurg 1989;70:13–7. [321] Benk V, Liebsch NJ, Munzenrider JE, Efird J, McManus P, Suit H. Base of skull and cervical spine chordomas in children treated by high-dose irradiation. Int J Radiat Oncol Biol Phys 1995;31(3):577–81. [322] Hug EB, Loredo LN, Slater JD, DeVries A, Grove RI, Schaefer RA, et al. Proton radiation therapy for chordomas and chondrosarcomas of the skull base. J Neurosurg 1999;91(3):432–9. [323] Munzenrider JE, Liebsch NJ. Proton therapy for tumors of the skull base. Strahlenther Onkol Organ Dtsch Röntgengesellschaft Al 1999;175(Suppl. 2):57–63. [324] Igaki H, Koichi T, Toshiyuki O, Shinji S, Kenji K, Masaharu H, et al. Clinical results of proton beam therapy for skull base chordoma. Int J Radiat Oncol Biol Phys 2004;60(4):1120–6. [325] Fuji H, Nakasu Y, Ishida Y, Horiguchi S, Mitsuya K, Kashiwagi H, et al. Feasibility of proton beam therapy for chordoma and chondrosarcoma of the skull base. Skull Base Off J North Am Skull Base Soc Al 2011;21:201–6. [326] Rombi B, Ares C, Hug EB, Schneider R, Goitein G, Staab A, et al. Spot-scanning proton radiation therapy for pediatric chordoma and chondrosarcoma:
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
[327]
[328]
[329]
[330]
[331]
[332]
[333]
[334]
[335]
[336]
[337]
[338]
[339]
[340] [341]
[342]
[343]
[344]
[345]
[346] [347]
[348] [349]
[350]
[351]
[352] [353]
clinical outcome of 26 patients treated at Paul Scherrer institute. Int J Radiat Oncol Biol Phys 2013;86:578–84. Santoni R, Liebsch N, Finkelstein DM, Hug E, Hanssens P, Goitein M, et al. Temporal lobe (TL) damage following surgery and high-dose photon and proton irradiation in 96 patients affected by chordomas and chondrosarcomas of the base of the skull. Int J Radiat Oncol Biol Phys 1998;41:59–68. Glosser G, McManus P, Munzenrider J, Austin-Seymour M, Fullerton B, Adams J, et al. Neuropsychological function in adults after high dose fractionated radiation therapy of skull base tumors. Int J Radiat Oncol Biol Phys 1997;38:231–9. Pehlivan B, Ares C, Lomax AJ, Stadelmann O, Goitein G, Timmermann B, et al. Temporal lobe toxicity analysis after proton radiation therapy for skull base tumors. Int J Radiat Oncol Biol Phys 2012;83:1432–40. Debus J, Hug EB, Liebsch NJ, O’Farrel D, Finkelstein D, Efird J, et al. Brainstem tolerance to conformal radiotherapy of skull base tumors. Int J Radiat Oncol Biol Phys 1997;39:967–75. Marucci L, Niemierko A, Liebsch NJ, Aboubaker F, Liu MCC, Munzenrider JE. Spinal cord tolerance to high-dose fractionated 3D conformal proton-photon irradiation as evaluated by equivalent uniform dose and dose volume histogram analysis. Int J Radiat Oncol Biol Phys 2004;59:551–5. Pai HH, Thornton A, Katznelson L, Finkelstein DM, Adams JA, Fullerton BC, et al. Hypothalamic/pituitary function following high-dose conformal radiotherapy to the base of skull: demonstration of a dose-effect relationship using dose-volume histogram analysis. Int J Radiat Oncol Biol Phys 2001;49:1079–92. Habrand IL, Austin-Seymour M, Birnbaum S, Wray S, Carroll R, Munzenrider J, et al. Neurovisual outcome following proton radiation therapy. Int J Radiat Oncol Biol Phys 1989;16:1601–6. Urie MM, Fullerton B, Tatsuzaki H, Birnbaum S, Suit HD, Convery K, et al. A dose response analysis of injury to cranial nerves and/or nuclei following proton beam radiation therapy. Int J Radiat Oncol Biol Phys 1992;23:27–39. Muthukumar N, Kondziolka D, Lunsford LD, Flickinger JC. Stereotactic radiosurgery for chordoma and chondrosarcoma: further experiences. Int J Radiat Oncol Biol Phys 1998;41:387–92. Pamir MN, Kilic¸ T, Türe U, Ozek MM. Multimodality management of 26 skull-base chordomas with 4-year mean follow-up: experience at a single institution. Acta Neurochir (Wien) 2004;146(4):343–54 [discusion 354]. Feigl GC, Bundschuh O, Gharabaghi A, Safavi-Abassi S, El Shawarby A, Samii M, et al. Evaluation of a new concept for the management of skull base chordomas and chondrosarcomas. J Neurosurg 2005;102(Suppl.):165–70. Krishnan S, Foote RL, Brown PD, Pollock BE, Link MJ, Garces YI. Radiosurgery for cranial base chordomas and chondrosarcomas. Neurosurgery 2005;56(4):777–84 [discussion 777–84]. Martin JJ, Niranjan A, Kondziolka D, Flickinger JC, Lozanne KA, Lunsford LD. Radiosurgery for chordomas and chondrosarcomas of the skull base. J Neurosurg 2007;107:758–64. Liu A-L, Wang Z-C, Sun S-B, Wang M-H, Luo B, Liu P. Gamma knife radiosurgery for residual skull base chordomas. Neurol Res 2008;30:557–61. Henderson FC, McCool K, Seigle J, Jean W, Harter W, Gagnon GJ. Treatment of chordomas with CyberKnife: Georgetown university experience and treatment recommendations. Neurosurgery 2009;64:A44–53. Jiang B, Veeravagu A, Lee M, Harsh GR, Lieberson RE, Bhatti I, et al. Management of intracranial and extracranial chordomas with CyberKnife stereotactic radiosurgery. J Clin Neurosci Off J Neurosurg Soc Australas 2012;19:1101–6. Hauptman JS, Barkhoudarian G, Safaee M, Gorgulho A, Tenn S, Agazaryan N, et al. Challenges in linear accelerator radiotherapy for chordomas and chondrosarcomas of the skull base: focus on complications. Int J Radiat Oncol Biol Phys 2012;83:542–51. Debus J, Schulz-Ertner D, Schad L, Essig M, Rhein B, Thillmann CO, et al. Stereotactic fractionated radiotherapy for chordomas and chondrosarcomas of the skull base. Int J Radiat Oncol Biol Phys 2000;47(3):591–6. Scheil S, Bruderlein S, Liehr T, Starke H, Herms J, Schulte M, et al. Genomewide analysis of sixteen chordomas by comparative genomic hybridization and cytogenetics of the first human chordoma cell line, U-CH1. Genes Chromosomes Cancer 2001;32:203–11. Brandal P, Bjerkehagen B, Danielsen H, Heim S. Chromosome 7 abnormalities are common in chordomas. Cancer Genet Cytogenet 2005;160:15–21. Hallor KH, Staaf J, Jönsson G, Heidenblad M, Vult von Steyern F, Bauer HC, et al. Frequent deletion of the CDKN2A locus in chordoma: analysis of chromosomal imbalances using array comparative genomic hybridisation. Br J Cancer 2008;98(2):434–42. Larizza L, Mortini P, Riva P. Update on the cytogenetics and molecular genetics of chordoma. Hered Cancer Clin Pract 2005;3(1):29–41. Almefty KK, Pravdenkova S, Sawyer J, Al-Mefty O. Impact of cytogenetic abnormalities on the management of skull base chordomas. J Neurosurg 2009;110(4):715–24. Stacchiotti S, Marrari A, Tamborini E, Palassini E, Virdis E, Messina A, et al. Response to imatinib plus sirolimus in advanced chordoma. Ann Oncol 2009;20(11):1886–94. Schwab J, Antonescu C, Boland P, Healey J, Rosenberg A, Nielsen P, et al. Combination of PI3K/mTOR inhibition demonstrates efficacy in human chordoma. Anticancer Res 2009;29(6):1867–71. Krause DS, Van Etten RA. Tyrosine kinases as targets for cancer therapy. N Engl J Med 2005;353(2):172–87. Duffaud F, Le Cesne A. Imatinib in the treatment of solid tumours. Target Oncol 2009;4(1):45–56.
75
[354] Casali PG, Stacchiotti S, Sangalli C, Olmi P, Gronchi A. Chordoma. Curr Opin Oncol 2007;19(4):367–70 [Review]. [355] Stacchiotti S, Longhi A, Ferraresi V, Grignani G, Comandone A, Stupp R, et al. Phase II study of imatinib in advanced chordoma. J Clin Oncol 2012;30(9):914–20. [356] Hof H, Welzel T, Debus J. Effectiveness of cetuximab/gefitinib in the therapy of a sacral chordoma. Onkologie 2006;29(12):572–4. [357] Lindén O, Stenberg L, Kjellén E. Regression of cervical spinal cord compression in a patient with chordoma following treatment with cetuximab and gefitinib. Acta Oncol 2009;48(1):158–9. [358] Singhal N, Kotasek D, Parnis FX. Response to erlotinib in a patient with treatment refractory chordoma. Anticancer Drugs 2009;20(10):953–5. [359] Naka T, Iwamoto Y, Shinohara N, Ushijima M, Chuman H, Tsuneyoshi M. Expression of c-met proto-oncogene product (c-MET) in benign and malignant bone tumors. Mod Pathol 1997;10:832–8. [360] Weinberger PM, Yu Z, Kowalski D, Joe J, Manger P, Psyrri A, et al. Differential expression of epidermal growth factor receptor, c-Met, and HER2/neu in chordoma compared with 17 other malignancies. Arch Otolaryngol Head Neck Surg 2005;131(8):707–11. [361] Li Y, Guessous F, Zhang Y, Dipierro C, Kefas B, Johnson E, et al. MicroRNA-34a inhibits glioblastoma growth by targeting multiple oncogenes. Cancer Res 2009;69(19):7569–76 [Epub 2009 Sep 22]. [362] Presneau N, Shalaby A, Idowu B, Gikas P, Cannon SR, Gout I, et al. Potential therapeutic targets for chordoma: PI3K/AKT/TSC1/TSC2/mTOR pathway. Br J Cancer 2009;100(9):1406–14. [363] Han S, Polizzano C, Nielsen GP, Hornicek FJ, Rosenberg AE, Ramesh V. Aberrant hyperactivation of akt and Mammalian target of rapamycin complex 1 signaling in sporadic chordomas. Clin Cancer Res 2009;15(6):1940–6. [364] Faivre S, Kroemer G, Raymond E, et al. Current development of mTOR inhibitors as anticancer agents. Nat Rev Drug Discov 2006;5(8):671–88. [365] Rao RD, Mladek AC, Lamont JD, Goble JM, Erlichman C, James CD, et al. Disruption of parallel and converging signaling pathways contributes to the synergistic antitumor effects of simultaneous mTOR and EGFR inhibition in GBM cells. Neoplasia 2005;7(10):921–9. [366] Goudar RK, Shi Q, Hjelmeland MD, Keir ST, McLendon RE, Wikstrand CJ, et al. Combination therapy of inhibitors of epidermal growth factor receptor/vascular endothelial growth factor receptor 2 (AEE788) and the mammalian target of rapamycin (RAD001) offers improved glioblastoma tumor growth inhibition. Mol Cancer Ther 2005;4(1):101–12. [367] Lal B, Goodwin CR, Sang Y, Foss CA, Cornet K, Muzamil S, et al. EGFRvIII and cMet pathway inhibitors synergize against PTEN-null/EGFRvIII+ glioblastoma xenografts. Mol Cancer Ther 2009;8(7):1751–60. [368] Azzarelli A, Quagliuolo V, Cerasoli S, Zucali R, Bignami P, Mazzaferro V, et al. Chordoma: natural history and treatment results in 33 cases. J Surg Oncol 1988;37(3):185–91. [369] Scimeca PG, James-Herry AG, Black KS, Kahn E, Weinblatt ME. Chemotherapeutic treatment of malignant chordoma in children. J Pediatr Hematol Oncol 1996;18(2):237–40. [370] Al-Rahawan MM, Siebert JD, Mitchell CS, Smith SD. Durable complete response to chemotherapy in an infant with a clival chordoma. Pediatr Blood Cancer 2012;59(2):323–5. [371] Bayrak OF, Aydemir E, Gulluoglu S, Sahin F, Sevli S, Yalvac ME, et al. The effects of chemotherapeutic agents on differentiated chordoma cells. J Neurosurg Spine 2011;15(6):620–4. [372] Guiu S, Guiu B, Feutray S, Chauffert B. Direct intratumoral chemotherapy with carboplatin and epinephrine in a recurrent cervical chordoma: case report. Neurosurgery 2009;65(3):E629–30 [discussion E630]. [373] Guan JY, He XF, Chen Y, Zeng QL, Mei QL, Li YH. Percutaneous intratumoral injection with pingyangmycin lipiodol emulsion for the treatment of recurrent sacrococcygeal chordomas. J Vasc Interv Radiol 2011;22(8):1216–20. [374] Karakousis CP, Park JJ, Fleminger R, Friedman M. Chordomas: diagnosis and management. Am Surg 1981;47(11):497–501. [375] Schönegger K, Gelpi E, Prayer D, Dieckmann K, Matula C, Hassler M, et al. Recurrent and metastatic clivus chordoma: systemic palliative therapy retards disease progression. Anticancer Drugs 2005;16(10):1139–43. [376] Chugh R, Dunn R, Zalupski MM, Biermann JS, Sondak VK, Mace JR, et al. Phase II study of 9-nitro-camptothecin in patients with advanced chordoma or soft tissue sarcoma. J Clin Oncol 2005;23(15):3597–604. [377] Ji Z, Long H, Hu Y, Qiu X, Chen X, Li Z, et al. Expression of MDR1, HIF-1␣ and MRP1 in sacral chordoma and chordoma cell line CM-319. J Exp Clin Cancer Res 2010;29:158. [378] Mirra JM, Nelson SD, Della Rocca C, Mertens F. World Health Organization classification of tumours. In: Mertens F, editor. Pathol Genet Tumours Soft Tissue Bone. 2002. p. 315–7. [379] Tamborini E, Virdis E, Negri T, Orsenigo M, Brich S, Conca E, et al. Analysis of receptor tyrosine kinases (RTKs) and downstream pathways in chordomas. Neuro-oncology 2010;12(8):776–89. [380] Dewaele B, Maggiani F, Floris G, Ampe M, Vanspauwen V, Wozniak A, et al. Frequent activation of EGFR in advanced chordomas. Clin Sarcoma Res 2011;1:4. [381] Shalaby A, Presneau N, Ye H, Halai D, Berisha F, Idowu B, et al. The role of epidermal growth factor receptor in chordoma pathogenesis: a potential therapeutic target. J Pathol 2011;223(3):336–46. [382] Mitsuhashi T, Sasano WM, Ono HM. The expression of insulin like growthfactor 1 (IGF1), IGF1 receptor and transforming growth factor-beta in chordoma. Modern Pathol 2006 [cité 28 déc 2012].
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 76
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
[383] Chung CH, Ely K, McGavran L, Varella-Garcia M, Parker J, Parker N, et al. Increased epidermal growth factor receptor gene copy number is associated with poor prognosis in head and neck squamous cell carcinomas. J Clin Oncol 2006;24(25):4170–6. [384] Nieto Y, Nawaz F, Jones RB, Shpall EJ, Nawaz S. Prognostic significance of overexpression and phosphorylation of epidermal growth factor receptor (EGFR) and the presence of truncated EGFRvIII in locoregionally advanced breast cancer. J Clin Oncol 2007;25(28):4405–13. [385] Selvaggi G, Novello S, Torri V, Leonardo E, De Giuli P, Borasio P, et al. Epidermal growth factor receptor overexpression correlates with a poor prognosis in completely resected non-small-cell lung cancer. Ann Oncol 2004;15(1):28–32. [386] Spano J-P, Lagorce C, Atlan D, Milano G, Domont J, Benamouzig R, et al. Impact of EGFR expression on colorectal cancer patient prognosis and survival. Ann Oncol 2005;16(1):102–8. [387] Schlegel J, Merdes A, Stumm G, Albert FK, Forsting M, Hynes N, et al. Amplification of the epidermal-growth-factor-receptor gene correlates with different growth behaviour in human glioblastoma. Int J Cancer 1994;56(1):72–7. [388] Sommer J, Itani DM, Homlar KC, Keedy VL, Halpern JL, Holt GE, et al. Methylthioadenosine phosphorylase and activated insulin-like growth factor-1 receptor/insulin receptor: potential therapeutic targets in chordoma. J Pathol 2010;220(5):608–17. [389] Rikhof B, De Jong S, Suurmeijer AJH, Meijer C, Van der Graaf WTA. The insulinlike growth factor system and sarcomas. J Pathol 2009;217(4):469–82. [390] Scheipl S, Froehlich EV, Leithner A, Beham A, Quehenberger F, Mokry M, et al. Does insulin-like growth factor 1 receptor (IGF-1R) targeting provide new treatment options for chordomas? A retrospective clinical and immunohistochemical study. Histopathology 2012;60(6):999–1003. [391] Corso S, Comoglio PM, Giordano S. Cancer therapy: can the challenge be MET? Trends Mol Med 2005;11(6):284–92. [392] Kuniyasu H, Yasui W, Yokozaki H, Akagi M, Akama Y, Kitahara K, et al. Frequent loss of heterozygosity of the long arm of chromosome 7 is closely associated with progression of human gastric carcinomas. Int J Cancer 1994;59(5):597–600. [393] Naka T, Boltze C, Samii A, Samii M, Herold C, Ostertag H, et al. Expression of c-MET, low-molecular-weight cytokeratin, matrix metalloproteinases-1 and -2 in spinal chordoma. Histopathology 2009;54(5):607–13. [394] Naka T, Kuester D, Boltze C, Scheil-Bertram S, Samii A, Herold C, et al. Expression of hepatocyte growth factor and c-MET in skull base chordoma. Cancer 2008;112(1):104–10. [395] Burger PC, Makek M, Kleihues P. Tissue polypeptide antigen staining of the chordoma and notochordal remnants. Acta Neuropathol 1986;70(3–4):269–72. [396] Buleje SJ, Yábar BA, Guevara-Fujita M, Fujita R. [Molecular and genetic features of gastrointestinal stromal tumors (gist)]. Rev Gastroenterol Peru 2012;32(4):394–9. [397] Tamborini E, Miselli F, Negri T, Lagonigro MS, Staurengo S, Dagrada GP, et al. Molecular and biochemical analyses of platelet-derived growth factor receptor (PDGFR) B, PDGFRA, and KIT receptors in chordomas. Clin Cancer Res 2006;12(23):6920–8. [398] Demetri GD, Elias AD. Results of single-agent and combination chemotherapy for advanced soft tissue sarcomas. Implications for decision making in the clinic. Hematol Oncol Clin North Am 1995;9(4):765–85. [399] Schmelzle T, Hall MN. TOR a central controller of cell growth. Cell 2000;103(2):253–62. [400] Atkins MB, Hidalgo M, Stadler WM, Logan TF, Dutcher JP, Hudes GR, et al. Randomized phase II study of multiple dose levels of CCI-779, a novel mammalian target of rapamycin kinase inhibitor, in patients with advanced refractory renal cell carcinoma. J Clin Oncol 2004;22(5):909–18. [401] Launay SG, Chetaille B, Medina F, Perrot D, Nazarian S, Guiramand J, et al. Efficacy of epidermal growth factor receptor targeting in advanced chordoma: case report and literature review. BMC Cancer 2011;11(1):423. [402] Rhomberg W, Eiter H, Böhler F, Dertinger S. Combined radiotherapy and razoxane in the treatment of chondrosarcomas and chordomas. Anticancer Res 2006;26(3B):2407–11. [403] Di Maio S, Temkin N, Ramanathan D, Sekhar LN. Current comprehensive management of cranial base chordomas: 10-year meta-analysis of observational studies. J Neurosurg 2011;115(6):1094–105. [404] Nikoghosyan AV, Karapanagiotou-Schenkel I, Münter MW, Jensen AD, Combs SE, Debus J. Randomised trial of proton vs. Carbon ion radiation therapy in patients with chordoma of the skull base, clinical phase III study HIT-1-Study. BMC Cancer 2010;10:607. [405] Jian BJ, Bloch OG, Yang I, Han SJ, Aranda D, Tihan T, et al. Adjuvant radiation therapy and chondroid chordoma subtype are associated with a lower tumor recurrence rate of cranial chordoma. J Neurooncol 2010;98(1):101–8. [406] Jawad MU, Scully SP. Surgery significantly improves survival in patients with chordoma. Spine (Phila Pa 1976) 2010;35(1):117–23. [407] Di Maio S, Rostomily R, Sekhar LN. Current surgical outcomes for cranial base chordomas: cohort study of 95 patients. Neurosurgery 2012;70(6):1355–60 [discussion 1360]. [408] Wu Z, Zhang J, Zhang L, Jia G, Tang J, Wang L, et al. Prognostic factors for longterm outcome of patients with surgical resection of skull base chordomas106 cases review in one institution. Neurosurg Rev 2010;33(4):451–6. [409] Sen C, Triana AI, Berglind N, Godbold J, Shrivastava RK. Clival chordomas: clinical management, results, and complications in 71 patients. J Neurosurg 2010;113(5):1059–71.
[410] Takahashi S, Kawase T, Yoshida K, Hasegawa A, Mizoe JE. Skull base chordomas: efficacy of surgery followed by carbon ion radiotherapy. Acta Neurochir (Wien) 2009;151(7):759–69. [411] Tzortzidis F, Elahi F, Wright D, Natarajan SK, Sekhar LN. Patient outcome at long-term follow-up after aggressive microsurgical resection of cranial base chordomas. Neurosurgery 2006;59(2):230–7 [discussion 230–7]. [412] Pallini R, Maira G, Pierconti F, Falchetti ML, Alvino E, Cimino-Reale G, et al. Chordoma of the skull base: predictors of tumor recurrence. J Neurosurg 2003;98(4):812–22. [413] Jeanrot C, Vinh TS, Anract P, De Pinieux G, Ouaknine M, Forest M, et al. Sacral chordoma: retrospective review of 11 surgically treated cases. Rev Chir Orthop Reparatrice Appar Mot 2000;86(7):684–93. [414] Fuchs B, Dickey ID, Yaszemski MJ, Inwards CY, Sim FH. Operative management of sacral chordoma. J Bone Joint Surg Am 2005;87(10):2211–6. [415] Hsieh PC, Xu R, Sciubba DM, McGirt MJ, Nelson C, Witham TF, et al. Longterm clinical outcomes following en bloc resections for sacral chordomas and chondrosarcomas: a series of twenty consecutive patients. Spine (Phila Pa 1976) 2009;34(20):2233–9. [416] Ruggieri P, Angelini A, Ussia G, Montalti M, Mercuri M. Surgical margins and local control in resection of sacral chordomas. Clin Orthop Relat Res 2010;468(11):2939–47. [417] Clarke MJ, Dasenbrock H, Bydon A, Sciubba DM, McGirt MJ, Hsieh PC, et al. Posterior-only approach for en bloc sacrectomy: clinical outcomes in 36 consecutive patients. Neurosurgery 2012;71(2):357–64, discussion 364. [418] Sciubba DM, Cheng JJ, Petteys RJ, Weber KL, Frassica DA, Gokaslan ZL. Chordoma of the sacrum and vertebral bodies. J Am Acad Orthop Surg 2009;17(11):708–17 [Review]. [419] Moojen WA, Vleggeert-Lankamp CL, Krol AD, Dijkstra SP. Long-term results: adjuvant radiotherapy in en bloc resection of sacrococcygeal chordoma is advisable. Spine (Phila Pa 1976) 2011;36(10):E656–61. [420] Samson IR, Springfield DS, Suit HD, Mankin HJ. Operative treatment of sacrococcygeal chordoma. A review of twenty-one cases. J Bone Joint Surg Am 1993;75(10):1476–84. [421] Biagini R, Ruggieri P, Mercuri M, Capanna R, Briccoli A, Perin S, et al. Neurologic deficit after resection of the sacrum. Chir Organi Mov 1997;82(4):357–72 [Review]. [422] Stener B, Gunterberg B. High amputation of the sacrum for extirpation of tumors. Principles and technique. Spine (Phila Pa 1976) 1978;3(4):351–66. [423] Bommer KK, Ramzy I, Mody D. Fine-needle aspiration biopsy in the diagnosis and management of bone lesions: a study of 450 cases. Cancer 1997;81(3):148–56. [424] McLoughlin GS, Sciubba DM, Suk I, Witham T, Bydon A, Gokaslan ZL, et al. En bloc total sacrectomy performed in a single stage through a posterior approach. Neurosurgery 2008;63(1 Suppl. 1):ONS115–20. [425] Tomita K, Tsuchiya H. Total sacrectomy and reconstruction for huge sacral tumors. Spine (Phila Pa 1976) 1990;15(11):1223–7. [426] Doita M, Harada T, Iguchi T, Sumi M, Sha H, Yoshiya S, et al. Total sacrectomy and reconstruction for sacral tumors. Spine (Phila Pa 1976) 2003;28(15):E296–301. [427] Gallia GL, Haque R, Garonzik I, Witham TF, Khavkin YA, Wolinsky JP, et al. Spinal pelvic reconstruction after total sacrectomy for en bloc resection of a giant sacral chordoma. Technical note. J Neurosurg Spine 2005;3(6): 501–6. [428] Fourney DR, Rhines LD, Hentschel SJ, Skibber JM, Wolinsky JP, Weber KL, et al. En bloc resection of primary sacral tumors: classification of surgical approaches and outcome. J Neurosurg Spine 2005;3(2):111–22. [429] Okaji RY, Silveira Jr JM, Nakano MK, Kiuti LT, Maiorano MC. Sacral chordoma en-bloc resection and lumbar-iliac stabilization. Arq Neuropsiquiatr 2008;66(2B):400–1. [430] Xue-Song L, Chao Y, Kai-Yong Y, Si-Qing H, Heng Z. Surgical excision of extensive sacrococcygeal chordomas assisted by occlusion of the abdominal aorta. J Neurosurg Spine 2010;12(5):490–6. [431] Yang H, Zhu L, Ebraheim NA, Liu J, Shapiro A, Castillo S, et al. Surgical treatment of sacral chordomas combined with transcatheter arterial embolization. J Spinal Disord Tech 2010;23(1):47–52. [432] Yang HL, Chen KW, Wang GL, Lu J, Ji YM, Liu JY, et al. Pre-operative transarterial embolization for treatment of primary sacral tumors. J Clin Neurosci 2010;17(10):1280–5. [433] Stacchiotti S, Casali PG, Lo Vullo S, Mariani L, Palassini E, Mercuri M, et al. Chordoma of the mobile spine and sacrum: a retrospective analysis of a series of patients surgically treated at two referral centers. Ann Surg Oncol 2010;17(1):211–9. [434] Cheng EY, Ozerdemoglu RA, Transfeldt EE, Thompson Jr RC. Lumbosacral chordoma. Prognostic factors and treatment. Spine (Phila Pa 1976) 1999;24(16):1639. [435] Baratti D, Gronchi A, Pennacchioli E, Lozza L, Colecchia M, Fiore M, et al. Chordoma: natural history and results in 28 patients treated at a single institution. Ann Surg Oncol 2003;10(3):291–6. [436] Zhou H, Chen CB, Lan J, Liu C, Liu XG, Jiang L, et al. Differential proteomic profiling of chordomas and analysis of prognostic factors. J Surg Oncol 2010;102(7):720–7. [437] Choi D, Melcher R, Harms J, Crockard A. Outcome of 132 operations in 97 patients with chordomas of the craniocervical junction and upper cervical spine. Neurosurgery 2010;66(1):59–65 [discussion 65]. [438] Carpentier A, Blanquet A, George B. Suboccipital and cervical chordomas: radical resection with vertebral artery control. Neurosurg Focus 2001;10(3).
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
[439] Bjornsson J, Wold LE, Ebersold MJ, Laws ER. Chordoma of the mobile spine. A clinicopathologic analysis of 40 patients. Cancer 1993;71(3):735–40. [440] Sundaresan N, Galicich JH, Chu FC, Huvos AG. Spinal chordomas. J Neurosurg 1979;50(3):312–9. [441] Wang Y, Xiao J, Wu Z, Huang Q, Huang W, Zhu Q, et al. Primary chordomas of the cervical spine: a consecutive series of 14 surgically managed cases. J Neurosurg Spine 2012;17(4):292–9, http://dx.doi.org/10.3171/2012.7.SPINE12175. [442] Barrenechea IJ, Perin NI, Triana A, Lesser J, Costantino P, Sen C. Surgical management of chordomas of the cervical spine. J Neurosurg Spine 2007;6(5):398–406. [443] Klekamp J, Samii M. Spinal chordomas–results of treatment over a 17-year period. Acta Neurochir (Wien) 1996;138(5):514–9. [444] Murali R, Rovit RL, Benjamin MV. Chordoma of the cervical spine. Neurosurgery 1981;9(3):253–6. [445] Boriani S, Bandiera S, Biagini R, Bacchini P, Boriani L, Cappuccio M, et al. Chordoma of the mobile spine: fifty years of experience. Spine (Phila Pa 1976) 2006;31(4):493–503. [446] Fontes R, O’Toole JE. Chordoma of the thoracic spine in an 89-year-old. Eur Spine J 2012;21(Suppl. 4):S428–32, doi:10.1007/s00586-011-1980-6, [Epub 2011 Aug 25]. [447] Wellinger C. Spinal chordoma. I. Review of the literature since 1960. Rev Rhum Mal Osteoartic 1975;42(2):109–16 [Review. French. No abstract available]. [448] Wellinger C. Spinal chordoma. II. Review of the literature since 1960. Rev Rhum Mal Osteoartic 1975;42(3):195–204 [French. No abstract available]. [449] Wellinger C. Spinal chrodoma – III. Review of the literature since 1960. Rev Rhum Mal Osteoartic 1975;42(4):287–95 [French]. [450] Leman P, Cohadon F, Cohadon S. Vertebral chordomas. J Chir (Paris) 1965;89(4):485–500. [451] de Bruïne FT, Kroon HM. Spinal chordoma: radiologic features in 14 cases. AJR Am J Roentgenol 1988;150(4):861–3. [452] Fujita T, Kawahara N, Matsumoto T, Tomita K. Chordoma in the cervical spine managed with en bloc excision. Spine (Phila Pa 1976) 1999;24(17): 1848–51. [453] Mazel CH, Grunenwald D, Laudrin P, Marmorat JL. Radical excision in the management of thoracic and cervicothoracic tumors involving the spine: results in a series of 36 cases. Spine (Phila Pa 1976) 2003;28(8):782–92 [discussion 792. Review]. [454] Rhines LD, Fourney DR, Siadati A, Suk I, Gokaslan ZL. En bloc resection of multilevel cervical chordoma with C-2 involvement. Case report and description of operative technique. J Neurosurg Spine 2005;2(2):199–205. [455] Bailey CS, Fisher CG, Boyd MC, Dvorak MF. En bloc marginal excision of a multilevel cervical chordoma. Case report. J Neurosurg Spine 2006;4(5): 409–14. [456] Leitner Y, Shabat S, Boriani L, Boriani S. En bloc resection of a C4 chordoma: surgical technique. Eur Spine J 2007;16(12):2238–42 [Epub 2007 Aug 23]. [457] Cloyd JM, Chou D, Deviren V, Ames CP. En bloc resection of primary tumors of the cervical spine: report of two cases and systematic review of the literature. Spine J 2009;9(11):928–35 [Epub 2009 Aug 28. Review]. [458] Chou D, Acosta Jr F, Cloyd JM, Ames CP. Parasagittal osteotomy for en bloc resection of multilevel cervical chordomas. J Neurosurg Spine 2009;10(5):397–403. [459] Hsieh PC, Gallia GL, Sciubba DM, Bydon A, Marco RA, Rhines L, et al. En bloc excisions of chordomas in the cervical spine: review of five consecutive cases with more than 4-year follow-up. Spine (Phila Pa 1976) 2011;36(24):E1581–7. [460] Vassal F, Dumas B, Nuti C. Margin-free, en bloc resection of a multilevel cervical chordoma with C-2 involvement: case report with 2-year follow-up and description of operative technique. Br J Neurosurg 2012;26(6):929–31, doi:10.3109/02688697.2012.685785, [Epub 2012 May 21]. [461] Massimiliano V, Giulio M. Six level cervico-thoracic circumferential reconstruction: report of the second case of the literature. Acta Neurochir Suppl 2011;108:187–90. [462] Hsu KY, Zucherman JF, Mortensen N, Johnston JO, Gartland J. Follow-up evaluation of resected lumbar vertebral chordoma over 11 years: a case report. Spine (Phila Pa 1976) 2000;25(19):2537–40. [463] Abe E, Sato K, Tazawa H, Murai H, Okada K, Shimada Y, et al. Total spondylectomy for primary tumor of the thoracolumbar spine. Spinal Cord 2000;38(3):146–52. [464] Bosma JJ, Pigott TJ, Pennie BH, Jaffray DC. En bloc removal of the lower lumbar vertebral body for chordoma. Report of two cases. J Neurosurg 2001;94(Suppl. 2):284–91. [465] Biagini R, Casadei R, Boriani S, Erba F, Sturale C, Mascari C, et al. En bloc vertebrectomy and dural resection for chordoma: a case report. Spine (Phila Pa 1976) 2003;28(18):E368–72. [466] Guo C, Yan Z, Zhang J, Jiang C, Dong J, Jiang X, et al. Modified total en bloc spondylectomy in thoracic vertebra tumour. Eur Spine J 2011;20(4): 655–60. [467] Sivabalan P, Li J, Mobbs RJ. Extensive lumbar chordoma unique reconstructive approach. Eur Spine J 2011;20(Suppl. 2):S336–42 [Epub 2011 Apr 10]. [468] Clarke MJ, Hsu W, Suk I, McCarthy E, Black 3rd JH, Sciubba DM, et al. Threelevel en bloc spondylectomy for chordoma. Neurosurgery 2011;68(2 Suppl. Operative):325–33 [discussion 333]. [469] Wakao N, Imagama S, Ito Z, Ando K, Hirano K, Tauchi R, et al. Total en bloc spondylectomy for L2 chordoma: a case report. Nagoya J Med Sci 2011;73(3–4):197–203.
77
[470] Chadha M, Agarwal A, Wadhwa N. Chondroid chordoma of the L5 spinous process and lamina: a case report. Eur Spine J 2005;14(8):803–6 [Epub 2005 May 14]. [471] Kamal MF, Farah GR, Malkawi HM, Khammash HM. Tumores rari et inusitati. Chordoma in a lumbar vertebral transverse process: a case report and review of the literature. Clin Oncol 1984;10(2):167–72. [472] Enneking WF, Spanier SS, Goodman MA. A system for the surgical staging of musculoskeletal sarcoma. Clin Orthop Relat Res 2003;415:4–18. [473] Buraczewski J, Rudowski W. Chordoma of the thoracic spine appearing as a mediastinal tumor. J Thorac Surg 1957;34:75–84. [474] Levowitz BS, Khan MY, Rand E, Hurwitz A. Thoracic vertebral chordoma presenting as a posterior mediastinal tumor. Ann Thorac Surg 1966;2(1):75–81. [475] Schwarz SS, Fisher 3rd WS, Pulliam MW, Weinstein ZR. Thoracic chordoma in a patient with paraparesis and ivory vertebral body. Neurosurgery 1985;16(1):100–2. [476] Cotler HB, Cotler JM, Cohn HE, Israel HI, Gartland JJ. Intrathoracic chordoma presenting as a posterior superior mediastinal tumor. Spine (Phila Pa 1976) 1983;8(7):781–6. [477] Ahrendt MN, Wesselhoeft CW. Chordoma presenting as a posterior mediastinal mass in a pediatric patient. J Pediatr Surg 1992;27(12):1515–8. [478] Taki S, Kakuda K, Kakuma K, Yamashita R, Kosugi M, Annen Y. Posterior mediastinal chordoma: MR imaging findings. AJR Am J Roentgenol 1996;166(1):26–7. [479] Murphy JM, Wallis F, Toland J, Toner M, Wilson GF. CT and MRI appearances of a thoracic chordoma. Eur Radiol 1998;8(9):1677–9. [480] Topsakal C, Bulut S, Erol FS, Ozercan I, Yildirim H. Chordoma of the thoracic spine–case report. Neurol Med Chir (Tokyo) 2002;42(4):175–80. [481] Delgado R, Bonatelli Ade P, Stávale JN. Thoracic chordoma. Arq Neuropsiquiatr 2008;66(2B):405–7. [482] Wang WL, Abramson JH, Ganguly A, Rosenberg AE. The surgical pathology of notochordal remnants in adult intervertebral disks: a report of 3 cases. Am J Surg Pathol 2008;32(8):1123–9. [483] Cho HY, Lee M, Takei H, Dancer J, Ro JY, Zhai QJ. Immunohistochemical comparison of chordoma with chondrosarcoma, myxopapillary ependymoma, and chordoid meningioma. Appl Immunohistochem Mol Morphol 2009;17(2):131–8. [484] Radl R, Leithner A, Kastner N, Bodo K, Nader A, Windhager R. Disappearance of a cervical spine chordoma after nonoperative treatment. A case report. J Bone Joint Surg Am 2005;87(8):1822–7. [485] Higinbotham NL, Philipps RF, Farr HW, Hutsu HO. Chordoma. Thirty-five years study at Memorial Hospital. Cancer 1967;20:1841–50. [486] Rich TA, Schiller A, Suit HD, Mankin HJ. Clinical and pathologic review of 48 cases of chordoma. Cancer 1985;56(1):182–7. [487] Probst EN, Zanella FE, Vortmeyer AO. Congenital clivus chordoma. AJNR Am J Neuroradiol 1993;14(3):537–9. [488] Sassin JF, Chutorian AM. Intracranial chordoma in children. Arch Neurol 1967;17(1):89–93. [489] Cummings BJ, Hodson DI, Bush RS. Chordoma: the results of megavoltage radiation therapy. Int J Radiat Oncol Biol Phys 1983;9(5):633–42. [490] Proyard G, Dony H. Chordoma of the cervical spine. Acta Chir Belg 1965;64:132–9. [491] Occhipinti E, Mastrostefano R, Pompili A, Carapella CM, Caroli F, Riccio A. Spinal chordomas in infancy. Report of a case and analysis of the literature. Childs Brain 1981;8(3):198–206. [492] Jain SP, Agrawal PK, Jain S, Pandey UC, Samuel KC, Sinha N. Chordoma presenting in the gluteal region in the child. Report of a rare case. Indian J Cancer 1981;18(2):160–2. [493] Tao Z-Z, Chen S-M, Liu J-F, Huang X-L, Zhou L. Paranasal sinuses chordoma in pediatric patient: a case report and literature review. Int J Pediatr Otorhinolaryngol 2005;69(10):1415–8. [494] Berdal P, Myhre E. Cranial chordomas involving the paranasal sinuses. J Laryngol Otol 1964;78:906–19. [495] Yoneoka Y, Tsumanuma I, Fukuda M, Tamura T, Morii K, Tanaka R, et al. Cranial base chordoma – long-term outcome and review of the literature. Acta Neurochir 2008;150(8):773–8. [496] Horton KM, Levey MS, Owl-Smith FA, Azizkhan RG, Schiebler ML. Metastasizing chordoma in early childhood: report of a case at 1,5 T. Magn Reson Imaging 1989;7(6):689–91. [497] Bianchi PM, Marsella P, Masi R, Andriani G, Tucci FM, Partipilo P, et al. Cervical chordoma in childhood: clinical statistical contribution. Int J Pediatr Otorhinolaryngol 1989;18(1):39–45. [498] Jallo J, Nathan D, Bierbrauer K, Farber E. Chordoma: a case report. Surg Neurol 1997;48(1):46–8. [499] Zhou, Hua, Zhongjun Liu, Cuiling Liu, Qingjun Ma, Xiaoguang Liu, et al. Cervical chordoma in childhood without typical vertebral bony destruction: case report and review of the literature. Spine 2009;34(14):E493–7. [500] Clemons RL, Blank RH, Hutcheson JB, Ruffolo EH. Chordoma presenting as a posterior mediastinal mass. A choristoma. J Thorac Cardiovasc Surg 1972;63(6):922–4. [501] Stratt B, Steiner RM. The radiologic findings in posterior mediastinal chordoma. Skeletal Radiol 1980;5(3):171–3. [502] Niida H, Tanaka R, Tamura T, Takeuchi S. Clival chordoma in early childhood without bone involvement. Childs Nerv Syst 1994;10(8):533–5. [503] Kombogiorgas D, St George EJ, Chapman S, English M, Solanki GA. Infantile clivus chordoma without clivus involvement: case report and review of the literature. Childs Nerv Syst 2006;22(10):1369–74.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
[504] Yoneoka Y, Tsumanuma I, Fukuda M, Tamura T, Morii K, Tanaka R, et al. Cranial base Chordoma – long term outcome and review of the literature. Acta Neurochir 2008;150(8):773–8. [505] Matsumoto J, Towbin RB, Ball Jr WS. Cranial chordomas in infancy and childhood. A report of two cases and review of the literature. Pediatric Radiology 1989;20(1–2):28–32. [506] Kaneko Y, Sato Y, Iwaki T, Shin RW, Tateishi J, Fukui M. Chordoma in early childhood: a clinicopathological study. Neurosurgery 1991;29(3):442–6. ˜ [507] Auger M, Raney B, Callender D, Eifel P, Ordónez NG. Metastatic intracranial chordoma in a child with massive pulmonary tumor emboli. Pediatr Pathol 1994;14(5):763–70. [508] Argaud R, Lestrade A. Sur la précocité de certains chordomes sacrococcygiens. Bull Acad Med 1926;95:375–7. [509] Worthy TS. Sacrococcygeal chordoma – two cases with unusual features. Clin Radiol 1965;16(4):412–3. [510] Garofalo E, Minerva A, Baltieri G. Sacrococcygeal chordoma in a 19-month-old boy. Minerva Pediatr 1976;28(31):1909–14. [511] Nakamura Y, Becker LE, Marks A. S100 protein in human chordoma and human and rabbit notochord. Arch Pathol Lab Med 1983;107(3):118–20. [512] Emery JL. Pulmonary embolus in children. Arch Dis Child 1962;37:591–5. [513] Lountzis NI, Hogarty MD, Kim HJ, Junkins-Hopkins JM. Cutaneous metastatic chordoma with concomitant tuberous sclerosis. J Am Acad Dermatol 2006;55(2 Suppl.):S6–10. [514] Schneegans E, Mandigas M. Hydrocephalie non communicante due à un chordome malin. Bull Soc Pediatr 1938;36:535–8. [515] Larson 3rd TC, Houser OW, Laws Jr ER. Imaging of cranial chordomas. Mayo clinic proceedings. Mayo Clinic 1987;62(10):886–93. [516] Nolte K. Malignant intracranial chordoma and sarcoma of the clivus in infancy. Pediatr Radiol 1979;8(1):1–6. [517] Richards AT, Stricke L, Spitz L. Sacrococcygeal chordomas in children. J Pediatr Surg 1973;8(6):911–4. [518] Cable DG, Moir C. Pediatric sacrococcygeal chordomas: a rare tumor to be differentiated from sacrococcygeal teratoma. J Pediatr Surg 1997;32(5):759–61. [519] Al-Adra D, Bennett A, Gill R, Lees G. Pediatric metastatic sacrococcygeal chordoma treated with surgery. Eur J Pediatr Surg 2011;21(3):196–8. [520] Kozlowski K, Barylak A, Campbell J, Hoeffel JD, Beluffi G, Masel J, et al. Primary sacral bone tumours in children (report of 16 cases with a short literature review). Australas Radiol 1990;34(2):142–9. [521] Shinmura Y, Katsutoshi M, Shuhei Y, Yoshihiro T. Sacrococcygeal chordoma in infancy showing an aggressive clinical course: an autopsy case report. Pathol Int 2003;53(7):473–7. [522] Ellis VH. Notochordal tumor of cauda equina in a child of 8 years. Br J Surg 1935;23:25–30. [523] Congdon CC. Benign and malignant chordomas; a clinico-anatomical study of twenty-two cases. Am J Pathol 1952;28(5):793–821. [524] Choi, Gwi Hyun, Moon-Sool Yang, Do Heum Yoon, Hyun Chyul Shin, Keung Nyun Kim, et al. Pediatric cervical chordoma: report of two cases and a review of the current literature. Child’s Nervous System 2010;26(6):835–40. [525] Windeyer BW. Chordoma. Proc Royal Soc Med 1959;52:1088–100. [526] Killampalli VV, Dominic P, Alistair JS. Preadolescent presentation of a lumbar chordoma: results of vertebrectomy and fibula strut graft reconstruction at 8 years. Eur Spine J 2006;15(Suppl. 5):621–5. [527] Rosenqvist H, Saltzman GF. Sacrococcygeal and vertebral chordomas and their treatment. Acta Radiol 1959;52:177–93. [528] Brooks JJ, LiVolsi VA, Trojanowski JQ. Does chondroid chordoma exist? Acta Neuropathologica 1987;72(3):229–35. [529] Amendola BE, Amendola MA, Oliver E, McClatchey KD. Chordoma: role of radiation therapy. Radiology 1986;158(3):839–43. [530] Taylor RE, Eldridge PR, Errington RD, Jones B, Punt J, Spooner D. Proton therapy for base of skull chordoma: a report of the Royal College of Radiologists. Clin Oncol 2000;12:75–9. [531] Menezes AH. Craniovertebral junction neoplasms in the pediatric population. Childs Nerv Syst 2008;24(10):1173–86. [532] Krayenbühl H, Yasargil MG. Cranial chordomas. Prog Neurol Surg 1975;6:380. [533] Tewfik HH, McGinnis WL, Nordstrom DG, Latourette HB. Chordoma: evaluation of clinical behavior and treatment modalities. Int J Radiat Oncol Biol Phys 1977;2(9–10):959–62. [534] Reddy EK, Mansfield CM, Hartman GV. Chordoma. Int J Radiat Oncol Biol Phys 1981;7(12):1709–11. [535] Habrand JL, Bondiau PY, Dupuis O, Lévy-Piedbois C, Marin JL, Oberlin O. Late effects of radiotherapy in children. Cancer Radiother 1997;1(6):810–6. [536] Habrand JL, Bolle S, Datchary J, Alapetite C, Petras S, Helfre S, et al. Proton beam therapy in pediatric radiotherapy. Cancer radiothérapie 2009;13(6–7):550–5. [537] O’Connell JX, Renard LG, Liebsch NJ, Efird JT, Munzenrider JE, Rosenberg AE. Base of skull chordoma. A correlative study of histologic and clinical features of 62 cases. Cancer 1994;74(8):2261–7. [538] Mitchell A, Scheithauer BW, Unni KK, Forsyth PJ, Wold LE, McGivney DJ. Chordoma and chondroid neoplasms of the spheno-occiput. An immunohistochemical study of 41 cases with prognostic and nosologic implications. Cancer 1993;72(10):2943–9. [539] Nielsen GP, Rosenberg AE, Liebsch NJ. Chordomas of the base of skull in children and adolescents: a clinicopathologic study of 35 cases. Mod Pathol 1996;9(11A).
[540] Brooks M, Kleefield J, O’Reilly GV, Haykal HA, MacLeod M. Thoracic chordoma with unusual radiographic features. Comput Radiol 1987;11(2):85–90. [541] Dhall G, Traverso M, Finlay JL, Shane L, Gonzalez-Gomez I, Jubran R. The role of chemotherapy in pediatric clival chordomas. J Neurooncol 2011;103(3):657–62. [542] Nix WL, Steuber CP, Hawkins EP, Stenback WA, Pokorny WJ, Fernbach DJ. Sacrococcygeal chordoma in a neonate with multiple anomalies. J Pediatr 1978;93(6):995–8. [543] Yadav YR, Kak VK, Khosla VK, Khandelwal N, Radotra BD. Cranial chordoma in the first decade. Clin Neurol Neurosurg 1992;94(3):241–6. [544] Sen CN, Sekhar LN, Schramm VL, Janecka IP. Chordoma and chondrosarcoma of the cranial base: an 8-year experience. Neurosurgery 1989;25(6):931–40. [545] Derome PJ, Visot A, Monteil JP, Maestro JL. Management of cranial chordomas in tumors of the cranial base. Diagnosis and treatment. New-York: Futura; 1987. p. 607–22. [549] Boriani S, Weinstein JN, Biagini R. Primary bone tumors of the spine. Terminology and surgical staging. Spine (Phila Pa 1976) 1997;22(9):1036–44 [Review]. [550] Casali PG. Adding cisplatin (CDDP) to imatinib (IM) re-establishes tumor response following secondary resistance to IM in advanced chordoma; 2012. Casali et al., 25 (18 Supplement): 10038 – ASCO Meeting Abstracts [Internet]. Disponible sur: http://meeting.ascopubs.org/cgi/content/abstract/25/ 18 suppl/10038 [551] De Comas AM, Deavers MT, Raymond AK, Madewell JE, Lewis VO. Intraneural parachordoma of the arm with regional metastases. Skeletal Radiol 2011;40(7):943–6. [560] Makek M, Leu HJ. Malignant fibrous histiocytoma arising in a recurrent chordoma: case report and electron microscopic findings. Virchows Arch A Pathol Anat Histol 1982;397(3):241–50. [565] Virchow R. Untersuchungen ueber die Entwicklung des Schaedelgrundes im gesunden und krankhaften Zustande und uber den Einfluss derselben auf Schadelform, Gesichtsbildung und Gehirnban. Berlin: G. Reimer; 1857. p. 47. [566] Zarghouni M, Vandergriff C, Layton KF, Mcgowan JB, Coimbra C, Bhakti A, et al. Chordoid glioma of the third ventricle. Proc (Bayl Univ Med Cent) 2012;25(3):285–6. [567] Buckingham M, Bajard L, Chang T, Daubas P, Hadchouel J, Meilhac S, et al. The formation of skeletal muscle: from somite to limb. J Anat 2003;202:59–68. [568] Lalam R, Cassar-Pullicino VN, McClure J, Singh J. Entrapped intralesional marrow: a hitherto undescribed imaging feature of benign notochordal cell tumour. Skeletal Radiol 2012;41:B725–31. [569] Barry JJ, Jian BJ, Sughrue ME, Kane AJ, Mills SA, Tihan T, et al. The next step: innovative molecular targeted therapies for treatment of intracranial chordoma patients. Neurosurgery 2011;68(1):231–40 [discussion 240–1. Review]. [570] Trikha V, Gupta V, Kumar R. Increased uptake in Tc-99m MDP scan of sacral chordoma: an unusual presentation. Clin Nucl Med 2004;29(9):562–3. [571] Rossleigh MA, Smith J, Yeh SD. Scintigraphic features of primary sacral tumors. J Nucl Med 1986;27(5):627–30. [572] Origitano TC, Karesh SM, Henkin RE, Halama JR, Reichman OH. Photodynamic therapy for intracranial neoplasms: investigations of photosensitizer uptake and distribution using indium-111 Photofrin-II single photon emission computed tomography scans in humans with intracranial neoplasms. Neurosurgery 1993;32(3):357–63 [discussion 363–4]. [573] Di Girolamo S, Ottaviani F, Floris R, Bruno E, Napolitano B, Schillaci O. Indium111 pentetreotide single photon emission computed tomography (In111 pentetreotide SPECT): a new technique to evaluate somatostatin receptors in chordomas. J Laryngol Otol 2005;119(5):405–8. [574] Higuchi T, Taki J, Sumiya H, Kinuya S, Bunko H, Nonomura A, et al. Intense 201 Tl uptake in giant-cell tumour of bone. Nucl Med Commun 2002;23(6):595–9. [575] Suga K, Tanaka N, Nakanishi T, Utsumi H, Yamada N. Bone and gallium scintigraphy in sacral chordoma. Report of four cases. Clin Nucl Med 1992;17(3):206–12. [576] Miyazawa N, Ishigame K, Kato S, Satoh Y, Shinohara T. Thoracic chordoma: review and role of FDG-PET. J Neurosurg Sci 2008;52(4):117–21. [577] Park SA, Kim HS. F-18 FDG PET/CT evaluation of sacrococcygeal chordoma. Clin Nucl Med 2008;33(12):906–8. [578] Ferraresi V, Nuzzo C, Zoccali C, Marandino F, Vidiri A, Salducca N, et al. Chordoma: clinical characteristics, management and prognosis of a case series of 25 patients. BMC Cancer 2010;10:22, http://dx.doi.org/10.1186/1471-2407-10-22. [579] Zhang H, Yoshikawa K, Tamura K, Sagou K, Tian M, Suhara T, et al. Carbon11-methionine positron emission tomography imaging of chordoma. Skeletal Radiol 2004;33(9):524–30. [580] Mammar H, Kerrou K, Nataf V, Pontvert D, Clemenceau S, Lot G, et al. Positron emission tomography/computed tomography imaging of residual skull base chordoma before radiotherapy using fluoromisonidazole and fluorodeoxyglucose: potential consequences for dose painting. Int J Radiat Oncol Biol Phys 2012;84(3):681–7. [581] Jackson RJ, Gokaslan ZL. Spinal-pelvic fixation in patients with lumbosacral neoplasms. J Neurosurg 2000;92(1 Suppl):61–70.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
Neurochirurgie xxx (2014) xxx–xxx
Disponible en ligne sur
ScienceDirect www.sciencedirect.com
Rapport 2013 : Les chordomes
Les chordomes Chordoma B. George a,∗ , D. Bresson a , S. Bouazza a , S. Froelich a , E. Mandonnet a , S. Hamdi a , M. Orabi a , M. Polivka b , A. Cazorla b , H. Adle-Biassette b , J.-P. Guichard c , M. Duet d , E. Gayat e , F. Vallée e , C.-H. Canova f , F. Riet f , S. Bolle f , V. Calugaru f , R. Dendale f , J.-J. Mazeron f , L. Feuvret f , E. Boissier f , S. Vignot f , S. Puget g , C. Sainte-Rose g , K. Beccaria g a
Service de neurochirurgie, hôpital Lariboisière, 2, rue Ambroise-Paré, 75010 Paris, France Service d’anatomopathologie, hôpital Lariboisière, 2, rue Ambroise-Paré, 75010 Paris, France c Service de neuroradiologie, hôpital Lariboisière, 2, rue Ambroise-Paré, 75010 Paris, France d Service de médecine nucléaire, hôpital Lariboisière, 2, rue Ambroise-Paré, 75010 Paris, France e Service d’anesthésie-réanimation, hôpital Lariboisière, 2, rue Ambroise-Paré, 75010 Paris, France f Service de radiothérapie et d’oncologie médicale, hôpital de la Salpêtrière, institut Gustave-Roussy, institut Curie, 47-83, boulevard de l’Hôpital, 75013 Paris, France g Service de neurochirurgie, hôpital Necker, 149, rue de Sèvres, 75015 Paris, France b
i n f o
a r t i c l e
Historique de l’article : Rec¸u le 3 juillet 2013 Rec¸u sous la forme révisée ´ 2014 le 14 fevrier Accepté le 11 mars 2014 Disponible sur Internet le xxx Keywords: Chordoma Skull base Mobile spine Diagnosis Prognosis
a b s t r a c t Purposes. – To review in the literature, all the epidemiological, clinical, radiological, histological and therapeutic data regarding chordomas as well as various notochordal entities: ecchordosis physaliphora, intradural and intraparenchymatous chordomas, benign notochordal cell tumors, parachordomas and extra-axial chordomas. To identify different types of chordomas, including familial forms, associations with tuberous sclerosis, Ollier’s disease and Maffucci’s syndrome, forms with metastasis and seeding. To assess the recent data regarding molecular biology and progress in targeted therapy. To compare the different types of radiotherapy, especially protontherapy and their therapeutic effects. To review the largest series of chordomas in their different localizations (skull base, sacrum and mobile spine) from the literature. Materials. – The series of 136 chordomas treated and followed up over 20 years (1972–2012) in the department of neurosurgery at Lariboisière hospital is reviewed. It includes: 58 chordomas of the skull base, 47 of the craniocervical junction, 23 of the cervical spine and 8 from the lombosacral region. Similarly, 31 chordomas in children (less than 18 years of age), observed in the departments of neurosurgery of les Enfants-Malades and Lariboisière hospitals, are presented. They were observed between 1976 and 2010 and were located intracranially (n = 22 including 13 with cervical extension), 4 at the craniocervical junction level and 5 in the cervical spine. Methods. – In the entire Lariboisière series and in the different groups of localization, different parameters were analyzed: the delay of diagnosis, of follow-up, of occurrence of metastasis, recurrence and death, the number of primary patients and patients referred to us after progression or recurrence and the number of deaths, recurrences and metastases. The influence of the quality of resection (total, subtotal and partial) on the prognosis is also presented. Kaplan-Meier actuarial curves of overall survival and disease free survival were performed in the entire series, including the different groups of localization based on the following 4 parameters: age, primary and secondary patients, quality of resection and protontherapy. In the pediatric series, a similar analysis was carried-out but was limited by the small number of patients in the subgroups. Results. – In the Lariboisière series, the mean delay of diagnosis is 10 months and the mean follow-up is 80 months in each group. The delay before recurrence, metastasis and death is always better for the skull base chordomas and worse for those of the craniocervical junction, which have similar results to those of the cervical spine. Similar figures were observed as regards the number of deaths, metastases and recurrences. Quality of resection is the major factor of prognosis with 20.5 % of deaths and 28 % of recurrences after total resection as compared to 52.5 % and 47.5 % after subtotal resection. This is still more
∗ Auteur correspondant. Adresse e-mail : [email protected] (B. George). http://dx.doi.org/10.1016/j.neuchi.2014.02.003 0028-3770/© 2014 Elsevier Masson SAS. Tous droits réservés.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
2
obvious in the group of skull base chordomas. Adding protontherapy to a total resection can still improve the results but there is no change after subtotal resection. The actuarial curve of overall survival shows a clear cut in the slope with some chordomas having a fast evolution towards recurrence and death in less than 4 years and others having a long survival of sometimes more than 20 years. Also, age has no influence on the prognosis. In primary patients, disease free survival is better than in secondary patients but not in overall survival. Protontherapy only improves the overall survival in the entire series and in the skull base group. Total resection improves both the overall and disease free survival in each group. Finally, the adjunct of protontherapy after total resection is clearly demonstrated. In the pediatric series, the median follow-up is 5.7 years. Overall survival and disease free survival are respectively 63 % and 54.3 %. Factors of prognosis are the histological type (atypical forms), localization (worse for the cervical spine and better for the clivus) and again it will depend on the quality of resection. Conclusions. – Many different pathologies derived from the notochord can be observed: some are remnants, some may be precursors of chordomas and some have similar features but are probably not genuine chordomas. To-day, immuno-histological studies should permit to differentiate them from real chordomas. Improving knowledge of molecular biology raises hopes for complementary treatments but to date the quality of surgical resection is still the main factor of prognosis. Complementary protontherapy seems useful, especially in skull base chordomas, which have better overall results than those of the craniocervical junction and of the cervical spine. However, we are still lacking an intrinsic marker of evolution to differentiate the slow growing chordomas with an indolent evolution from aggressive types leading rapidly to recurrence and death on which more aggressive treatments should be applied. © 2014 Elsevier Masson SAS. All rights reserved.
r é s u m é Mots clés : Chordome Base du crâne Rachis Diagnostic Pronostic
Objectifs. – Faire une revue de littérature de toutes les données épidémiologiques, cliniques, radiologiques, anatomopathologiques et thérapeutiques concernant les chordomes et les différentes entités notochordales décrites : ecchordosis physaliphora, chordomes intraduraux et intraparenchymateux, tumeurs bénignes à cellule notochordale, parachordomes et chordomes extra-axiaux. Identifier les différentes formes de chordomes, en particulier les formes familiales, les formes associées à la sclérose tubéreuse de Bourneville, à la maladie d’Ollier et au syndrome de Maffucci, les formes métastatiques, les formes avec essaimage. Analyser les nouvelles données de biologie moléculaire et leurs applications thérapeutiques. Comparer les différentes formes de radiothérapie complémentaire, notamment la protonthérapie et leurs intérêts thérapeutiques. Analyser les grandes séries de chordomes de la littérature selon les différentes localisations de chordomes (base du crâne, sacrum et rachis mobile). Matériel. – La série de 136 chordomes traités et suivis dans le service de neurochirurgie de l’hôpital Lariboisière sur les 20 dernières années (1992–2012) est présentée. Elle comprend 58 patients ayant un chordome localisé à la base du crâne, 47 à la charnière craniocervicale, 23 sur le rachis cervical et 8 au niveau lombosacré. La série de chordomes observés dans la population pédiatrique (moins de 18 ans) des services de neurochirurgie de l’hôpital des Enfants-Malades et Lariboisière sur une période de 34 ans (1976–2010) inclut 31 enfants dont 22 localisations crâniennes dont 13 étendues au rachis cervical, 4 au niveau de la charnière craniocervicale et 5 au niveau cervical. Méthodes. – Pour la série Lariboisière, ont été analysés sur l’ensemble de la série et sur les différents groupes de localisation, les délais moyens de diagnostic, de suivi, de survenue de décès, de récidive et de métastase ainsi que le nombre de patients pris en charge initialement ou secondairement (après récidive ou progression), le nombre de décès, de récidives et de métastases. L’influence sur ces paramètres, de la qualité de l’exérèse, selon qu’elle a été initialement totale, subtotale ou partielle, est présentée. Des courbes actuarielles de Kaplan-Meier de survie globale et sans progression ont été établies sur l’ensemble de la série et les différentes localisations, de fac¸on globale et en fonction de différents paramètres : l’âge, la prise en charge primaire ou secondaire, la qualité de l’exérèse, le traitement par protonthérapie. Pour la série pédiatrique, une analyse similaire a été effectuée, avec cependant des limites liées aux petits effectifs dès que l’on subdivise la série. Résultats. – Pour la série Lariboisière, le délai diagnostic moyen est de 10 mois et le suivi moyen de 80 mois dans les différentes localisations. Le délai sans progression, de survenue de métastase, de récidive et de décès est toujours meilleur pour les chordomes de la base du crâne; ceux de la charnière craniocervicale sont moins bons et se comparent plus volontiers à ceux du rachis cervical. Il en est de même pour le nombre de décès, de métastases et de récidives. La qualité de l’exérèse est un élément majeur du pronostic avec 20,5 % de décès et 28 % de récidive après exérèse totale contre 52,5 % et 47,5 % après exérèse subtotale. Ceci est encore plus net dans le groupe des chordomes de la base du crâne. L’adjonction d’une protonthérapie améliore les résultats après exérèse complète mais ne change rien si l’exérèse a été subtotale. En courbe actuarielle, la survie globale indique deux groupes de patients : certains ayant une évolution rapide avec récidive et décès avant 4 ans et d’autres ayant une survie prolongée, parfois au-delà de 20 ans. L’âge n’a aucune influence sur le pronostic. La prise en charge primaire améliore la survie sans progression mais pas la survie globale. La protonthérapie n’améliore que la survie globale pour l’ensemble de la série et pour les chordomes de la base. La résection complète améliore la survie globale et sans progression dans tous les groupes. Enfin, l’intérêt d’associer résection complète et protonthérapie apparaît clairement. Dans la série pédiatrique, le suivi médian est de 5,7 ans. La survie globale et sans progression à 15 ans est respectivement de 63 et 54,3 %. Les facteurs de mauvais pronostic observés sont le type histologique (formes atypiques), la localisation (meilleure pour le clivus, moins bonne pour le rachis) et là encore la qualité de l’exérèse.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
3
Conclusions. – Il existe de nombreuses entités dérivés de la notochorde ; certaines sont des vestiges ; d’autres possiblement des précurseurs des chordomes ; et d’autres encore des tumeurs apparentées mais probablement différentes des véritables chordomes. Les données immuno-histologiques devraient aujourd’hui permettent de les différencier. Les connaissances en biologie moléculaire font naître des espoirs de traitements complémentaires efficaces mais pour l’instant la qualité de l’exérèse reste le meilleur facteur de pronostic. La protonthérapie complémentaire semble améliorer les résultats en particulier pour les chordomes de la base du crâne dont le pronostic paraît moins sévère que celui des chordomes de la charnière craniocervicale et du rachis cervical. Enfin, il manque toujours un paramètre intrinsèque qui permettrait de différencier les chordomes d’évolution lente de ceux évoluant et récidivant rapidement et pour lesquels une attitude agressive serait particulièrement justifiée. © 2014 Elsevier Masson SAS. Tous droits réservés.
1. Introduction Le chordome est une entité pathologique très particulière. C’est une tumeur plutôt rare, développée à partir de vestiges embryonnaires et qui le plus souvent ne comporte pas de caractéristiques de malignité sur le plan histologique. Et pourtant, son histoire naturelle et son évolution sous traitement s’apparentent beaucoup à celles d’une tumeur à malignité locale. Le chordome a trois localisations principales : le sacrum, le rachis cervical et la base du crâne. Chacune de ces localisations pose des problèmes sur le plan chirurgical ; problème d’accès pour certaines d’entre elles mais surtout problème de résection complète du fait de l’extension tumorale. La chirurgie reste pourtant la modalité thérapeutique essentielle. La résection complète est le seul élément de bon pronostic non controversé. Néanmoins, l’adjonction d’une irradiation à doses élevées, utilisant des techniques particulières préservant les structures fonctionnelles présente un grand intérêt dans la prise en charge des chordomes. Le traitement médical est une modalité en devenir. Les progrès de la biologie moléculaire concernant l’origine et la croissance tumorale permettent d’envisager une efficacité prochaine des thérapies dites « ciblées » sur les chordomes. À ce jour, ont été rapportés que des traitements palliatifs ou des essais thérapeutiques sur de courtes séries sans que rien de vraiment probant n’ait encore été démontré. En liaison avec le développement de la biologie moléculaire, des études génétiques ont commencé à apparaître, rapportant des altérations de gènes impliquant des perturbations biologiques conduisant à la formation et à la croissance de cette tumeur. Le chordome nécessite donc d’ouvrir de nombreuses portes pour en comprendre les différents aspects ; des plus classiques : clinique, radiologique, chirurgical, à d’autres plus étonnants pour une tumeur bénigne : radiothérapie, chimiothérapie et jusqu’à certaines données fondamentales d’embryologie, de biologie moléculaire et de génétique. C’est ce que ce rapport va essayer d’entreprendre, en sachant qu’il correspond aux données acquises à ce jour, sans doute, on l’espère, rapidement dépassées pour certaines dans quelques années. 2. Historique Il semble que ce soit Luschka qui, le premier en 1856, ait découvert de petites protrusions « comme de la gelée » (jelly-like), dans le crâne au niveau du clivus de Blumenbach [1]. Virchow, la même année, en fit une description et les dénomma : « ecchondrosis physaliphora ». En fait, il choisit ce terme car il pensait que ces protrusions étaient d’origine cartilagineuse à partir de la synchondrose sphénooccipitale. En 1858, Muller émit l’idée que ces excroissances pouvaient être non pas d’origine cartilagineuse, mais dérivées de la notochorde. Pour avancer cela, il avait comparé des coupes histologiques de chordomes à celles de notochorde d’embryons humains, en assimilant la synchondrose sphéno-occipitale à un disque intervertébral
que l’on supposait être un vestige notochordal (Fig. 1). En fait, son idée fut ignorée pendant de nombreuses années et c’est l’appellation de Virchow [565] qui resta généralement acceptée jusqu’en 1895, date à laquelle Ribbert établit clairement l’origine notochordale de ces tumeurs auxquelles il donna le nom de chordomes. Ensuite, dans de nombreuses publications, une comparaison entre chordome, entité pathologique tumorale à malignité locale, tumeurs bénignes à cellules notochordales, vestiges notochordaux et nucleus pulposus des disques intervertébraux supposé être le seul résidu de la notochorde primitive a été faite. Parallèlement, des cas cliniques de plus en plus nombreux ont été publiés. Le premier chordome localisé dans la région nasopharyngée a été opéré en 1864 par Klebs [2] ; le premier chordome cervical en 1904 par Linck [3] et le premier chordome sacrococcygien en 1922 par Stewart [4]. À cette date, seulement 22 cas de chordomes, toutes localisations confondues, avaient été publiés. L’un d’entre eux, un chordome nasopharyngien chez un garc¸on de 16 ans, avait nécessité deux interventions pour assurer son exérèse avec un résultat remarquable puisqu’on indique qu’il n’y a eu aucune morbidité postopératoire ni récidive. Néanmoins, le délai de suivi n’a pas été indiqué [5]. En 1935, une revue de littérature fait état de 150 cas publiés (Mabrey [6]) ; Harvey et Dawson [7] en colligent 240 en 1941 ; Faust et al. [8] 250 en 1944 ; enfin Utne et Pugh [9] en rassemblent 505 en 1955. 3. Embryologie Depuis Muller en 1858, les chordomes sont rattachés à leur origine notochordale. Même si initialement, ils ont été considérés comme d’origine cartilagineuse et que la confusion a persisté longtemps entre chondrosarcomes et chordomes, aujourd’hui la différence est clairement établie [10]. La notochorde est un élément en forme de tige qui définit l’axe primitif de l’embryon. Sur le plan phylogénétique, c’est un élément commun retrouvé chez toutes les espèces supérieures du monde animal à partir de l’Amphioxus. Pour cette espèce, la notochorde est le seul élément axial. Chez les autres espèces du groupe des chordés, la notochorde est remplacée par un squelette osseux qui devient la colonne vertébrale et une partie de la base du crâne. Cependant, une partie de la notochorde va pouvoir persister sous forme de vestiges. La notochorde se forme dès la 3e semaine de la vie embryonnaire à partir du nœud de Hensen. Initialement, l’embryon est un disque ovale à grand axe antéropostérieur avec deux couches cellulaires : l’ectoblaste et l’endoblaste. À partir de l’ectoblaste des cellules migrent vers la ligne médiane et s’y regroupent, formant la ligne primitive dont l’épaississement antérieur est le nœud de Hensen. De cette ligne primitive, les cellules s’enfoncent en profondeur puis s’étalent latéralement pour former une troisième couche : le mésoblaste. À partir du nœud de Hensen, donc en avant, des cellules s’invaginent en doigt de gant sur la ligne médiane. Le nœud de
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 4
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 1. Article de 1894 sur l’ecchordosis physaliphora sphéno-occipitalis et la photographie du Pr Virchow. Article published in 1894 on the ecchordosis physaliphora sphenoocipitalis with Pr Virchow’s picture.
Hensen recule alors vers l’extrémité caudale au fur et à mesure que ce prolongement céphalique se forme et devient le canal chordal puis la plaque chordale et enfin la notochorde (au 20e jour). En fait, c’est un cordon continu et plein situé sur la ligne médiane entre les deux parties latérales du mésoblaste (Fig. 2). Le mésoblaste s’organise et se segmente d’avant en arrière devenant les somites avec trois parties (4e semaine, diamètre de 7 mm) ; de dehors en dedans et de la surface vers la profondeur, on distingue les dermatomes, les myotomes et les sclérotomes. C’est à ce stade que les cellules de la notochorde deviennent des cellules volumineuses et vacuolées remplies d’une substance mucoïde comparables aux cellules physaliphores caractéristiques des chordomes.
Fig. 2. Mise place chez l’embryon de la notochorde au milieu du mésoderme et entre ectoderme et endoderme. Scheme of the embryo with the notochord inside the mesoderm and between ectoderm and endoderm.
Au-dessus de la notochorde et du mésoblaste, l’ectoblaste devient le neuroectoderme dont une partie va devenir le tube neural. En dessous, l’entoblaste va s’organiser pour former le tube digestif (Fig. 3). Les sclérotomes de chaque côté de la notochorde vont se rejoindre au-dessus et en dessous de la chorde pour constituer les vertèbres (Fig. 4). Progressivement, la chorde va présenter des renflements correspondant aux disques et des rétrécissements au niveau des corps vertébraux. On observe une énorme dilatation au niveau de la région lombosacrée (Fig. 5). La chorde s’étend alors depuis l’ébauche du sacrococcyx jusqu’à la poche de Rathke sous l’hypophyse. Elle passe donc à travers les corps vertébraux jusqu’à la pointe de l’odontoïde, le corps de l’atlas et enfin la partie inférieure du clivus ; puis elle traverse d’arrière en avant le basi-occiput pour se retrouver derrière le pharynx primitif ; elle entre à nouveau dans le basi-occiput pour finir dans la paroi osseuse derrière la posthypophyse. À partir de la 15e semaine, les îlots de notochorde dégénèrent pour disparaître au fur et à mesure de l’ossification des corps vertébraux. Cette involution des cellules chordales, commencée à la 6e semaine, va se poursuivre longtemps puisqu’on peut retrouver des cellules chordales jusque pendant la deuxième décennie de la vie. On en trouve à la base du crâne et dans les corps vertébraux. Selon les données autopsiques, il persisterait même des vestiges notochordaux chez 2 à 5 % des individus, essentiellement au niveau du renflement sacrococcygien (60 % des cas environ) et dans la région sphéno-occipitale (30 à 35 % des cas). On a retrouvé également, mais très rarement, sur des radiographies (tomographies) un canal radio transparent traversant une vertèbre verticalement comme le faisait la notochorde embryonnaire [11–14]. Schmorl [15] a observé aussi 8 fois (7 thoraciques et 1 lombaire) sur 5000 autopsies, un vestige de petit volume dans un corps vertébral.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
5
Fig. 3. A. Différenciation de l’ectoderme en plaque neurale. B. Formation du tube neural et différentiation des crêtes neurales. C. Séparation des crêtes neurales du neuroectoderme de part et d’autre du tube neural. La notochorde se situe en arrière du tube neural. A. Differentiation of the ectoderm to the neural plaque. B. Formation of the neural tube and separation of neural crests. C. Neural crests appear on both sides of the neural tube. The notochord is located behind the neural tube.
La persistance de vestiges aux deux extrémités de la notochorde embryonnaire a pu être expliquée par les remaniements importants qui s’y produisent ; notamment la disparition de plusieurs segments entiers du renflement de l’extrémité caudale. On peut mettre en parallèle les nombreuses anomalies et tumeurs tératoïdes observées à ce niveau. À l’extrémité céphalique, les 3 premiers myotomes donnent les muscles de la langue, et les
sclérotomes la lame basilaire (basi- occiput et basi-sphénoïde) ; de nombreux remaniements s’opèrent avec la plicature du tube neural expliquant la possibilité de fragments résiduels détachés de la notochorde désintégrée. On ne retrouve pas la même intensité de modifications sur le rachis mobile, ce qui pourrait expliquer la moindre fréquence des vestiges notochordaux et donc la rareté des chordomes à ce niveau.
Fig. 4. Différentiation des somites en dermatomes, myotomes, sclérotomes (de la superficie vers la profondeur) de chaque côté du tube neural. Le sclérotomes s’organisent autour du tube neural pour former les vertèbres. Differentiation of the somites into dermatomes, myotomes and sclerotomes (from surface to depth) on both sides of the neural tube. Sclerotomes are going to move around the neural tube to form the vertebrae. D’après Buckingham et al. [567] ; publié avec l’autorisation de Wiley Blackwell.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 6
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 5. La notochorde involue en ne formant plus qu’un fin cordon au niveau des vertèbres mais avec un épaississement persistant au niveau des disques (B). Il persiste parfois après la naissance le stigmate de ce cordon dans les vertèbres (A). The notochord disappears and finally is made only of a string, small inside the vertebrae and thicker at the level of the discs (B). This string is sometimes persisting inside the vertebrae after birth (A). D’après Taylor [12] (A) ; (A) et (B) publiés avec l’autorisation de Wiley Blackwell.
Il faut aborder la question controversée du nucleus pulposus. Il est considéré par beaucoup comme étant le seul reste de la notochorde après la naissance, et pourtant il ne serait pas le point d’origine des chordomes rachidiens. En effet, les chordomes se développent à partir des corps vertébraux et non des disques. Le plus souvent, une seule vertèbre est envahie par le chordome ; lorsque plusieurs le sont, les disques intermédiaires sont en général respectés. Cela avait déjà été remarqué par Horowitz en 1941 [16]. Pourtant, on retrouve beaucoup de similarités sur le plan histologique, y compris en microscopie électronique [17] entre la structure du nucleus pulposus et celle du chordome. Il existerait toutefois des différences au niveau de la biologie moléculaire. Par ailleurs, une étude ancienne réalisée par Ribbert [18] en 1895 est fort troublante. Le nucleus pulposus de lapins a été ponctionné et le produit de ponction déposé à la surface antérieure du disque ; ceci a donné lieu quelques semaines plus tard à une formation d’allure tumorale dont la structure histologique était celle d’un chordome. Cette étude a, de plus, été confirmée par Congdon [19] en 1952. Le « chordome » obtenu était plutôt du type « tumeur bénigne à cellules notochordales » car sa croissance s’arrêtait rapidement puis la tumeur involuait. En fait, depuis 1857, des opinions contradictoires ont été avancées avec des partisans affirmant que le nucleus pulposus était le seul reste de la notochorde et inversement d’autres supportant l’idée que la notochorde disparaissait entièrement, le nucleus pulposus provenant du cartilage embryonnaire périchordal. Finalement, des études plus récentes montrent que la notochorde serait progressivement remplacée au niveau des disques par du fibrocartilage jusque dans les premières années de la vie [20–23]. Les deux types cellulaires observés au niveau du nucleus pulposus de l’adulte [24] seraient néanmoins dérivés de la notochorde si on se base sur l’immuno-histochimie et les études cytogénétiques. Enfin, si l’origine des chordomes se situe au niveau des disques, comment expliquer les chordomes sacrés et surtout ceux de la base du crâne ?
À l’inverse, il paraît beaucoup plus probable que les chordomes se développent à partir des vestiges notochordaux. La distribution topographique et même la fréquence de ces vestiges correspondent clairement avec celles des chordomes. Il a même été rapporté deux cas de chordomes sacrococcygiens et un du clivus [25] situés à proximité de vestiges notochordaux. Ces vestiges s’observent dans le clivus [18], la couche sous-muqueuse du nasopharynx [26], les corps vertébraux [27] et la région sacrococcygienne [28]. Des îlots de cellules notochordales ont aussi été retrouvés sur la face antérieure cartilagineuse des corps vertébraux [25]. Les chordomes trouveraient donc leur origine à partir des vestiges de la notochorde et non pas de son seul résidu en fin d’évolution au niveau du nucleus pulposus. Reste encore à expliquer les exceptionnels mais bien réels chordomes strictement intraduraux, voire intracérébraux ou encore d’autres comme ceux développés en extra-axial tel celui rapporté par Leroux-Robert et De Brux [29] au niveau de l’écaille occipitale et beaucoup d’autres ensuite y compris dans les tissus mous. Le facteur inducteur de la croissance tumorale à partir des vestiges notochordaux a aussi été discuté. Un traumatisme a été suggéré notamment rachidien en s’appuyant sur l’expérimentation de Ribbert rapportée plus haut ; il a été avancé que la survenue d’une hernie discale post-traumatique pourrait mobiliser le nucleus pulposus et induire un chordome. Difficile à accepter, compte tenu des réserves sur le nucléus énoncées auparavant. Actuellement, c’est essentiellement du côté de la génétique et de la biologie moléculaire que sont recherchés les facteurs inducteurs des chordomes. 4. Les entités pathologiques notochordales De nombreuses entités pathologiques sont dénommées à l’aide de termes comprenant un mot dérivé de la notochorde. Cela témoigne des difficultés à établir le diagnostic de chordome. En fait, la confusion est apparue dès les premières descriptions. Les vestiges notochordaux ont d’abord été rattachés au cartilage de la
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
synchondrose sphéno-occipitale : l’ecchondrosis physaliphora qui est devenue plus tard l’ecchordosis physaliphora (EP). Puis a été décrit le chordome intradural (CH ID), masse tumorale prépontique le plus souvent et histologiquement très proches du chordome classique (CH). Plus récemment, ont été observés et décrites les tumeurs bénignes à cellules notochordales (en anglais benign notochordal cell tumor [BNCT]). À ces entités, il faut ajouter ce qui a été appelé parachordome ou chordome extra-axial ou encore chordoma periphericum. Trois termes qui pourraient désigner des entités similaires ou très différentes. Ces parachordomes peuvent être localisés un peu partout dans les os mais en dehors des vertèbres, d’où l’appellation parfois utilisée, de chordomes extra-axiaux ; ils ont également été décrits dans les tissus mous comme le poumon. Des cas de chordomes parapharyngés, extraosseux ont également été rapportés. Si on considère qu’ils correspondent au développement de tumeurs à partir de l’extrémité de la notochorde située sous le basi-occiput, il faut les classer parmi les chordomes véritables sinon il faut les inclure dans les parachordomes. Il faut rappeler la confusion entre chordomes et chondrosarcomes ou plus globalement entre tumeurs d’origine notochordale et tumeurs d’origine cartilagineuse. Cette confusion a duré depuis la découverte des vestiges notochordaux jusqu’à l’utilisation en routine de l’immuno-histochmie. C’est cette technique qui a permis de différencier les chordomes chondroïdes des chondrosarcomes. Les chordomes chondroïdes ont été décrits avant l’immunohistochimie par Heiffelfinger comme une variante de chordomes à matrice chondroïde, mais il est plus que vraisemblable que certains d’entre eux étaient en fait des chondrosarcomes de bas grade et vice versa. Néanmoins, le problème de la distinction entre tumeurs cartilagineuses et notochordales n’est pas entièrement réglé. En effet, il persiste des formes intermédiaires qui posent problème. C’est le cas pour certains qui pensent que les parachordomes seraient à classer dans ce qui est dénommé chondrosarcomes myxoïdes extrasquelettaux ; pour d’autres, ils correspondent à des sarcomes chordoïdes. On peut y ajouter les chordomes avec composante à cellules malignes en fuseau (chordomas with malignant spindle cell component). Au sujet de cette entité, trois hypothèses ont été avancées ; l’une est une simple coïncidence de survenue simultanée de chordomes et de tumeurs malignes à cellules en fuseau. Les deux autres évoquent soit une forme de chordomes à croissance très rapide, soit un autre phénotype du chordome où les cellules moins différenciées prendraient le dessus sur les cellules conventionnelles. Et pour que la confusion soit totale, il faut souligner que dans les parachordomes sont souvent retrouvées des cellules en fuseau. Enfin, il ne faut pas oublier de mentionner certains types de tumeurs à composante chordoïde. À noter aussi les méningiomes et les gliomes chordoïdes. Pour les méningiomes, cette composante les fait classer parmi les méningiomes atypiques (type II). 4.1. Vestiges notochordaux ou ecchordosis physaliphora (EP) Ils ont été découverts par Luschka en 1856 [1] mais n’ont été rattachés à la notochorde que près de 40 ans plus tard par Ribbert et Steiner [30] en 1894. Ils les retrouvent dans 2 % des autopsies, localisés au niveau du clivus en regard de la jonction sphéno-occipitale. Ils ont été confirmés mais avec une fréquence différente par Steward et Burrow [31] (1,5 % de 200 autopsies) en 1923 puis par Wyatt et al. [32], 0,36 % (6 sur 1600 autopsies) en 1971. L’EP est une formation intradurale, prépontique, de petite taille (inférieure à 2 cm) et rattachée au clivus par un petit pédicule. Il est parfois identifié en IRM. Mehnert et al. [33] en 2004 en a ainsi retrouvé 5 cas sur 300 IRM (1,7 %). L’aspect est celui d’une masse homogène en hyposignal en T1, hypersignal en T2 et ne prenant
7
pas le contraste. Le pédicule rattachant la masse au clivus est visible trois fois sur cinq. Des anomalies osseuses avec un signal similaire à la masse principale sont parfois visibles au niveau du clivus, là où s’insère le pédicule. À noter qu’un des cinq cas a pu être contrôlé deux ans plus tard en IRM avec une image inchangée. Ces masses sont en principe de petit volume, inférieur à 2 cm de diamètre, et donc généralement asymptomatiques mais on retrouve dans la littérature au moins 12 cas révélés par des symptômes. Le plus souvent il s’agit de symptômes non spécifiques : céphalées, étourdissement, vertiges. . ., mais ont aussi été rapportés d’autres cas révélés par une diplopie, une hémiparésie et même une hémorragie intratumorale entraînant le décès [34]. D’autres cas ont été découverts devant une rhinorrhée par fuite de LCR au niveau du clivus [35–37] (Tableau 1).
4.2. Les chordomes intraduraux (CH ID) Autre entité : le chordome intradural (CH ID), qui serait donc plus une tumeur qu’un vestige non prolifératif. En fait, la distinction entre EP et plus ou moins gros chordomes intraduraux (CH ID) est difficile à faire. Des cas similaires à ceux rapportés plus haut et révélés par une hémorragie ou une fuite de LCR ont été décrits avec le diagnostic de CH ID et non d’EP. Tashiro et al. [47], en 1994, publient le cas d’une femme de 56 ans dont le CH ID prépontique a été découvert devant une atteinte de plusieurs nerfs crâniens (le V, le VII et le XII) ; de plus ils colligent 10 cas dans la littérature dont 7 prépontiques, un de l’angle pontocérébelleux, un suprasellaire et un du foramen magnum ; il s’agissait de 6 hommes et 3 femmes (pour l’un, le sexe n’est pas mentionné), âgés de 26 à 75 ans. La lésion mesurait de 2 à 6 cm. Deux ont été révélés par des hémorragies entraînant le décès [48] et leur diagnostic a été fait à l’autopsie. Plus récemment, ont été rapportés plusieurs cas traités soit par chirurgie soit par radiothérapie. Bergmann et al. [49] ont présenté 3 cas, 2 femmes et un homme, âgés de 38 à 44 ans ; deux de ces tumeurs étaient localisés dans la région cervicale haute et l’autre en prépontique. Les trois ont été opérés plus ou moins complètement, avec un recul de 1 à 7 ans sans récidive. Jiagang et al. [50,51] décrivent un CH ID suprasellaire chez un homme de 51 ans révélé par des céphalées et une baisse d’acuité visuelle, et opéré par voie ptérionale (Fig. 6). Ito et al. [52] présentent deux femmes porteuses de CH ID ; la première, âgée de 59 ans, avait un CH ID adhérant au tronc cérébral et traité par radiochirurgie ; l’autre, âgée de 75 ans, a présenté plusieurs récidives et a été opérée à plusieurs reprises avant d’être traitée par Gammaknife. Ce cas est l’un des rares ayant présenté des récidives ce qui est à l’encontre du bon pronostic habituel, même après chirurgie partielle, de ces CH ID. Feng et al. [37] rapportent un très petit CH ID du clivus révélé par une rhinorrhée et traité par endoscopie endonasale ; sa petite taille le ferait plutôt classer dans les EP. Ils retrouvent 3 autres cas dans la littérature ayant aussi présenté une fuite de LCR mais tous étaient de plus gros volume avec un diamètre supérieur à 10 mm. Feng et al. considèrent que son cas est une EP et les autres des CH ID. Plusieurs revues de littérature ont été publiées après celle de Tashiro et al. [47] en 1994 : celle de Nishigawa, en 1998, portant sur 14 cas, et la dernière par Ciarpaglini et al. [53] en 2009 colligeant 22 cas de CH ID intracrâniens et 9 d’EP symptomatiques. Depuis lors, on peut ajouter 5 cas de CH ID rachidiens [49,54–56] dont 4 cervicaux et un thoracique, et 9 cas intracrâniens [50,51,57–63] dont 6 prépontiques, 1 suprasellaire et 1 latéro-bulbaire au niveau du foramen magnum associé à une sclérose tubéreuse de Bourneville et 1 du cavum de Meckel (Tableau 2). Parmi les CH ID, il faut mettre à part les chordomes intraparenchymateux (Tableau 3). Au moins 4 cas ont été rapportés [78–81].
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
8 Tableau 1 Ecchordrosis physaliphora symptomatiques. Symptomatics of ecchordrosis physaliphora. Référence
Âge/sexe
Siège
Signes
Chirurgie
RxTT
Récidive
Suivi
Évolution
Stam et Kamphorst [34] Macdonald et al. [35] Akimoto et al. [38] Toda et al. [39] Ng et al. [40] Cha et al. [41] Takeyama et al. [42] Ling et al. [43] Fracasso et al. [44] Rotondo et al. [45] Alkan et al. [46]
75/M 66/F 51/F 56/F 84/M 49/M 12/M 45/F 48/F 47/F 12/M
Prépontine Prépontine Prépontine Prépontine Prébulbaire Prépontine Prépontine Prépontine Prépontine Prépontine Prépontine
HM Fuite LCR Diplopie Céphalée− Hémiparésie + trouble sensitif Trouble équilibre Hémiparésie + diplopie Surdité HM Céphalée Hémo VII Dysarthrie Hémiparésie Fuite LCR
Non Total Total Total Total Total SubT Total Non Total Non
Non Non Non Non Non Non Non Non Non Non Non
Non Non Non Non Non Non Non Non Non Non Non
? 4M ? 2A 6M 18 M 6M 4S ? 12 M 4S
DcD RAS ? RAS RAS RAS RAS ? DcD RAS RAS
Total
Non
Non
Feng et al. [37]
Prépontine
RAS
RAS : rien à signaler ; RxTT : radiothérapie ; DcD : décédé ; SubT : exérèse subtotale. RAS: free of progression; RxTT: radiotherapy; DcD: death; SubT: subtotal.
Le premier chez un homme de 58 ans était localisé au niveau de la tente avec une extension intraparenchymateuse sus et sous tentorielle. La lésion découverte en 1981 devant des céphalées, mesurait 1,8 cm de diamètre. Le patient a refusé tout traitement pendant près
de 8 ans mais revint en urgence, léthargique, confus, dysarthrique avec des troubles visuels et un Parinaud. Il s’améliora après dérivation de son hydrocéphalie puis devint comateux quelques jours plus tard. Il fut opéré en deux temps, sur la fosse postérieure puis
Tableau 2 Chordomes intraduraux. Intradural chordomas. Références
Âge/sexe
Siège
Symptômes
Chirurgie
RxTT
Récidive
Suivi
Évolution
Dahlin et Maccarty [64] Bartolini [65] Mathews et Wilson [66] Mapstone et al. [48] Vaquero et al. [67] Yuhi et al. [68] Ramiro et al. [54] Wolfe et Scheithauer [69]
? 57/M 41/M 26/M 39/F 28/M 33/F 44/M
Pont Pont Selle Pont Supraselle Pont T6 Pont
Non Non SubT SubT Total ? Total SubT
Non Non Oui ? ? Non ? Non
Non Non ? ? ? Non Non Non
? ? 4S ? ? 18 M 12 M ?
DcD DcD HM RAS ? DcD RAS RAS DcD
Katayama et al. [70]
70/F 30/F
Supraselle FM
SubT Total
Non Non
Non Non
? 11 M
Amélioration Amélioration
Hardie [71]
28/F
Pont
?
?
?
?
RAS
Tashiro et al. [47] Wanibuchi et al. [72] Vaz et al. [55] Nishigaya et al. [73]
56/F 54/M 37/F 56/M
Pont Supraselle C5-T2 Pont
? Total SubT SubT
? Non Non Non
? Non Non Non
? 5M 18 M 5 ans
? RAS Def main Surdité
Korinth et al. [74]
48/F
APC
SubT
Oui
Oui
?
Métastases rachis
Gelabert-González et al. [56] Danilewicz et al. [75] Masui et al. [76]
65/M 19/F 63/M
C6-C7 Pont Pont
Total Total Total
Non Non Non
Non Non Non
2 ans 12 ans ?
RAS Diplopie CN VI
Roberti et al. [77]
58/M ? ? 9/M 60/M 30/M 59/F 75/F 51/M 38/M 44/F 76/M 38/M
Pont Pont Selle Pont Pont Pont Pont Pont Supraselle Cervical Cervical Pont FM lat Pont Meckel
Asymptomatique CN HLH endocrine CN hémiparésie Confus CN équilibre Paraparésie Diplopie Confus Dysarthrie Troubles visuels Coma Paraparésie Diplopie VIII Paraparésie CN HLH Paresthésies Syndrome cérébelleux CN Trouble équilibre Troubles visuels Paraparésie CN multiples CN équilibre, tetraparésie Équilibre ? ? Céphalées Trouble mémoire CN V ? ? Troubles visuels Douleur Douleur Diplopie équilibre HIC + TSC Hémo Vent CN V
Total Total Total Total SubT Total SubT Total Total Total Total SubT SubT
Non Non Non Non Non Non Oui Oui ? Non Non Non Oui
Non Non Non Non Non Non ? Multiples ? Non Non Non Non
12 M ? ? 1 an 4M 1 an ? ? ? 7 ans 1 an 5 ans ?
RAS CN IV RAS RAS RAS RAS ? ? ? RAS RAS RAS CN IX, X
Chang et al. [57] Ciarpaglini et al. [53] Bhat et al. [59] Ito et al. [60] Jiagang et al. [50,51] Bergmann et al. [49]
Kimmell et al. [58] Kim et al. [62] Barresi et al. [63]
RAS : rien à signaler ; RxTT : radiothérapie ; DcD : décédé ; SubT : exérèse subtotale. RAS: free of progression; RxTT: radiotherapy; DcD: death; SubT: subtotal.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
9
Tableau 3 Chordomes intraduraux intraparenchymateux. Intradural intraparenchymatal chordomas. References
Âge/sexe
Site
Clinique
Chirurgie
RxTT
Récidive
Suivi
Évolution
Warnick et al. [78]
58/M
Tente
SubT
?
?
?
HLH
Commins et al. [79]
51/F
Hypothal
Total
Non
Non
Non
DcD
Dow et al. [80] Figueiredo et al. [81]
9/F 18/M
Cervelet Pineal
Dysarthrie Troubles visuels Confus HIC HIC Parinaud
SubT SubT
Non Oui
Non Oui
14 M 16 A
MéningiteRAS DcD
RAS : rien à signaler ; RxTT : radiothérapie ; DcD : décédé ; SubT : exérèse subtotale. RAS: free of progression; RxTT: radiotherapy; Dcd: death; SubT: subtotal.
sur le lobe occipital. Il récupéra et ne conserva qu’une hémianopsie latérale homonyme avec au scanner un petit résidu le long du sinus droit. Le deuxième fut observé chez une femme de 51 ans, hospitalisée pour des céphalées et un état confusionnel. Elle présentait une hypertension intracrânienne avec œdème papillaire et hydrocéphalie. Le scanner et l’IRM ont découvert un chordome de la région hypothalamique, remontant dans le V3, d’environ 2 cm de diamètre. La patiente s’améliora après ventriculo-cisternostomie mais décéda 3 jours après l’exérèse de la lésion par voie transcorticale transventriculaire. À l’autopsie, on mit en évidence un hématome de l’hypothalamus antérieur. Le troisième patient était une fille de 9 ans présentant un chordome du cervelet, révélé par une hypertension intracrânienne et réséqué de fac¸on subtotale, et dont le résidu était stable en IRM 14 mois après. Enfin, le dernier patient, un garc¸on de 18 ans, présentait un chordome de la pinéale ; il fut hospitalisé pour douleurs et ballonnements abdominaux. Il avait été opéré 16 ans auparavant d’une masse pinéale étiquetée germinome, intervention complétée par une dérivation ventriculo-péritonéale et une radiothérapie. À l’examen, on retrouvait un syndrome de Parinaud et une paralysie du III. L’IRM mit en évidence une tumeur pinéale prenant le
contraste, et l’échographie, une masse abdominale autour du cathéter de dérivation. La biopsie de cette masse, réalisée sous scanner révéla un chordome. La tumeur pinéale ne fut pas réopérée mais le diagnostic initial fut révisé pour conclure à un chordome avec métastase le long de la dérivation. Le patient décéda rapidement de complications systémiques (sic) (Tableau 3). On peut y ajouter le cas rapporté en communication affichée par une équipe lyonnaise (DA Guerra Sierra) lors du congrès de Vienne (Autriche) en 2011 ; il s’agissait d’une femme de 65 ans opérée d’un cancer du sein en 2007 et présentant une masse occipitale considérée initialement comme une métastase et qui s’est révélée être un chordome. Ces tumeurs intraparenchymateuses posent le problème de leur origine car il est difficile d’imaginer un résidu de la notochorde aussi à distance. On est obligé d’évoquer une migration ectopique de résidus notochordaux ou la transformation de cellules pluripotentes vers des cellules chordales sous l’influence de facteurs encore inconnus. Par ailleurs, on ne peut pas négliger le fait qu’ils ne s’agissent pas de véritables chordomes car la plupart n’ont pas eu d’étude immuno-histochimique complète en particulier de recherche de positivité pour les cytokératines et la brachyurie. Les critères qui sont maintenant retenus en faveur d’une EP et qui la différencient des CH ID sont : la petite taille (inférieure à 2 cm), le caractère asymptomatique, l’absence de prise de contraste en IRM, l’existence d’un tractus la reliant au clivus visible en scanner ou à l’intervention, l’absence de matrice myxoïde extracellulaire en histologie et un coefficient de prolifération (Ki 67) nul ou très faible. Sur le plan évolutif, les EP restent stables et asymptomatiques alors que les CH ID augmentent de volume au cours du temps. Néanmoins, l’exérèse totale ou subtotale des CH ID est le plus souvent possible du fait de l’absence d’envahissement osseux et de limites bien définies dans les espaces sous-arachnoïdiens ; leur pronostic est donc généralement bon même en cas d’exérèse incomplète. La plupart des cas rapportés n’ont pas récidivé bien qu’aucun traitement complémentaire (radiothérapie) n’a le plus souvent été réalisé. Il faut cependant souligner que la durée de suivi postopératoire est souvent courte. 4.3. Les tumeurs bénignes à cellules notochordales (BNCT)
Fig. 6. CH intradural. A. Dans la citerne opto-chiasmatique. B. Latéro-médullaire. Intradural chordoma. A. In the opto-chiasmatic cistern. B. In the latero-medullary cistern. D’après Jiagang et al. [50,51] ; publié avec l’autorisation d’Elsevier (A) ; d’après Kimmell et al. [58] (B).
La tumeur bénigne à cellule notochordale, en anglais benign notochordal cell tumor (BNCT), est une autre entité chordale qui a pu être décrite sous d’autres dénominations : résidu notochordal géant intravertébral [82], hamartome notochordal géant d’origine intraosseuse, chordome bénin [82,83]. Le terme de BNCT semble, à juste titre, devoir s’imposer. Il s’agit d’une lésion intravertébrale évoquant un chordome, contenant des cellules physaliphores avec des caractéristiques immunohistochimiques similaires à celles du chordome. Néanmoins, cette entité pathologique ne comporte aucune destruction osseuse ni aucune invasion des tissus mous. L’aspect en IRM est celui d’un chordome, hormis la prise de contraste qui est absente dans les BNCT (tout comme dans les EP). Ces BNCT seraient donc plus
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 10
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 7. Benign notochordal cell tumor (BNCT). Aspect en IRM coupes axiales et sagittales en T1 et T2. Benign notochordal cell tumor (BNCT). MRI features in axial and sagittal T1 and T2 views. D’après Lalam et al. [568] ; publié avec l’autorisation de Springer-Verlag Berlin, Heidelberg.
proches de vestiges que de tumeurs évolutives. Cette question n’est en fait pas tranchée. La première description qu’en a faite Ulich et Mirra [84] en 1982 évoque un résidu notochordal intravertébral. D’autres publications ont suivi, dans lesquelles la BNCT fut découverte lors d’autopsie [85,86] ou par hasard lors d’interventions chirurgicales (Mirra, Yamaguchi, Ulich). Il s’agissait de lésions infracentimétriques, non visibles sur les examens radiologiques. Des lésions plus volumineuses et parfois symptomatiques, souvent visibles en imagerie ont été publiées ultérieurement. Darby et al. [87] en 1999 soulèvent la question : vestige ou véritable tumeur ? Mirra et Brien [88] en 2001 évoquent la possibilité d’un hamartome car les BNCT ne grossiraient que pendant l’enfance et seraient stables ensuite, en tout cas pendant plus de 10 ans. Haasper et al. [89] renforcent cette idée en affirmant que les BNCT opérés ne présentent aucune récidive et ce pendant plus de 10 ans. Néanmoins, le terme d’hamartome est récusé par Yamaguchi et al. [90] en 2008, car contrairement aux hamartomes, les BNCT contiennent du tissu immature. Pour certains, la BNCT serait un précurseur du chordome qui aurait, avant sa transformation, une croissance réduite, voire nulle. Cette hypothèse est supportée par la découverte de BNCT au voisinage d’authentiques chordomes. Deshpande et al. [91], en 2007, en retrouvent 6 au voisinage des 82 (3 %) chordomes qu’ils ont opérés ; Yamaguchi et al. [83] présentent un homme de 57 ans dont le chordome du coccyx était accolé à une BNCT et associé à 2 autres dans le sacrum ; le même auteur, en 2005, rapporte 2 cas de BNCT intra-osseuse, associée à un chordome extraosseux [92]. Nishiguchi et al. [93] décrivent une lésion comportant un mélange de chordome et de BNCT. Cette lésion prenait faiblement le contraste en IRM mais était positive en TEP-FDG (Fig. 7). Elle a été traitée après biopsie par Carbone 11 entraînant une régression importante sans récidive à 24 mois. Les BNCT sont le plus souvent de découverte incidentelle. Yamaguchi et al. [85,86], en 2004, trouvent 20 BNCT sur une série de
100 autopsies. Lorsqu’elles sont symptomatiques, il s’agit le plus souvent de douleurs locales spontanées ou provoquées à la pression. Plus rarement sont décrites des sensations de raideur ou d’engourdissement. Dans la série autopsique de Yamaguchi, l’âge varie de 7 à 82 ans (63 ans en moyenne) avec une distribution de sexe M/F à 3/1. Ils ont été retrouvés chez 11,5 % des clivus étudiés, 5 % des cervicaux, 2 % des lombaires et 12 % des sacrums. Sur le plan radiologique, la BNCT peut être invisible en scanner mais peut aussi se révéler par un aspect condensé, sclérotique de l’os. En IRM, elle est presque toujours apparente sous la forme d’un hypersignal homogène en T2 et un hyposignal homogène en T1 mais sans prise de contraste ; la lésion est bien circonscrite sans destruction ni extension au-delà de la vertèbre. L’image radiologique peut occuper jusqu’à 50 % du corps vertébral. L’os autour de la lésion est normal ou montre un discret épaississement des travées osseuses. Une telle image radiologique peut faire évoquer une tumeur comme un hémangiome, un myélome, un lipome ou une lésion inflammatoire. L’attitude raisonnable semble être une surveillance radiologique rapprochée, au moins initialement. Certains préconisent une biopsie à l’aiguille mais elle comporte un nombre de faux positifs et de faux négatifs non négligeable qui rend son intérêt discutable. Sur le plan histologique, l’os trabéculaire en périphérie est normal, parfois plus dense. Parfois, entre les travées osseuses, on observe des cellules claires évoquant plus ou moins du tissu graisseux. Ces cellules forment parfois des ensembles microkystiques éosinophiles. La lésion centrale a les mêmes caractéristiques que les vestiges notochordaux (EP) ou même les chordomes avec en particulier des cellules physaliphores. Mais, à l’inverse des chordomes, il n’y a, d’une part, aucune matrice myxoïde intercellulaire, d’autre part, aucune anomalie évoquant une agressivité tumorale, encore moins une malignité : pas de mitose, pas de nécrose, pas de
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Tableau 4 Les principales caractéristiques des benign notochordal cell tumor (BNCT). The principal characteristics of benign notochordal cell tumor (BNCT). Radios standards
Sclérose ou rien
Scanner
Sclérose avec densification Pas de destruction osseuse ni de rupture corticale Hyposignal en T1, hypersignal en T2 Pas de prise de contraste, pas d’extension vers les tissus mous Cellules vacuolées et éosinophiles Pas de lobule ; pas de matrice myxoide ; pas de figures de mitoses Parfois éléments de moelle osseuse incluse Positivité : S100, vimentine, cytokératine, EMA, brachyurie
IRM
Histologie
pleïomorphisme. Les champs sont uniformes sans variation d’un secteur à l’autre. En immuno-histochimie, les BNCT sont positives pour les cytokératines, la brachyurie le CAM, l’EMA le S100 et la vimentine comme le sont les chordomes classiques. Ces différences histopathologiques et immuno-histochimiques ont été précisées notamment par Yamaguchi et al. [90]. Certaines publications contestent néanmoins ces données, en particulier la positivité aux cytokératines de haut poids moléculaire, 18 et 19 [94,95]. Finalement, entre la notochorde et le chordome, existent plusieurs formes intermédiaires : les vestiges notochordaux (EP) résidus a priori inactifs et non évolutifs, les chordomes intraduraux (CH ID) et les tumeurs bénignes à cellules notochordales (BNCT), éléments pathologiques plus ou moins évolutifs, d’allure bénigne mais qui pourraient être des formes précurseurs du véritable chordome. Les principales caractéristiques des BNCT sont résumées dans le Tableau 4. 4.4. Chordomes extra-axiaux, parachordomes, chordoma periphericum Des tumeurs ayant des caractéristiques proches du chordome, mais localisées en dehors de l’axe de la notochorde (du coccyx à la base du crâne), ont été rapportées sous différentes dénominations depuis 1955. À cette date, Laskowski [96] décrit 5 cas auxquels il donne le nom de chordoma periphericum. Dabska [97] en 1977 rapporte 10 cas, incluant ceux de Laskowski et utilise le terme de parachordome qui sera ensuite le terme le plus souvent utilisé. En 1993, Ishida et al. [98] publient un cas localisé au mollet chez une femme de 19 ans et colligent 11 cas dans la littérature. Van Akkooi et al. [99] décrivent un cas de la paroi thoracique chez une femme de 56 ans qu’ils ajoutent aux 36 cas déjà publiés. Enfin la dernière revue de littérature, effectuée par Clabeaux et al. [100] en 2008, colligeaient 45 cas (20 femmes, 25 hommes âgés de 4 à 86 ans–moyenne 35 ans). Les localisations les plus fréquemment observées étaient les membres inférieurs (51 %) suivis par les membres supérieurs (27 %) et le tronc, c’est-à-dire le thorax, l’abdomen et le pelvis (19,5 %). La plupart des localisations étaient osseuses mais les localisations aux parties molles et aux organes sont loin d’être rares. On peut ainsi mentionner : le poumon [101–104] ; le médiastin postérieur [105–107], la séreuse gastrique [108] ou les tissus pelviens au contact du pubis [109]. Sebag et al. [110] rapportent un cas chez un garc¸on de 6 ans, localisé aux foramens intervertébraux L2-L3 et L3-L4 se présentant comme une masse en sablier avec élargissement des foramens mais sans envahissement ni lyse osseuse. Un chordome localisé à l’intérieur d’un tératome cystique mature de l’ovaire a également été rapporté [111]. Un autre cas de tératome de l’ovaire contenant un segment de colonne vertébrale incluant des résidus notochordaux avait été publié en 1940 par Riopelle [112]. Pour les membres, à côté des localisations osseuses ont été décrits
11
des parachordomes du mollet [98,113,114], du muscle fessier [115], des muscles péri-scapulaires [116], et du poignet [117]. Un autre de ces parachordomes extraosseux est très particulier. Il s’agissait d’une femme de 67 ans présentant une masse développée le long du nerf médian, depuis le poignet jusqu’au-dessus du coude, ayant rapidement grossi pendant les 6 derniers mois, et étant associée à des métastases ganglionnaires axillaires. La patiente a accepté une désarticulation du bras après une chimiothérapie mal tolérée et inefficace. Le suivi à 20 mois est sans nouvel élément [551]. Ces parachordomes sont réputés pour avoir une évolution bénigne, en particulier après exérèse complète. La plupart des auteurs ne recommandent d’ailleurs pas de radiothérapie complémentaire lorsque l’exérèse est estimée complète. Néanmoins, d’une part, le suivi des patients est souvent court ; d’autre part, sur les 45 cas répertoriés par Clabeaux et al., on observe 9 récidives dans un délai variant de 3 mois à 12 ans, et 5 cas compliqués de métastases : parachordome de la jambe avec métastase pulmonaire [118] ; lésion de la fesse avec métastase sur le muscle fessier à distance de la lésion initiale [115] ; parachordome de la paroi thoracique avec métastase ganglionnaire [119] ; parachordome du mollet avec métastases multiples [113] et parachordome du mollet avec métastase pulmonaire et cérébrale [114]. Tirabosco et al. [120] reprennent une série de 12 cas qu’ils considèrent comme étant d’authentiques chordomes extra-axiaux car positifs à la brachyurie, et parmi lesquels on observe 3 récidives qui, toutes, correspondent à des exérèses par morcellement et incomplètes (Fig. 8). L’aspect macroscopique, tel qu’il est décrit dans les articles précédemment cités est très similaire à celui des chordomes. Il s’agit de masses plurilobées, généralement bien circonscrites mais pas encapsulées, plus ou moins grisâtres et dont le contenu est plutôt mou voire gélatineux. En imagerie, l’aspect est là encore voisin de celui du chordome avec souvent une prise de contraste. Lorsque le parachordome est développé à partir de l’os, il est invasif avec effraction de la corticale et extension vers les parties molles. Sur le plan histologique, sont le plus souvent décrits deux types de cellules : des cellules à cytoplasme éosinophile et des cellules en fuseau. Elles présentent toutes deux des vacuoles souvent volumineuses, très similaires aux cellules physaliphores. Une matrice myxoide est souvent présente. En revanche, on observe rarement de nécrose ou d’anomalies cytonucléaires. Sur le plan immunohistochimique, les disparités entre les différents cas sont très importantes. Certains sont positifs pour les cytokératines, d’autres ne le sont pas, si bien que pour certains, les parachordomes se rapprocheraient plus des tumeurs chondroides (chondrosarcomes myxoïdes) et pour d’autres des tumeurs chordoïdes (chordoïd sarcomas). Certains auteurs considèrent qu’il s’agit d’authentiques chordomes extra-axiaux, voire de tumeurs bénignes à cellules notochordales (BNCT). Kikuchi et al. [104] rapportent deux cas de tumeurs asymptomatiques localisées au niveau du poumon et stables dans le temps, dont l’une sur une période de plus de 8 ans, qui seraient des BNCT. Le problème selon lui est qu’une BNCT de siège osseux a des critères radiologiques qu’on ne peut bien sûr pas retrouver sur une tumeur des parties molles ; dans ce cas, seul l’aspect histologique comme l’absence de matrice myxoide permettrait ce diagnostic. Néanmoins la positivité en immuno-histochimie à la brachyurie, découverte récemment, semble être un argument majeur sinon définitif en faveur d’une lésion d’origine chordale : chordome ou BNCT (cf le chapitre sur la brachyurie). Les deux cas de Kikuchi et al. sont positifs pour la brachyurie. Sur ce critère, Tirabosco et al. [120] ne recensent en 2008 que 10 cas de parachordomes positifs à la brachyurie dont 8 osseux et 2 des parties molles. En définitive, il existe un certain nombre de tumeurs des os ou des parties molles similaires aux chordomes sur le plan macroscopique
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 12
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 8. CH extra-axial intramusculaire. Extra-axial chordomas: intramuscular. D’après Clabeaux et al. [100] ; publié avec l’autorisation de Springer.
et microscopique. Certaines sont positives à la brachyurie et en général aussi à la cytokératine 19, et seraient donc d’authentiques chordomes (ou BNCT) ; les autres seraient à classer avec les parachordomes, entité reconnue par l’OMS, et regroupées avec les tumeurs mixtes ou les myoépithéliomes des tissus mous depuis 2002 [121]. Ce type de tumeur est proche des tumeurs des glandes salivaires (pleiomorphic adenoma). Il s’agit d’un groupe hétérogène présentant des aspects variés, positif aux cytokératines de petit poids moléculaire et au S100 mais négatif aux cytokératines 18,19 et 20. Bien entendu, il faut aussi avoir éliminé la possibilité d’une métastase d’un chordome en localisation axiale ou celle d’un carcinome (cancer du rein ou mélanome par exemple) par un bilan radiologique et un PET scan (Tableau 5). 5. Meningiome et gliome chordoïdes 5.1. Les meningiomes chordoïdes Ils correspondent à une forme rare de méningiomes dans laquelle on retrouve une infiltration lympho-plasmocytaire avec des contingents plus ou moins importants très proches du chordome. C’est une variété qui semble avoir été décrite en 1977 par Eimoto et Hashimoto [122] sous le terme de méningiome vacuolé puis, par Dahmen [123] sous le terme de méningiome myxoïde. Mais c’est Connors [124], en 1980, qui a attiré l’attention sur ce type de méningiome. Le cas qu’il a rapporté a été discuté entre les pathologistes de l’université de Californie, favorables au diagnostic de chordome, et ceux de l’Armed Forces Institute, favorables au diagnostic de méningiome angioblastique. C’est Kepes et al. [125] en 1988 qui introduisit le terme de méningiome chordoïde en décrivant 7 cas (incluant d’ailleurs celui de Connors). L’OMS a introduit en 1993 cette variété dans sa classification des méningiomes en lui attribuant un grade II, donc intermédiaire, du fait non pas tant d’aspects atypiques cytonucléaires, que de la prédisposition supposée à récidiver. Cette variété est rare. Seuls 19 cas sur une série de 1663 méningiomes (1,1 %) ont été observés à Lariboisière sur une période de 20 ans (1991–2011). Elle représente de 0,5 à 1 % de
tous les méningiomes des trois grandes séries publiées [125–127]. Le premier rapporte la série de la Mayo Clinic avec 42 cas, Epari et al. celle de New Dehli avec 12 cas. La troisième série, la première à avoir été publiée, est celle de Kepes avec 7 cas. Dans cette série, essentiellement pédiatrique, le méningiome est dans tous les cas associé à un syndrome de Castleman ou au moins à un syndrome inflammatoire avec une anémie. Le syndrome de Castleman est un syndrome inflammatoire avec prolifération lymphoïde associant fièvre, anémie microcytaire hypochrome, hépatosplénomégalie, dysgammaglobulinémie et retard de développement somatique et sexuel. Civit et al. [128] en publient un cas similaire en 1998, et insiste sur l’association du méningiome à ce syndrome inflammatoire, et à un œdème important et même à un infiltrat inflammatoire péritumoral. Il souligne sa disparition après l’exérèse du méningiome. Dans un des cas de Kepes, ce syndrome inflammatoire a pu réapparaître lors d’une récidive. Cette notion d’association à un syndrome inflammatoire ne semble être fréquente que dans la population pédiatrique. Les séries ultérieures composées surtout d’adultes ne comportent quasiment jamais de signes inflammatoires associés. Kozler et al. [129] reprennent 92 cas dans la littérature qui comptent 90 % d’adultes ; 7 autres cas pédiatriques ont été publiés après ceux de Kepes et seulement 2 cas sur les 85 publiés après Kepes présentent un syndrome de Castleman. Ces méningiomes chordoïdes (Fig. 9) sont dans 81,5 % supratentoriels, et plutôt de la convexité proche de la ligne médiane. Mais ont été publiés pratiquement toutes les localisations possibles : ventricule latéral [130], troisième et quatrième ventricule [131], foramen magnum, foramen jugulaire, orbite [132], tente, angle pontocérébelleux, cervical et même intraparenchymateux [133,134] et un cas au niveau du poumon [135]. Ce type de méningiome s’observe dans une population plus jeune que celle des méningiomes classiques : 47,4 ans (12 à 77 ans) pour Couce et al. et 32,4 ans (12 à 67 ans) pour Epari et al. Kozler et al. indiquent une proportion d’enfants de moins de 18 ans de 8,2 %. Le sexe est à peu près également réparti sauf en pédiatrie où le taux est de 2 pour 1 en faveur des filles. Sur les 9 cas rassemblés par Civit et al., la moyenne d’âge est de 13,8 ans avec 6 filles et 3 garc¸ons.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
13
Tableau 5 Chordomes et entités notochordales. Chordomas and notochordal entities. Entité
Localisation
Symptomatologie la plus fréquente
Taille
IRM TDM
Histologie
Évolutivité
EP
Intradurale Prépontique
Aucune
< 2 cm
Prépontique (56 %) Suprasellaire : 19 % Pré-médullaire : 19 % Latéraux : 6 % Intra-osseux
F (localisation)
> 2 cm
Matrice myxoïde = 0 Ki 67 : nul Brachyurie = + Matrice myxoïde + Ki 67 : faible Brachyurie = +
Nulle (?)
CH ID
Prise de contraste = 0 Tractus le rattachant au clivus (3/5) Prise de contraste +
Aucune
Petite
Prise de contraste = 0 Lyse osseuse = 0
Faible ou nulle
CH extra-axial Parachordome
Os et tissus mous
Masse + douleur
Variable
Prise de contraste = +
Os et tissus mous
Masse + douleur
Variable
Prise de contraste = +
Chordome
Os et extension extraosseuse
F (localisation)
> 5 cm
Prise de contraste = + Lyse osseuse = +
Matrice myxoïde = 0 CytoK 18–19 = + Brachyurie = + CytoK 18–19 = + Brachyurie = + CytoK 18–19 = 0 Brachyurie = 0 Matrice myxoïde = + CytoK 18–19 = + Brachyurie = + Atypies cytonucléaires
BNCT
Le pronostic de ce type de méningiome serait donc plus mauvais que celui des formes classiques. Dans la série pédiatrique, 2 récidives à 2 ans ont été observées sur les 9 cas, dont une après exérèse totale. Dans la série de Couce et al. (n = 42), 2 patients sont décédés en postopératoire ; un autre après récidive et sur les 36 restants ayant un suivi connu, 14 soit 39 % ont récidivé entre 1,8 et 16 ans après exérèse. Toutes les exérèses incomplètes et une seule exérèse totale ont récidivé. L’index de prolifération dans cette série variait de 0,4 à 11,4 %. À l’inverse dans la série d’Epari et al. (n = 12) aucune récidive n’a été notée pour un suivi de 3 à 24 mois. L’index de prolifération est très variable selon les publications, de moins de 1 % [132] à 9 % [136]. Epari et al. [127] indiquent que tous ses patients ont un index inférieur à 2 % sauf 2 ayant un index à 6 et 8 %. En définitive, il est difficile d’affirmer que ce type de méningiomes a vraiment un plus fort taux de récidives que les méningiomes classiques. Comme pour ces derniers, une exérèse incomplète justifie une surveillance particulière. Enfin la différenciation de ce type de méningiomes par rapport aux autres types tumoraux ne devrait pas poser de problème. En immuno-histochimie, ils ne sont pas positifs ni pour la brachyurie,
Faible
Faible Faible Récidives Métastases
ni pour les cytokératines, et en général peu pour le S100, ce qui les séparent clairement des chordomes. En revanche, ils sont positifs pour la vimentine et l’EMA et négatifs pour la GFAP, ce qui les distingue des gliomes chordoïdes.
5.2. Le gliome chordoïde C’est une entité encore plus rare puisque, en 2012, on n’en trouve que 45 cas décrits dans la littérature. La première description a été faite par Wanschitz et al. [137] en 1995, et développée par Brat et al. [138] en 1998 qui introduit le terme de gliome chordoïde. Cette entité n’a été incorporée dans la classification de l’OMS qu’en 2000, et classée comme un gliome de grade II. Le gliome chordoïde s’observe le plus souvent chez une femme, d’âge moyen 45,2 ans [139,140]. Il est pratiquement toujours localisé au niveau du troisième ventricule et de l’hypothalamus, et se révèle donc en général par des signes liés à une hydrocéphalie, un diabète insipide, des troubles visuels, une léthargie et une ataxie. Son origine serait en fait l’épendyme de la lame terminale [141,142,566].
Fig. 9. Méningiome chordoïde de la région du foramen magnum (Lariboisière). Foramen magnum chordoid meningioma.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 14
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
En immuno-histochimie, on note une positivité pour l’EMA et le D2-40, une négativité des cytokératines et ce qui le caractérise le plus, une GFAP positive. Le coefficient de prolifération est généralement faible, autour de 1 %. Il est considéré comme une lésion de bas grade dont le pronostic n’est pas tant lié à son agressivité naturelle qu’à celle du traitement, en particulier chirurgical. Le traitement est en effet chirurgical pour la quasi-totalité des cas rapportés, mais avec une exérèse le plus souvent partielle justifiant parfois une radiochirurgie complémentaire.
6. Brachyurie La brachyurie est une protéine liée à un gène via un domaine spécifique appelé T box et correspondant au locus 6q27. Elle contrôle la production de protéines inconnues mais qui interfèrent dans les étapes précoces du développement embryonnaire et notamment de la notochorde. Une modification minime de sa structure peut induire une croissance de la queue de certains animaux, insuffisante (brachourie = queue courte, d’où son nom) ou absente (anourie). D’une fac¸on plus générale, c’est un facteur de transcription intranucléaire indispensable pour un développement correct, et la persistance de la notochorde et secondairement des somites. Une anomalie, par mutation par exemple, de la brachyurie entraîne donc des perturbations dans la formation de l’axe vertébral et du mésoderme postérieur dont les hémangioblastes. La brachyurie est aussi un promoteur de la transition épithélial-mésothélial observée dans la progression, et notamment l’apparition de métastases, de nombreux cancers. La brachyurie semble très spécifique des chordomes et apporte un élément décisif à l’hypothèse de l’origine notochordale des chordomes puisqu’elle est exprimée dans la notochorde normale. Une duplication du gène T dans la région 6q27 à l’origine de la brachyurie, a été retrouvée chez tous les membres porteurs de chordomes de quatre familles différentes [143,144]. La région 6q27 contient presque exclusivement le gène de la brachyurie. La brachyurie a été mise en évidence de fac¸on quasi constante dans tous les chordomes des quelques séries étudiées. Elle est très sensitive (au moins dans 90 % des cas) et de plus quasi spécifique (près de 100 % pour tous les auteurs) car elle n’est observée dans aucun autre type tumoral et notamment les tumeurs cartilagineuses. La seule exception notable et parfaitement compréhensible est représentée par l’hémangioblastome du système nerveux central. Vujovic et al. [145] ont testé 54 chordomes et 323 néoplasmes de divers types dont 163 tumeurs cartilagineuses et de plus 33 tissus normaux. La brachyurie était exprimée dans tous les chordomes sauf un qui n’exprimait pas non plus les cytokératines et fut donc reclassé chondrosarcome. Il est intéressant de noter que la brachyurie était détectée de fac¸on diffuse et homogène, ce qui fait penser qu’une biopsie, même de petit volume, permet de retrouver la brachyurie et de faire le diagnostic. De plus, la brachyurie (comme les cytokératines) était retrouvée dans tous les contingents quel qu’en soit le type. Ainsi, elle est positive dans les secteurs chondroides des chordomes chondroides et dans les secteurs différenciés des chordomes dédifférenciés. En revanche, les secteurs dédifférenciés (sarcomateux) n’expriment pas la brachyurie (ni les cytokératines). Les formes récidivantes (n = 4) et les métastases (n = 5) la fixent également. Inversement, aucune des autres tumeurs, y compris cartilagineuses, n’exprime la brachyurie. Elle n’est également pas détectée dans une grande variété de tissus normaux : cerveau, sein, articulation, cartilage, utérus, ovaire, vessie, rein, foie, poumon, ganglion lymphatique, nerf sciatique, peau, amygdale, thyroïde et glande salivaire. Enfin il est remarquable qu’elle ne soit pas présente dans le nucleus pulposus. En revanche, elle est retrouvée (avec les cytokératines) mais uniquement dans la notochorde chez un embryon de 6 à 8 semaines de gestation testé dans sa totalité.
Dans toutes les cellules où elle est trouvée positive, la fixation est intranucléaire comme il se doit pour un facteur de transcription. Le même auteur souligne l’intérêt d’autres marqueurs dont le CD 24 qui serait tout aussi spécifique du chordome. Inversement, le collagène X n’est pas détecté dans les chordomes, mais est trouvé présent dans toutes les tumeurs cartilagineuses. Ce gène est impliqué dans la calcification de la matrice cartilagineuse ce qui expliquerait la quasi-absence de calcifications dans les chordomes et leur grande fréquence dans les chondrosarcomes. De fac¸on plutôt curieuse, le collagène X est aussi retrouvé dans le nucleus pulposus bien connu lui aussi pour se calcifier. Le nucleus pulposus exprime également le CD 24, ce qui soulève à nouveau l’ambiguïté de son origine notochordale ou cartilagineuse. L’hypothèse serait donc que la brachyurie et la cytokératine s’exprimeraient dans la notochorde puis disparaîtraient au fur et à mesure de sa dégénérescence et de sa transformation cartilagineuse, y compris dans la structure ultime dérivée d’elle, le nucleus pulposus. Jambhekar et al. [146] ont étudié l’expression de la brachyurie dans 51 chordomes et 58 tumeurs diverses. Sa population tumorale provenait de quatre sources différentes, et a été observée sur une période de 10 ans. Tous les chordomes, sauf 5, étaient positifs. La négativité de ces 5 cas était expliquée par le fait qu’il s’agissait de matériel histologique ancien et sans doute mal conservé. Dans cette étude, la fixation était uniforme quel que soit le type de chordome. Inversement, aucune des 58 autres tumeurs n’exprimait la brachyurie. En parallèle, les cytokératines et l’EMA étaient positives pour tous les chordomes et le S100 pour 86 % d’entre eux. Oakley et al. [147] publient la seule étude dans laquelle la sensibilité de la brachyurie pour la détection des chordomes est légèrement prise en défaut. Ils analysent 79 chordomes dont 45 chondroides et 24 chondrosarcomes observés sur 38 ans (1969–2007). Pour eux, les cytokératines sont plus performantes que la brachyurie avec 97 % de sensibilité et 100 % de spécificité ; la brachyurie est aussi spécifique (100 %) mais un peu moins sensible (90 %). CD 24 est également très spécifique (100 %) mais très peu sensible (47 %). La combinaison la plus efficace est l’association cytokératine–brachyurie avec respectivement 98 et 100 % de sensibilité et de spécificité. Tirabosco et al. [120] s’intéressent aux chordomes extra-axiaux et ne trouvent ainsi que 10 parachordomes extra-axiaux (8 osseux et 2 des parties molles) positifs pour la brachyurie sur les 12 cas étudiés. Ils testent également 83 tissus normaux provenant de 11 organes différents et 340 tissus tumoraux dont 14 hémangioblastomes du système nerveux et 14 tumeurs testiculaires à cellules germinales. La brachyurie a été retrouvée positive dans tous les cas d’hémangioblastomes, dans 2 tumeurs testiculaires et dans 2 des 13 tissus testiculaires normaux. Aucun des autres tissus ni aucune autre tumeur n’exprimait la brachyurie. Ils en concluent que parmi les tumeurs extra-axiales macroet microscopiquement similaires au chordome, seuls doivent être dénommés chordomes extra-axiaux ceux qui fixent pour la brachyurie ; les autres font partie des parachordomes selon la définition de l’OMS. La publication de Kikuchi et al. [104] à propos de 2 chordomes extra-axiaux du poumon va dans le même sens. Les deux lésions rapportées sont asymptomatiques et sans progression ; l’un est resté stable pendant 8 ans avant d’être opéré. Les deux tumeurs fixent la brachyurie. Ils pensent qu’il s’agit dans les deux cas d’une tumeur bénigne à cellules notochordales (BNCT). En parallèle, ils testent 5 autres BNCT prises au hasard parmi les 34 cas publiés précédemment par la même équipe [85] qui se révèlent également positives. Confirmant ces données, Kyriakos [148] observe une réaction positive à la brachyurie dans un cas d’ecchordosis physaliphora (EP) et dans deux cas de BNCT. L’intérêt de la brachyurie pour l‘authentification de la notochorde et des lésions qui en sont dérivées (BNCT, chordomes axiaux et extra-axiaux) paraît donc évident.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
En revanche, Shen et al. [149] rapportent 6 cas de chordomes (sur une série de 46) associés à des résidus notochordaux (BNCT) avec brachyurie positive pour les chordomes et pas pour les BNCT. Pour expliquer la possibilité du développement d’authentiques chordomes extra-axiaux osseux ou des parties molles, Kikuchi et al. s’appuient sur une étude de Palena et al. [150] mettant en évidence non pas la brachyurie protéine, mais à l’état d’ARN messager, dans une variété de tissus adultes normaux. Théoriquement, un événement simple tel qu’une mutation suffirait donc pour que des cellules ayant une expression aberrante des gènes de la brachyurie se transforment en cellules de chordomes. Toutes ces données sur la brachyurie étayent l’hypothèse de l’origine des chordomes à partir de la notochorde et des BNCT. Pour Kikuchi et al., le diagnostic de BNCT dans l’os peut se faire sur des données radiologiques et histologiques, mais pas au niveau des tissus mous où la brachyurie est indispensable. Enfin une autre étude [151] a recherché l’expression de la brachyurie dans un des diagnostics différentiels du chordome : le cancer du rein à cellules claires ; 184 carcinomes du rein, 111 tumeurs germinales et 30 tissus testiculaires normaux ou néoplasiques ont été analysés. Aucune de ces différentes tumeurs n’était positive alors que les 12 chordomes testés l’étaient. La brachyurie serait donc le marqueur idéal pour authentifier la lignée notochordale jusqu’à sa disparition chez l’embryon ; elle ne s’exprimerait après la naissance que dans les vestiges (EP), les BNCT et les chordomes. La disparition in utero des cellules notochordales, avec transformation cartilagineuse aboutissant au nucleus pulposus, expliquerait ainsi celle de la brachyurie. Sa sensibilité, encore accrue si elle est couplée à la cytokératine, et sa spécificité sont pratiquement de 100 % si on excepte les hémangioblastomes et quelques tumeurs germinales. Outre son utilité diagnostique, la brachyurie pourrait avoir un intérêt thérapeutique car elle aurait un rôle dans la prolifération et la croissance tumorale des chordomes. Deux études [152,153] ont montré qu’à l’aide d’inhibiteurs de la brachyurie, on pouvait induire un arrêt de la croissance de chordomes sur des lignées cellulaires (JHC7 et U-CH1) chez la souris, les cellules prenant un aspect de sénescence. On conc¸oit les possibilités qu’aurait un inhibiteur de la brachyurie utilisable en clinique humaine. 7. Anatomopathologie (M. Polivka, A. Cazorla, H. Adle-Biassette)
15
Fig. 10. Sur le plan macroscopique, les chordomes sont en général lobulé, gélatineux avec parfois des secteurs plus fermes d’aspect cartilagineux. On macroscopic examination, chrodoma are multilobulated gelatinous and soft mass. The regions that contain cartilage are more firm.
Fig. 11. Tumeur d’architecture lobulée, comportant des septa. Lobular arrangement of tumor cells containing fibrous septa.
Définition selon l’OMS : « les chordomes sont des tumeurs malignes présentant une différenciation notochordale ». Macroscopie : tumeur généralement lobulée, de consistance molle gélatineuse avec parfois des secteurs plus fermes de consistance cartilagineuse, de couleur grisâtre ou blanc-bleuté mais il peut y avoir des remaniements hémorragiques, récents ou anciens d’aspect ocre (Fig. 10). Les lobules tumoraux peuvent être bien délimités quand la tumeur envahit les tissus mous, les limites sont souvent plus indistinctes dans l’os lui-même. En cas de rupture corticale, la tumeur reste souvent recouverte par le périoste. Ceci vaut surtout pour les tumeurs sacrées qui sont enlevées en bloc, les localisations cervicales et de la base sont le plus souvent très morcelées. Histologie : classification OMS, 2013. 7.1. Chordome classique La tumeur est d’architecture lobulée, les lobules tumoraux sont séparés par des septas fibrovasculaires (Fig. 11). Les cellules tumorales sont de grande taille, à cytoplasme bien délimité, éosinophile homogène (Fig. 12) ou clarifiées (Fig. 13), contenant une ou plusieurs vacuoles optiquement vides refoulant le noyau, déformant
Fig. 12. Les cellules tumorales de grande taille, bien délimité, au cytoplasme éosinophile homogène, disposées en travées parfois anastomosés sur un fond myxoïde. Neoplastic eosinophilic large cells disposed in solid sheets or irregular intersecting cord in a stroma containing myxoid matrix.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 16
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 13. Cellules tumorales clarifiées, contenant une ou plusieurs vacuoles optiquement vides refoulant le noyau. Noter la présence d’un infiltrat inflammatoire localisé au niveau du septa. Large tumoral cells, with vaculolated cytoplasm containing mucin, called physaliphorous cells.
Fig. 14. Cellules physaliphore caractéristique comportant des vacuoles intracytoplasmiques multiples. Higher magnification of physaliphorous cells.
Fig. 15. Matrice myxoïde mise en évidence par la coloration de bleu alcian. Mucinous matrix stained by alcian blue.
Fig. 16. Anisocaryose marquée avec présence de cellules de grande taille aux noyaux monstrueux et hyperchromatiques. Noter la présence d’une mitose (flèche), et des poussières nucléaires témoignant de l’aopoptose. Anaplastic features may be present, such as hyperchromatic and atypical nuclei and mitosis (arrow). Note the presence of nuclear dust suggestive of apoptosis.
parfois le cytoplasme réalisant l’aspect de cellule physaliphore (Fig. 14) (« portant des bulles ») ou de cellule araignée (le cytoplasme entre les vacuoles étant étiré comme les pattes de ce charmant animal). Ces cellules sont groupées en amas cohésifs de taille variable (Fig. 10 et 11), ou forment des travées monocellulaires, ou des cellules isolées, sur une matrice myxoïde (Fig. 12, 13 et 15) d’abondance très variable d’un lobule tumoral à l’autre au sein de la même tumeur. Les noyaux ont une taille et un contour variable, là aussi au sein d’une même tumeur, voire d’un même lobule : petits et grossièrement arrondis, souvent de contour un peu irrégulier, parfois de grande taille polylobés, voire monstrueux et hyperchromatiques (Fig. 16). Des nucléoles sont parfois présents. Des mitoses (Fig. 16), et des remaniements inflammatoires (Fig. 10 et 17), hémorragiques ou nécrotiques (Fig. 18 et 19), parfois extensifs, et de l’aopoptose (Fig. 16–19) peuvent être observés. 7.2. Chordome chondroïde La matrice a un aspect chondroïde (Fig. 20), soit de fac¸on focale associée à des secteurs myxoïdes, soit très rarement dans l’ensemble de
Fig. 17. Remaniements inflammatoires lymphohistiocytaires massifs infiltrant la tumeur, surtout au niveau des septas. Lymphohistiocytic infiltrates of the tumor.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 18. Chordome comportant des foyers de nécrose (N) et des noyaux apoptotiques. Necrosis (N) and nuclear dust.
17
Fig. 21. Contingent cellulaire indifférencié, fusiforme d’aspect sarcomateux. Malignant chordoma showing sarcomatous features.
Fig. 22. Même plage que la Fig. 12 marquée avec l’anticorps anti-KL1 Parallel section of Fig. 12 showing KL1 immunopositivity. Fig. 19. Chordome comportant des foyers de nécrose (N) et des noyaux apoptotiques. Necrosis (N) and nuclear dust.
la tumeur. Cette forme à été considérée comme de meilleur pronostic, mais ceci ne semble pas confirmé actuellement : il semble bien que cette différence pronostique soit en fait liée à une confusion avec le chondrosarcome avant l’ère de l’immuno-histochimie. Le diagnostic différentiel est en effet très difficile sur la seule morphologie s’il n’y a pas de cellule physaliphore dans la lésion, ce qui peut arriver.
7.3. Chordome dédifférencié
Fig. 20. Chordome comportant une matrice purement chondroïde Chondroid chordoma containg cartilaginous matrix.
Par définition, c’est une tumeur biphasique comportant des secteurs de chordome bien reconnaissable et des secteurs de haut grade, soit indifférencié à cellules fusiforme soit sarcomateux (Fig. 21 et 22). Les deux composants peuvent être bien démarqués les uns des autres, soit il peut exister une transition progressive entre eux. Ils sont plus fréquents au niveau sacrococcygien ; ils représenteraient jusqu’à 9 % des chordomes. Ils surviennent le plus souvent au cours de l’évolution d’un chordome connu, soit spontanément soit après une irradiation, avec alors un délai assez coût de 3 à 5 ans, les différenciant d’une 2e tumeur radio-induite.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 18
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 23. L’anticorps anti-KL1 marque les cellules tumorale fusiformes et physaliphores. KL1 antibody stains physlipfhorus and spindle cells.
Fig. 24. Immunomarquage anti-Ki67 mettant en évidence un index de prolifération évalué à 40 %. Ki67 proliferative index greater than 40 %.
7.4. Immuno-histochimie Classiquement, le chordome est la seule tumeur qui présente une positivité pour les marqueurs épithéliaux, conjonctifs et par la protéine S100. Les pan-cytokératines (Fig. 22 et 23) et la cytokératine 19, l’EMA (epithelial-membrane antigen) et la vimentine sont quasi constamment exprimés, mais parfois seulement de fac¸on focale, ce qui peut poser problème sur une petite biopsie. Brachyurie [145] est un marqueur plus récent, très spécifique du chordome, bien qu’il soit aussi exprimé par les hémangioblastomes et certaines tumeurs testiculaires. Sa sensibilité est élevée, estimée à 90,2 % dans une étude de 51 chordomes [146], mais l’immunoréactivité peut être perdue après décalcification, comme cela est fréquent dans les marquages nucléaires. Dans les formes dédifférenciées, ces différents marquages sont perdus [145,146] : le diagnostic repose sur la coexistence de secteurs de chordome reconnaissable, ou sur l’histoire clinique. D’autres anticorps peuvent être utiles au diagnostic différentiel, ils seront vus à ce propos. 7.5. Facteurs pronostiques
Fig. 25. Tumeur bénigne à cellules notochordales : les cellules comportent un cytoplasme clair un noyau rond et central, petit sans atypie. Absence de matrice myxoïde. Benign notochordal cell tumor: tumoral cells with clear cytoplasms, small round nuclei, without myxoid matrix.
Les facteurs cliniques semblent les plus importants, déterminant la possibilité d’une exérèse carcinologique [154]. Différents éléments histopronostiques ont été proposés, mais n’ont pas à ce jour donnés de résultat probant, en dehors de l’aspect dédifférencié qui est associé à un pronostic plus péjoratif. Une étude [155] a montré une corrélation entre le temps de doublement tumoral déterminé en imagerie et à la fois l’existence de mitoses et un index de marquage supérieur à 6 % avec le Ki67, protéine nucléaire exprimée par les cellules en cycle de synthèse de l’ADN. Cependant, on constate une très grande hétérogénéité du marquage au sein d’une même tumeur (Fig. 24), et il n’est pas clair s’il faut tenir compte des zones de marquage maximal ou de la moyenne ; et se pose le problème de la représentativité des prélèvements en cas de biopsie. Le marquage est en outre perdu ou fortement diminué après décalcification. 7.6. Diagnostic différentiel 7.6.1. Tumeur bénigne à cellules notochordales Cette entité a aussi été appelée : restes notochordaux, hamartome notochordal, ecchordosis physalyphora. Bien que l’origine en reste controversée, ces entités sont actuellement regroupées ; les
Fig. 26. Tumeur bénigne à cellules notochordales : immunomarquage antiKL1 positif. Benign notochordal cell tumor showing KL1 immunopositivity.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 27. Méningiome chordoïde comportant des travées et des cordons de cellules éosinophiles souvent vacuolisées sur un fond myxoïde. Chordoid meningioma ressembling chordoma.
localisations préférentielles se superposent à celle du chordome. Des observations de TBCN située au contact d’un chordome suggèrent qu’il pourrait s’agir d’une forme bénigne de chordome [93]. Histologiquement, le diagnostic en est difficile sans notion clinique (Fig. 25 et 26). Les cellules ressemblent en effet aux adipocytes de la moelle, avec un cytoplasme clair généralement pourvu d’une seule grosse vacuole optiquement vide ; la position du noyau seule attire l’attention : il n’est pas constamment refoulé en bordure de la cellule comme dans un adipocyte, mais est souvent rond et central, petit sans aucune atypie. Quelques cellules peuvent ne pas avoir de vacuole, le cytoplasme est alors éosinophile. Les éléments forment des plages cellulaires sans aspect lobulé ni matrice myxoïde ; les travées osseuses sont raréfiées dans la lésion, parfois épaissies au pourtour. Des éléments hématopoïétiques peuvent être inclus dans la lésion. Le diagnostic repose sur l’immuno-histochimie : Cytokératine KL1 (Fig. 26), EMA et brachyurie (la S100 étant exprimée par les adipocytes) [86] (OMS, 2013). 7.6.2. Chondrosarcome En situation médiane, le diagnostic peut être difficile, notamment dans le cas des chondrosarcomes de grade 2 qui ont souvent des remaniements myxoïdes : là aussi, c’est l’immuno-histochimie qui tranchera, les chondrosarcomes n’exprimant pas les marqueurs épithéliaux ni brachyurie [147]. 7.6.3. Méningiome chordoïde Le diagnostic différentiel se pose surtout devant des localisations particulières, en effet, des chordomes intraduraux ont été décrits. Le méningiome chordoïde est fait de travées et de cordons de cellules éosinophiles souvent vacuolisées sur un fond myxoïde, dont l’aspect est très proche d’un chordome (Fig. 27 et 28). Cependant, cet aspect est rarement isolé, et le plus souvent ces zones sont dispersées au sein d’un méningiome de morphologie plus typique [156]. Ce type de méningiome est de grade 2 de l’OMS en raison de son risque élevé de récidive. Le diagnostic repose sur la recherche de l’expression de brachyurie, car les méningiomes expriment EMA et vimentine de fac¸on très constante, et fréquemment S100 et cytokératine [136]. 7.6.4. Métastase de carcinome et extension de cancer de voisinage La métastase osseuse d’un cancer rénal à cellules claires peut ressembler à un chordome, cependant le caractère hémorragique
19
Fig. 28. Méningiome chordoïde marqué avec un anti-récepteurs à progestérone. Chordoid meningioma showing progesterone receptor expression.
Fig. 29. Gliome chordoïde comportant des travées de cellules épithélioïdes sur un fond myxoïde. Chordoid glioma composed of cords of epithelioid cells separated by a myxoid background.
alerte généralement le chirurgien dès l’intervention ! Mais, rarement, un chordome peut être richement vascularisé. D’autres cancers peuvent avoir un contingent de cellules claires, notamment des cancers pulmonaires, ovariens, salivaires. En l’absence de notion d’une telle tumeur primitive, le diagnostic morphologique peut être difficile. L’extension d’une tumeur de voisinage peut également poser un problème difficile, surtout en localisation sacrée où le chordome peut envahir largement les structures de voisinage au moment du diagnostic, notamment le rectum. En cas de doute, c’est l’immuno-histochimie qui tranchera, les carcinomes n’exprimant généralement pas la S100 (on se rappellera que les cancers du rein et du poumon expriment la vimentine), et pas brachyurie [151]. 7.6.5. Gliome chordoïde Le problème est un peu théorique, cette tumeur siégeant électivement dans le 3e ventricule. La morphologie de ce gliome de bas grade est cependant trompeuse, réalisant des travées de cellules épithélioïdes, mais non vacuolisées, sur un fond myxoïde, avec souvent une inflammation par des éléments mononucléés (lymphocytes et plasmocytes) au contact.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
20
Fig. 30. Gliome chordoïde marqué avec l’anticorps anti-GFAP. Chordoid glioma immunostained by GFAP.
Fig. 32. Parachordome : cellules isolées, parfois vaculolisées sur un fond myxoïde. Parachordoma: isolated cells, sometime containg vacuoles within an abuundant myxoid extracellular matrix.
myoépithéliales, appelées également tumeurs mixtes ou tumeur chondromyxoïdes ectomésenchymateuses. Elles sont observées surtout dans les membres et les ceintures, plus rarement dans le tronc, la tête et le cou, plus souvent en sous-cutané que dans les tissus mous profonds. Elles sont de morphologie très pléomorphe, comme les tumeurs salivaires dont elles sont le pendant. Certaines ont des cellules épithélioïdes vacuolisées qui leur ont fait donner autrefois le nom de parachordome (Fig. 32). Comme le chordome, ces cellules expriment cytokératines, EMA et S100, mais n’expriment pas brachyurie ; environ 50 % expriment GFAP, comme de nombreuses tumeurs salivaires [161]. 7.7. Travaux en cours
Fig. 31. Épendymome myxopapillaire. Myxopapillary ependymoma.
La positivité de la GFAP fera le diagnostic, cet anticorps étant négatif dans le chordome. Il faut noter que le gliome chordoïde peut exprimer l’EMA [138,157] (Fig. 29 et 30). 7.6.6. Épendymome myxopapillaire Des localisations sous-cutanées de la région sacrococcygienne, présacrées et intra-sacrées peuvent se développer à partir de reliquats ectopiques d’épendyme. L’architecture papillaire, la vascularisation par de nombreux vaisseaux à paroi hyaline, l’aspect des cellules qui présentent des pieds vasculaires fibrillaires permet de penser au diagnostic qui sera confirmé par l’immuno-histochimie : positivité de la GFAP, négativité des cytokératines et de brachyurie [158,159] (Fig. 31). 7.6.7. À part : myoépithéliome/parachordome Il s’agit d’une entité un peu complexe pour des raisons historiques. Des chordomes ectopiques des tissus mous ont été décrits initialement sous le terme de chordoma periphericum en 1951 par Laskowski [96], puis ont été dénommés parachordome en 1977 par Dabska [97]. Les progrès de l’immuno-histochimie les ont ensuite démembrés : s’il existe d’authentiques chordomes des tissus mous, confirmés par le marquage avec brachyurie [160], ces lésions sont exceptionnelles, et la plupart des lésions des tissus mous ayant une morphologie de chordome sont en fait des tumeurs
Les chordomes primitifs et les récidives de 90 patients ont été revus à l’hôpital Lariboisière. Elles ont été classées sur le plan morphologique en tenant compte de l’architecture de la tumeur, de la différenciation y compris la présence d’un contingent peu différencié ou sarcomateux, du type de la matrice (chondroïde, myxoïde, mixte), des atypies cytonucléaires, du nombre de mitose, de la nécrose, d’une hémorragie et de l’inflammation. Les sous-types histologiques de 168 chordomes provenant de 86 patients primaires ou en récidive ont été analysés ; les chordomes récidivants conservaient globalement des formes histologiques comparables aux tumeurs primitives. Les sous-types histologiques étaient composés de 57,1 % de chordomes classiques avec prédominance nette du contingent myxoïde, 6,5 % de chordomes chondroïdes, 29,8 % de type mixte et 6,5 % de formes peu différenciées. Les tumeurs ont par la suite été étudiées par la méthode de TMA (Tissue MicroArray) pour la mise en évidence des facteurs pronostiques et des cascades moléculaires pouvant être la cible de thérapeutiques spécifiques. Nous avons tout d’abord utilisé les méthodes immuno-histochimiques, pour étudier l’index de prolifération (Ki67), l’accumulation de la protéine p53, et l’expression de l’EGFR, du STAT 3p, du VEGF et de la voie mTOR/PI3K. En parallèle, des études moléculaires visant à étudier les mutations d’EGFR et du p53 ont débuté. L’analyse des données ainsi que les corrélations histo-moléculaires avec les données cliniques sont en cours. Les résultats préliminaires montrent que les chordomes non récidivants ont un index de prolifération positif pour la moitié des patients évalué en moyenne de 7,2 %, et des écart-types très élevés. Pour ce qui concerne les tumeurs avec reprise évolutive et/ou les récidives locales et/ou à distance l’index est positif chez 70 % des patients, évalué en moyenne à 11,6 % avec des chiffres très variables.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
21
Fig. 33. Coupe TDM avec injection en axiale (A) et reconstructions sagittale médiane (B). Chordome lytique du clivus et du corps du sphénoïde. Calcifications centrales qui dans ce cas semblent correspondre à des fragments osseux résiduels au sein de la tumeur (flèches). Noter le refoulement de l’hypophyse normale en haut (tête de flèche). CT scanner axial (A) and sagittal (B) reconstruction slices: Osteolytic clival chordoma of the clivus and sphenoidal bone. Calcifications looking more like residual bony fragments inside the tumor (arrows). Notice the upwards shift of the normal pituitary gland (arrow head).
Il existe une expression de l’EGFR très variable d’un patient à un autre, chez plus de la moitié des patients. La recherche de mutation d’EGFR sur 1/3 des patients testés à ce jour selon la technique de pyroséquenc¸age n’a pas mis en évidence de mutation. 8. Radiologie–examens isotopiques 8.1. Imagerie radiologique (J.-P. Guichard) La TDM et l’IRM sont complémentaires au diagnostic et au bilan d’extension préthérapeutique des chordomes. 8.1.1. Chordomes du clivus Ils représentent en fréquence la deuxième localisation des chordomes [56,162]. 8.1.1.1. TDM. La TDM en reconstruction osseuse haute définition est essentielle pour déterminer l’extension intra-osseuse
(Fig. 33 et 34). Grâce aux acquisitions millimétriques il est possible d’obtenir des reconstructions multiplanaires de bonne qualité qui facilitent le bilan d’extension à la base du crâne. La lésion est le plus souvent centrée sur le clivus, médiane, proche de la synchondrose sphéno-occipitale ou sur le tiers supérieur ou inférieur du clivus [163]. La tumeur est expansive et ostéolytique détruisant les travées osseuses et les corticales. Elle est bien limitée, sans condensation osseuse périphérique. Elle est parfois calcifiée mais la nature de ces calcifications n’est pas univoque. Elles correspondent plus souvent à des fragments osseux résiduels au sein du chordome qu’à des calcifications de la matrice du chordome. Ces calcifications dystrophiques intratumorales seraient plus évocatrices de la forme chondroïde. En reconstruction parenchymateuse, la TDM est moins performante que l’IRM pour fixer les limites extraosseuses de la tumeur. Le chordome est globalement hypodense ou isodense par rapport au parenchyme adjacent. La densité est souvent hétérogène avec des zones tissulaires isodenses délimitant des zones
Fig. 34. Coupe axiale d’angio-TDM en reconstruction osseuse (A) et parenchymateuse (B). Lyse du clivus avec extension vers le sphénoïde et le canal carotidien (tête de flèche). La tumeur est au contact de la carotide interne qui est de calibre normal (flèche). AngioCT scanner axial view with bone (A) and parenchymal (B) windows. Osteolysis of the clivus with tumoral extension towards the sphenoidal bone and carotid artery canal (arrow head). Tumor is in contact with the internal carotid artery without stenosis (arrow).
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 22
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 35. Coupe IRM sagittale T1. Chordome du clivus envahissant la citerne prépontique. Zones d’hypersignal spontanées (flèches) au sein d’une masse en isosignal. MRI T1 sagittal view without contrast. Clivus chordoma with extension into the prepontine cistern. Zones of hypersignal into an isosignal tumoral mass.
hypodenses correspondant à une portion kystique contenant du matériel myxoïde ou de la nécrose. Après injection intraveineuse de produit de contraste, les portions tissulaires se rehaussent contrairement aux zones spontanément hypodenses qui ne se rehaussent peu ou pas du tout. L’angio-TDM permet de déterminer la position des vaisseaux par rapport à la tumeur [164] et de juger du développement des anastomoses intracrâniennes avant un éventuel test d’occlusion artérielle. Les données de la TDM sont également utilisées pour la chirurgie assistée par ordinateur isolément ou en fusion avec les données de l’IRM [165,166]. 8.1.1.2. IRM. Par sa meilleure résolution tissulaire, l’IRM (Fig. 35–46) est complémentaire de la TDM pour déterminer l’extension intracrânienne et vers la face. Ainsi, l’IRM avec injection de gadolinium et la TDM en résolution osseuse sont le couple de choix dans l’exploration des chordomes. En IRM, le chordome est bien limité [163,167]. Son signal en T1 est intermédiaire ou en hyposignal et se détache nettement
Fig. 37. Coupe axiale IRM de type myélographique. Chordome intradural. Sur cette séquence, la tumeur est délimitée par l’hypersignal du LCS (A) (têtes de flèche). Insertion osseuse de la tumeur (flèche blanche) par rapport aux nerfs VI (flèches noires) et au tronc basilaire (B). Myelographic MRI axial view. Intradural chordoma. The tumor is delineated by the hypersignal of the CSF (A) (arrow head). Notice (B) the bony attachment (white arrow), the VI cranial nerves (black arrows) and the basilar trunk.
de l’hypersignal spontané de la graisse du spongieux osseux. Des hypersignaux T1 spontanés intratumoraux évoquent la présence d’hémorragie, de matériel mucoïde, de résidus osseux ou de calcifications. La caractéristique essentielle de la tumeur est son hypersignal T2 intense correspondant à sa composition riche en eau. L’hypersignal est globalement intense avec des septums de signal moins intense. Cette forme multilobulée traduit la disposition lobulaire des amas cellulaires séparés par des septums. Il peut également exister des zones d’hyposignal T2 correspondant à des hémorragies, des zones de matériel mucoïde ou des calcifications. Les hémorragies intratumorales sont mieux vues sur les séquences T2 en écho de gradient. Afin de différencier l’hypersignal de la tumeur de celui de la graisse, il convient d’utiliser une séquence T2 avec suppression du signal de la graisse. Sur les séquences T1 après injection de gadolinium, l’aspect multilobulé caractéristique de la tumeur est retrouvé sous forme d’un rehaussement modéré en rayon de miel des septums entourant des zones de faible rehaussement correspond à des zones de nécrose ou de matériel mucoïde. La suppression du signal de la graisse après
Fig. 36. Coupes IRM axiales en T1 (A), T2 (B) et T1 avec injection de gadolinium (C). Chordome du clivus avec extension intradurale. En T1, la lésion est en isosignal avec des zones d’hyposignal (astérisque). En T2, la lésion est en hypersignal intense, polylobée, les nodules sont entourés de septums en hyposignal (tête de flèche. Après injection, les portions les plus charnues se rehaussent délimitant des zones de rehaussement moins intenses correspond à des zones de nécrose ou de matériel mucoïde donnant un aspect en nid d’abeille. MRI axial T1 (A), T2 (B) and T1 with contrast (C) views. Clivus chordoma with intradural extension. In T1, isosignal mass with hyposignal zones (asterisk). In T2, hypersignal mass with lobules separated by hyposignal septa (arrow head). Contrast enhancement with gadolinium with less enhanced parts corresponding to necrosis or mucoïd zones (honeycomb features).
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
23
des problèmes de diagnostic différentiel avec le chondrosarcome [169]. Les formes purement intradurales [49] se développent dans la citerne prépontique. Il n’existe pas toujours de lyse du clivus. Les séquences fortement pondérées en T2 submillimétriques de type myélographique ont deux intérêts, le repérage du segment intracisternal des nerfs crâniens par rapport à la tumeur et la délimitation des contours intraduraux de la tumeur. En effet, sur ces séquences la tumeur est en hyposignal et se détache parfaitement de l’hypersignal du liquide céphalorachidien alors que sur les séquences T2 classiques, l’hypersignal de la tumeur se confond à celui du LCS. Enfin, récemment, l’intérêt des séquences de diffusion a été souligné dans le diagnostic différentiel des chordomes [170]. En effet, en raison de la différence de cellularité, les valeurs de l’ADC sont plus basses dans les chordomes que dans les chondrosarcomes. En angio-IRM, le déplacement des vaisseaux et l’englobement des carotides et du tronc basilaire sont courants. Les sténoses ou occlusions artérielles sont rares, car les chordomes ont une structure molle et sont non agressifs pour les vaisseaux. Enfin, les séquences d’angio-IRM veineuses permettent de déterminer la latéralisation du retour veineux et les éventuels retentissements de la tumeur sur le retour veineux cérébral.
Fig. 38. Coupe IRM axiale T1 en saturation de graisse. Chordome du clivus envahissant le sphénoïde, l’ethmoïde (tête de flèche) et les deux sinus caverneux (flèches). Rehaussement élevé et hétérogène de la tumeur. MRI T1 axial view with fat suppression. Clivus chordoma invading the sphenoid, the ethmoid (arrow head) and both cavernous sinus (arrows). Marked heterogeneous tumoral enhancement.
injection de produit de contraste permet de mieux différencier la composante de signal élevé de la tumeur de celui de la graisse adjacente. Les séquences d’IRM dynamiques [168] montrent une courbe de rehaussement progressif et sans pic. Les formes chondroides sont de signal T1 plus intense et en T2 moins intense en raison du contenu en eau moins important. La prise de contraste est plus marquée. Le point de départ est plus latéral, développé sur la face postérieure de l’apex pétreux, ce qui pose
8.1.1.3. Artériographie conventionnelle. Le chordome est une tumeur avasculaire ou très peu vasculaire. L’artériographie confirme les déplacements vasculaires et le calibre de la lumière artérielle vus en angio-TDM et angio-IRM. Son intérêt est surtout de réaliser un test d’occlusion ou une occlusion définitive afin de faciliter l’exérèse de chordome englobant les vaisseaux. 8.1.1.4. Extension locale. Le chordome se développe à partir des résidus de la notochorde qui sont enchâssés dans le spongieux de l’os. La lésion va progressivement lyser les travées osseuses pour enfin rompre la corticale et s’étendre secondairement aux structures adjacentes [171]. Vers l’avant, la tumeur envahit le sinus sphénoïdal puis les fosses nasales et l’ethmoïde. Plus bas, la lésion se développe dans l’espace prérachidien antérieur et bombe dans le nasopharynx et l’oropharynx.
Fig. 39. Coupe IRM axiale T1 (A) et sagittale T1 avec injection (B). Chordome du clivus envahissant les parties molles prérachidiennes et bombant dans le nasopharynx. On voit la graisse de l’espace rétropharyngé refoulée en avant (flèches blanches). Envahissement de la masse latérale droite de C2. La muqueuse du nasopharynx est normale (tête de flèche). MRI axial T1 and sagittal T1 views with contrast. Clivus chordoma invading the soft tissues of the pharynx. Fat in the retropharyngeal space is pushed forwards (white arrows). The C2 right lateral mass is invaded. The pharyngeal mucosa is intact (arrow).
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 24
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 40. Coupe IRM axiale T1 (A) et T2 (B). Chordome du clivus envahissant les apex pétreux en arrière des portions horizontales des carotides intrapétreuses (astérisques), en intradural l’angle pontocérébelleux droit, le cavum de Meckel droit et gauche et les sinus caverneux englobant la carotide interne droite qui reste de calibre normal (flèche). MRI T1 and T2 axial views. Clivus chordoma invading on both sides the petrous apex behind the horizontal segment of the internal carotid arteries (asterisks). Extension to the right cerebello-pontine angle, the Meckel cave on both sides and both cavernous sinus embedding the internal carotid artery (arrow).
Latéralement, la tumeur envahit l’apex pétreux et le canal carotidien dans leurs portions verticale et horizontale intrapétreuses. La tumeur peut s’étendre après avoir lysé la paroi postérieure de l’os pétreux dans l’angle pontocérébelleux. L’extension inférieure et latérale se fait vers le foramen jugulaire et le canal condylien et plus latéralement vers le condyle occipital. La lésion peut lyser les vertèbres C1 et C2 et envahir le foramen magnum. En arrière, la tumeur refoule dans un premier temps la dure-mère pour ensuite la rompre et se développer en intradural dans la citerne prépontique refoulant le tronc basilaire et le tronc cérébral. La lésion peut entraîner une indentation sur le tronc cérébral. Le 4e ventricule est parfois comprimé entraînant une hydrocéphalie.
Plus bas, la lésion arrive au contact des artères vertébrales dans leur segment V4. Vers le haut, la lésion envahit la selle turcique et refoule la glande hypophysaire en haut et en avant pouvant déborder dans la citerne opto-chiasmatique pour arriver au contact du chiasma optique et du plancher du 3e ventricule. Plus latéralement, elle envahit les sinus caverneux et la fosse temporale intracrânienne. Les coupes sagittales et axiales perpendiculaires au clivus sont les plus intéressantes pour déterminer les limites antérieure et postérieure de la tumeur. Les coupes axiales et coronales sont plus utiles dans l’extension latérale aux sinus caverneux, à la citerne opto-chiasmatique et à la face. Les angles de raccordement de la tumeur par rapport à la dure-mère et la séquence T2 de type myélographique permettent de prédire l’envahissement intradural [172].
Fig. 41. Coupe IRM sagittale T2 (A) et axiale T2 (B). Chordome du clivus envahissant le sphénoïde, la selle turcique et la citerne opto-chiasmatique. Notez la fine ligne correspondant à la dure-mère refoulée mais non rompue (flèches) et l’angle de raccordement obtus (tête de flèche). À l’intervention, la dure-mère était distendue mais non rompue. MRI T2 sagittal (A) and T2 axial (B) views. Clivus chordoma invading the sphenoid, the sella turcica and the opto-chiasmatic cistern. Notice the thin line corresponding to the shifted but intact dura mater (arrows) and its obtuse-angled connection to the bone (arrow head); this was confirmed during the surgery.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
25
Le bilan préthérapeutique doit particulièrement s’attacher à déterminer la proximité de la tumeur des structures nerveuses sensibles pour la radiothérapie comme le chiasma optique et le tronc cérébral. 8.1.1.5. Extension à distance. Bien que le chordome soit essentiellement une tumeur à malignité locale, il peut donner des métastases. Les localisations à distance sont de trois types, soit par dissémination cérébrospinale [76] soit par voie lymphatique vers les ganglions cervicaux soit enfin par voie hématogène [174] dans le foie, le poumon, l’os et la peau. La découverte de ces métastases semble actuellement plus fréquente en raison de l’augmentation de l’espérance de vie apportée par les nouveaux traitements. Le signal IRM des métastases est superposable à celui de la tumeur primitive. 8.1.1.6. Diagnostic différentiel. Les diagnostics différentiels des chordomes du clivus sont multiples, nous ne détaillerons que les plus importants [175].
Fig. 42. Coupe IRM axiale T2. Chordome du clivus avec envahissant intradural. La dure-mère normale n’est pas visible. Le tronc basilaire est englobé dans la tumeur (flèche). Le tronc cérébral est refoulé et déformé (tête de flèche). MRI T2 axial view. Clivus chordoma with intradural extension. The dura cannot be identified. The basilar trunk is encased by the tumor (arrow). The brain stem is severely compressed (arrow head).
En effet, lorsque la tumeur reste extradurale, l’angle de raccordement avec la dure-mère est obtus et la dure-mère est visualisée sous forme d’un fin liseré continu en hyposignal T2. Pour l’extension osseuse ou aux régions profondes de la face, le T1 avec suppression de graisse permet de différencier le rehaussement de la tumeur du signal de la graisse. En cas de récidive post-thérapeutique, les extensions se font parfois dans des sites anatomiques moins classiques avec notamment une dissémination le long de la voie d’abord opératoire [173].
8.1.1.7. Ecchordosis physaliphora (EP). Cette tumeur bénigne dérivée de la notochorde est localisée en arrière du clivus dans l’espace prépontique en intradural. Elle est toujours de petite taille, inférieure à 2 cm, de contours réguliers [33]. Sa détection en TDM est pratiquement impossible en raison de sa taille, des artéfacts nombreux dans la fosse postérieure et de sa densité équivalente à celle du LCS. Un pédicule osseux relie parfois la tumeur au clivus. En IRM, la lésion est un peu plus en hypersignal en T1 et T2 que le LCS. Elle est parfois difficile à différencier en T2 par rapport aux artefacts de flux de LCS des citernes de la base. Le signal est homogène. Les séquences T2 Flair et les séquences CISS ont un meilleur rendement dans le dépistage de ces lésions. L’EP ne se rehausse pas après injection de gadolinium en raison de la pauvreté de son contingent vasculaire. Il n’existe pas de critère formel pour différencier EP et chordome de développement intradural pur [53]. Les arguments diagnostiques en faveur de l’EP sont la découverte fortuite, la petite taille, l’absence de lyse osseuse et l’absence de rehaussement après injection de gadolinium. Le pont osseux n’est pas retrouvé dans les autres lésions rétroclivales et reste typique de l’ecchordosis physaliphora.
Fig. 43. Coupe IRM sagittale T1 (A) et T1 avec injection de gadolinium (B). Chordome du clivus envahissant la selle turcique et la citerne opto-chiasmatique. La glande hypophysaire normale est retrouvée en avant (flèche). Refoulement du tronc cérébral et du plancher du 3e ventricule (tête de flèche). MRI T1 sagittal views with (A) and without contrast (B). Clivus chordoma invading the sella and the opto-chiasmatic cistern. The pituitary gland is normal and displaced forwards (arrow). The brain stem and third ventricle are shifted (arrow head).
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 26
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 44. Coupe IRM axiale T2 sur le clivus (A) et axiale T2 cervicale (B). Chordome du clivus envahissant l’apex pétreux gauche (tête de flèche). Adénopathies cervicales métastatiques de même signale que la tumeur principale (flèches). MRI T2 axial view of the clivus and T2 axial view of the cervical spine. Clivus chordoma invading the left petrous apex (arrow head). Lymphatic nodes metastases in the neck with similar signal as the clival tumor (arrows).
8.1.1.8. Tumeur bénigne à cellule notochordale intra-osseuse (BNCT). Cette lésion est le plus souvent de découverte fortuite, siégeant dans le clivus [176]. À l’examen TDM, la lésion présente une ostéosclérose périphérique sans destruction de la trame osseuse qui présente plutôt des épaississements trabéculaires. En IRM la lésion est en hypersignal homogène T2 et en hyposignal homogène en T1. Il n’existe aucun rehaussement après injection de gadolinium. La lésion est bien limitée sans lyse des corticales et sans extension intradurale.
8.1.1.9. Adénome hypophysaire invasif. En TDM, la tumeur lyse le plancher sellaire et le corps du sphénoïde. En IRM, elle est en isosignal T1 par rapport à la substance grise et se rehausse de fac¸on intense et hétérogène après injection de contraste. L’argument important est que l’hypophyse normale n’est pas individualisable contrairement aux chordomes envahissant la selle turcique pour lesquels l’hypophyse normale est retrouvée refoulée en haut et en avant. L’extension rétroclivale intradurale n’est pas habituelle dans les adénomes. 8.1.1.10. Dysplasie fibreuse. Dans sa forme kystique, la dysplasie fibreuse entraîne un aspect soufflé et élargi du clivus en hypersignal T2 intense. La TDM retrouve cependant en périphérie l’aspect caractéristique des modifications de la trame osseuse en verre dépoli et le respect des corticales osseuses. 8.1.1.11. Chondrosarcome. Le point de départ est plus latéral centrée sur la suture pétro-occipitale et sphénopétreuse [177,178]. La lyse osseuse et le signal en IRM sont proches de ceux du chordome. La prise de contraste est variable en fonction du type histologique parfois intense. Les calcifications de type chondroïde sont courantes. Les séquences de diffusion semblent pouvoir différencier les deux tumeurs. Les chondrosarcomes avec une cellularité supérieure présentent un coefficient de diffusion plus élevée que celui des chordomes [179]. 8.1.1.12. Méningiome clival. Le point de départ est méningé. La TDM montre une hyperostose au niveau de l’insertion et de l’envahissement osseux. En IRM, le signal T1 et T2 sont différents de celui des chordomes. La prise de contraste est intense avec un raccordement et un épaississement de la méninge bien visibles après injection.
Fig. 45. Coupe IRM sagittale T2 de type myélographique. Ecchordosis physalifora, découvert à l’occasion d’un épisode de rhinorrhée compliqué de méningite. Formation rétroclivale intradurale (tête de flèche) associée à une méningocèle sphénoidale (flèche). Myelographic MRI T2 sagittal view. Ecchordosis physaliphora, discovered after a CSF leak and a meningitis presenting as an intradural mass (arrow head). Notice the sphenoidal méningocele (arrow).
8.1.1.13. Plasmocytome. C’est une masse lytique unique mal limitée, sans sclérose marginale. Il n’y a pas de calcifications intratumorales. Le signal T2 n’est pas aussi intense que celui des chordomes et le rehaussement après injection est plus marqué. 8.1.1.14. Métastases du sphénoïde. C’est la cause la plus fréquente de tumeur osseuse. Les lésions primitives sont les cancers du sein, du poumon et de la prostate.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
27
Fig. 46. Coupe IRM sagittale T1 (A) et T2 (B). Chordome des dernières pièces sacrées et du coccyx. En T1, la lésion est en discret hyposignal par rapport aux muscles avec extension dans les espaces sacrés et épiduraux. En T2, la lésion est lobulée en hypersignal intense, contenant des zones d’hyposignal correspondant aux septums. Notez la vertèbre L4 hémangiomateuse. MRI T1 (A) and T2 (B) sagittal views. Chordoma of the caudal part of the sacrum and of the coccyx. In T1, hyposignal as compared to the muscles; in T2, lobulated hypersignal mass with hyposignal zones corresponding to septa. Notice an hemangioma in the L4 vertebra.
La tumeur est mal limitée, infiltrante. Le signal n’est pas aussi intense que celui des chordomes et le rehaussement différent. Les localisations multiples sont courantes et détectées par scintigraphie osseuse. 8.1.1.15. Tumeur du nasopharynx envahissant le sphénoïde. Le point de départ de la tumeur est le nasopharynx, la muqueuse normale n’est pas retrouvée. Les adénopathies cervico-faciales sont courantes, notamment les adénopathies rétropharyngées. 8.1.1.16. Paragangliome. Dans cette localisation, il s’agit d’extension de paragangliomes jugulaire ou tympanique. L’origine de la lésion est latérale centrée sur le foramen jugulaire ou la caisse du tympan. L’atteinte osseuse en TDM est caractéristique avec lyse et infiltration donnant un aspect mité de l’os. L’hypervascularisation de la tumeur est retrouvée sous l’aspect d’hyposignaux en vide de signal au sein de l’hypersignal de la tumeur avec un aspect sel et poivre caractéristique. Sur les angioIRM et les séquences dynamiques, le rehaussement est intense et précoce [180]. 8.1.2. Chordomes de localisation non clivale Les autres localisations crâniennes sont beaucoup plus rares. Il s’agit des sinus de la face et des fosses nasales [181], du nasopharynx [182], du foramen jugulaire [183], du rocher [184] et de la voûte du crâne. Le diagnostic est fait sur la biopsie ou l’examen de la pièce opératoire dans ces localisations atypiques et inattendues. 8.1.3. Chordomes du rachis Dans cette localisation, le couple TDM et IRM est également le couple de choix dans l’exploration. 8.1.3.1. Chordomes du sacrum. Le sacrum est la localisation préférentielle des chordomes. C’est la tumeur primitive du sacrum la plus fréquente [185,186]. 8.1.3.1.1. Radiographies standard. Le chordome touche les dernières pièces sacrées ou le coccyx. Le premier étage sacré est
généralement respecté. Le chordome est responsable d’une ostéolyse médiane ou paramédiane centrée sur un trou sacré. De profil, il existe dans presque tous les cas une opacité des parties molles pré-sacrées, refoulant la clarté rectale. 8.1.3.1.2. TDM. La lyse du sacrum est de forme lobulaire avec extension secondaire dans les espaces pré- et postsacré [187]. La tumeur est hypodense souvent volumineuse au moment du diagnostic. L’hypodensité de la tumeur traduit le contenu myxoïde de la tumeur riche en eau. Il peut exister au sein de la masse des parties molles des calcifications, qui seraient plus fréquentes dans le chordome chondroïde. 8.1.3.1.3. IRM. Le chordome est lobulé, avec extension dans les espaces sacrés et épiduraux [188]. En T1, la lésion est en discrète hyposignal par rapport aux muscles. Il existe des zones d’hypersignal correspondant à des hémorragies ou un contenu mucineux. En T2, la tumeur est en hypersignal T2 intense, hétérogène avec des zones d’hyposignal qui correspondent aux zones d’hypersignal T1. Après injection de produit de contraste, la lésion est modérément rehaussée et hétérogène. 8.1.3.1.4. Diagnostic différentiel. 8.1.3.1.4.1. Tumeur à cellules géantes. C’est par ordre de fréquence la deuxième tumeur du sacrum [189]. La tumeur débute à la portion supérieure du sacrum et peut s’étendre latéralement passant au-delà de l’articulation sacro-iliaque jusque dans l’aile iliaque. Le signal IRM en T2 est beaucoup moins intense que celui des chordomes en raison de la présence de tissus fibreux au sein de la tumeur. Il existe parfois des zones kystiques avec un niveau liquide dû à l’association d’un kyste anévrismal. 8.1.3.1.4.2. Chondrosarcomes. Ils naissent latéralement à partir du cartilage de l’articulation sacro-iliaque. Il présente un hypersignal T2 hétérogène en raison de l’association de leur composante cartilagineuse et minéralisée. Il ne présente pas de composante hémorragique intratumorale ce qui permet de les différencier des chordomes. 8.1.3.1.4.3. Épendymome myxopapillaire. Ils peuvent entraîner une destruction osseuse du sacrum, mais le point de départ est intradural et l’atteinte osseuse est secondaire [190].
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 28
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 47. Coupe TDM axiale avec injection. Chordome cervical C4. Élargissement du foramen de conjugaison et masse intracanalaire pouvant évoquer une tumeur nerveuse (astérisque). La vertébrale est refoulée (flèche). CT scanner axial view with contrast. Cervical chordoma at C4. Enlargement of the intervertebral foramen and intraspinal extension simulating a dumb-bell schwannoma (asterisk). The vertebral artery is shifted (arrow).
Leur rehaussement après injection est beaucoup plus intense que celui des chordomes. 8.1.3.2. Chordome du rachis mobile. La lésion prédomine en cervical, lombaire puis thoracique. La tumeur est en hypersignal par rapport aux disques [191]. 8.1.3.2.1. Radiographies standard. Le chordome réalise typiquement une lyse osseuse polylobée du tiers postérieur du corps vertébral correspondant à la topographie du canal chordal. Il peut s’étendre à plusieurs vertèbres contiguës, en respectant les disques. 8.1.3.2.2. TDM. L’extension de la masse dans les parties molles est souvent importante. En cervical la tumeur peut présenter un développement en sablier dans un trou de conjugaison élargi simulant une tumeur nerveuse. Il présente une sclérose périlésionnelle et des calcifications amorphiques intratumorales. Après injection, le rehaussement est modéré, hétérogène avec des zones sans rehaussement (Fig. 47). 8.1.3.2.3. IRM. L’IRM montre l’aspect de la tumeur et ses extensions intra- et extraosseuses. Les contours de la masse sont réguliers avec parfois un aspect de pseudocapsule en hyposignal sur toutes les séquences. L’extension se fait aux régions paravertébrales et à l’espace épidural avec compression médullaire ou radiculaire. Le chordome est plurilobé, en isosignal ou hyposignal en T1. En T2, il est en hyperintense par rapport au LCS et aux disques intervertébraux avec des septums hypodenses (Fig. 48 et 49). Le rehaussement est variable [192]. La séquence de diffusion [193] est un argument diagnostic important du diagnostic différentiel avec hypersignal en diffusion et un ADC élevé. 8.1.3.2.4. Diagnostic différentiel. Les diagnostics différentiels sont nombreux [194,195]. La biopsie guidée sous TDM aide au diagnostic en raison du manque de spécificité des lésions. Nous décrirons les principales lésions pouvant poser un problème de diagnostic différentiel. 8.1.3.2.4.1. Tumeur bénigne à cellule notochordale intra-osseuse et intravertébrale (BNCT). Elle est le plus souvent de découverte fortuite. Les formes étendues sont parfois découvertes à l’occasion de douleurs. À l’examen TDM, la lésion réalise une ostéosclérose sans destruction de la trame osseuse qui présente plutôt des épaississements trabéculaires. La lésion est bien limitée sans lyse des corticales et
sans extension en dehors de la vertèbre. Elle peut occuper la moitié du corps de la vertèbre. En IRM, la lésion est en hypersignal homogène T2 et en hyposignal homogène en T1. Il n’existe aucun rehaussement après injection de gadolinium. Le diagnostic différentiel avec les chordomes repose sur la destruction osseuse extensive dépassant les corticales avec invasion des parties molles. La lésion ne se rehausse pas après injection de gadolinium [90]. Le développement de chordome à partir de cette tumeur bénigne a été rapportée [93]. 8.1.3.2.4.2. Hémangiome vertébral. En TDM, la vertèbre hémangiomateuse est striée verticalement en raison de l’élargissement des travées osseuses. La localisation des hémangiomes agressifs est plutôt dorsale. Ils présentent des plages lytiques étendues avec atteinte de l’ensemble du corps vertébral et de l’arc postérieur, destruction des corticales et extension épidurale et dans les parties molles. Le contenu est plus tissulaire que graisseux [196]. En IRM lorsqu’elle est tissulaire, la lésion est en hyposignal T1, et en hypersignal T2. La portion charnue se rehausse intensément après injection. 8.1.3.2.4.3. Chondrosarcome. Le chondrosarcome rachidien se développe plus souvent à partir de l’arc postérieur que du corps vertébral. Il peut se développer à partir d’une exostose dégénérée. Il entraîne une lyse osseuse avec extension dans les parties molles associée à des calcifications en motte. En IRM, la lésion est polylobée en hyposignal T1 et hypersignal T2 avec des septums et des contours en hyposignal. Les calcifications sont en hyposignal. La prise de contraste est périphérique et arciforme correspondant à des cloisons fibrovasculaires entourant des lobules cartilagineux. La courbe d’intensité de prise de contraste est exponentielle. 8.1.3.2.4.4. Plasmocytome solitaire. L’image caractéristique est celle d’une lyse du corps vertébral, multikystique, comprenant des cloisons osseuses verticales délimitant des plages d’ostéolyses ovalaires à grand axe vertical respectant longtemps les corticales. Parfois, l’aspect rappelle celui d’un angiome ou d’une métastase. La lésion présente un hyposignal en T1, une prise de contraste modérée et homogène en T1 avec injection de gadolinium et un hypersignal intense et homogène en T2. L’IRM confirme le caractère unique de la lésion et apprécie l’extension tumorale dans le canal rachidien. 8.1.3.2.4.5. Tuberculose rachidienne. L’infection tuberculeuse est à point de départ vertébral sans spondylodoscite. La lésion entraîne une géode centrosomatique plus ou moins entourée de condensation osseuse. L’abcès des parties molles et plus ou moins volumineux et se développe dans les espaces périrachidiens atteignant plusieurs vertèbres. En IRM, la lésion est discrètement en hypersignal en T1, en hypersignal T2 et les collections abcédées se rehaussent en périphérie. La perfusion en TDM [197] aide à différencier la tuberculose des tumeurs malignes en montrant un rBF et un rBV plus élevé dans la pathologie tumorale que dans la pathologie infectieuse et inflammatoire. 8.1.3.2.4.6. Métastase. Elles sont extrêmement fréquentes. La TDM précise l’étendue de la lyse osseuse qui peut s’étendre dans les pédicules. En IRM, le signal n’est pas spécifique. La lésion est en hyposignal T1, hypersignal variable en T2 avec une prise de contraste hétérogène. L’IRM apprécie l’extension épidurale et dans les parties molles ainsi que la présence d’éventuelles localisations multiples. 8.1.3.2.4.7. Lymphome. L’aspect est variable. Il s’agit le plus souvent d’une masse ostéolytique perméative envahissant les parties molles. Des formes condensantes et mixtes sont possibles. Une ostéolyse modérée associée à un envahissement marqué des parties molles sont évocateurs. L’IRM précise l’extension extraosseuse, la lésion est en hyposignal T2.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
29
Fig. 48. Coupe IRM sagittale T2 (A) et coronale T1 avec injection de gadolinium et saturation de graisse (B). Même patient que la Fig. 15. Le chordome est plurilobé, hyperintense en T2 (tête de flèche) par rapport au LCS et aux disques intervertébraux avec des septums hypodenses. Il s’étend aux vertèbres contiguës (flèches). La prise de contraste est nette. MRI T2 sagittal view (A) and T1 coronal view with contrast and fat suppression (B). Same patient as Fig. 15. Hyperintense mass (arrow head) in T2 as compared to the CSF and discs; Multiple lobules separated by hypointense septa. Extension to the adjacent vertebrae (arrows). Notice the marked contrast enhancement.
8.1.4. Surveillance post-thérapeutique La surveillance est basée sur l’IRM, quelle que soit la localisation. Les séquences T2 avec suppression du signal de la graisse détectent l’hypersignal de la récidive tumorale. La comparaison avec l’imagerie initiale et la connaissance du type de traitement réalisé sont fondamentales pour comprendre l’aspect postopératoire. Le site initial de la tumeur doit être exploré ainsi que l’ensemble de la voie d’abord chirurgicale.
L’aspect des chordomes est assez évocateur dans ses localisations classiques, ce qui permet d’évoquer le diagnostic dans la plus grande majorité des cas avant la biopsie. Le chordome entraîne une lyse osseuse régulière sans condensation périphérique avec lyse des corticales. L’IRM est caractéristique avec un aspect polylobé, en hypersignal T2 intense et un rehaussement en rayon de miel après injection de gadolinium. 8.2. Imagerie isotopique (M. Duet)
8.1.5. Conclusion L’exploration des chordomes repose sur le couple complémentaire TDM et IRM.
L’intérêt des examens isotopiques dans la prise en charge des chordomes paraît assez maigre car globalement il s’agit de lésions
Fig. 49. Coupes sagittales T2 parasagittale (A) et sagittale médiane (B). Récidive locale d’un chordome du clivus et par dissémination peropératoire sur la fixation cervicale postérieure (flèche). Récidive cervicale par diffusion intracanalaire avec syringomyélie (têtes de flèche). MRI T2 sagittal paramedian (A) and median (B) slices. Recurrence of a clivus chordoma and intra-operative seeding on the posterior cervical instrumentation (arrow). Intradural seeding with syringomyelia at the cervical level (arrow heads).
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 30
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
ostéolytiques, ne fixant pas ou peu en scintigraphie comme en TEP ; néanmoins, ils peuvent être de quelque utilité dans le diagnostic différentiel, le suivi et parfois le traitement. 8.2.1. Scintigraphie monophotonique D’une fac¸on générale, l’apport de la scintigraphie osseuse classique, réalisée grâce à un biphosphonate marqué au 99 Tc, dans le diagnostic de ces tumeurs ostéolytiques est faible, la fixation y étant presque toujours nulle ou très faible. Seuls quelques cas fixant le traceur ont été rapportés, probablement du fait de calcifications ou d’une ostéocondensation peri-tumorale. Trikha [570] publie un cas de chordome sacré fixant le 99 Tcbiphosphonate. Kendall [198], en 1977, observe 5 cas positifs dans une série de 44 chordomes. Rossleigh [571] examine 16 tumeurs sacrées dont 5 chordomes parmi lesquels un seul fixe modérément le traceur. L’intérêt de ce traceur est donc essentiellement de différencier le chordome de tumeurs osseuses ostéocondensantes primitives ou secondaires, notamment rachidiennes. En revanche, il ne permet pas un diagnostic différentiel avec le plasmocytome, lésion ostéolytique qui fixe peu ou pas le 99 Tc-biphosphonate. Enfin, l’indice de fixation observé dans les ostéosarcomes est variable selon le grade, faible pour les bas grades et souvent élevé pour les hauts grades. D’autres marqueurs utilisés en pathologie tumorale ont été testés : l’111 In-pentétréotide, permettant une scintigraphie des récepteurs de la somatostatine et couramment utilisé dans le bilan des tumeurs neuro-endocrines [572,573], le 201 Tl [574] dont la captation dépend de la pompe Na-K-ATPase et reflète ainsi la charge de tumeur viable. Ce traceur permet de différencier radio-nécrose et récidive, et a été utilisé pour établir le grade de tumeurs cérébrales, le gallium-67 [575] autrefois utilisé dans la définition du stade et de la prise en charge de lymphomes malins (hodgkiniens ou non). Aucun de ces traceurs n’a été d’un quelconque intérêt dans la prise en charge des chordomes. 8.2.2. TEP-scan Le 18 FDG, dont la captation traduit l’existence de cellules métaboliquement actives, a été le plus couramment utilisé. Les résultats de cette imagerie TEP ont été décevants, la captation du traceur étant majoritairement faible voire nulle. Son intérêt là encore réside dans le diagnostic différentiel entre chordome (captation nulle) et métastase (captation intense et parfois lésions multiples). Néanmoins, quelques cas de chordomes se sont révélés positifs au 18 FDG-TEP-scan. Ainsi Miyazawa [576] présente un cas de chordome thoracique chez un patient de 73 ans positif au 18 FDG lors du diagnostic initial, mais aussi lors de la récidive 7 mois plus tard. À cette date l’auteur souligne que, dans la littérature, seul un cas des 12 chordomes explorés par cette technique était positif. Park, en 2008 [577], rapporte également un cas de chordome sacré chez une femme de 52 ans, détecté au 18 FDG-TEP-scan sous la forme d’une fixation hétérogène peu intense. Nishiguchi et al. [93] décrivent un cas de chordome associé à une BNCT fixant le 18 FDG et dont l’intensité a diminué après radiothérapie au 11 C. Ferraresi [578] mentionne que 2 des 10 patients traités par imatinib avaient une fixation initialement élevée, qui avait diminué sous traitement. Casali et al. [199] sont les seuls à présenter une série de 6 chordomes (5 sacrés et un clival) qui tous fixaient le 18 FDG lors du bilan initial. Ces résultats positifs pourraient traduire une agressivité particulière des chordomes explorés dans cette étude. Par ailleurs, tous ont montré une diminution de la fixation sous traitement par imatinib. Ces études soulignent l’intérêt potentiel de la technique, si ce n’est à titre systématique, tout au moins dans le bilan initial de tumeurs présélectionnées, ayant un potentiel agressif. En cas de positivité, elle constituerait un examen de référence pour le suivi thérapeutique ou pour la détection d’éventuelle récidive. En effet, il est parfois difficile, en IRM, de différencier une reprise évolutive d’une
image cicatricielle notamment après abord endoscopique endonasal. Plus intéressant semble être l’utilisation de la 11 C-methionine, acide aminé marqueur de la prolifération cellulaire. Zhang [579] (Chiba Japon) en 2004 rapporte ainsi une série de 15 chordomes (11 sacrés, 1 thoracique et 3 iliaques) dont 12 étaient positifs et dont la fixation a diminué après radiothérapie au 11 C− (CIRT). L’index de fixation T/N (tumeur/zone non tumorale) est passé de 3,3 ± 1,7 à 2,3 ± 1,4 avec un suivi de 20 mois. Debus [330] (Heidelberg Allemagne) a étudié en 11 C-méthionine TEP-scan 45 patients dont 17 chordomes de la base du crâne traités ensuite par CIRT ; il obtient 94 % de contrôle local avec un suivi moyen de 9 mois. Cependant, l’utilisation d’un traceur marqué au 11 C est difficile car elle ne peut être faite que dans des centres de médecine nucléaire situés près d’un cyclotron, compte tenu de la demi-vie très courte (20 min) du traceur. Une autre classe de traceurs, ceux de l’hypoxie, pourrait permettre une évaluation pronostique. Le 18 F-MISO est le plus couramment utilisé. Il diffuse librement dans les cellules, qu’elles soient normoou hypoxiques, mais il est piégé sélectivement dans les cellules hypoxiques. Son taux de fixation dépend alors étroitement de la teneur en oxygène. L’évaluation de l’hypoxie tumorale est particulièrement intéressante puisqu’elle constitue un facteur pronostique majeur de radio- et de chimio-resistance. Une étude particulièrement intéressante vient d’être publiée (2012) par Mammar [580] dans laquelle 7 patients ayant des chordomes ont été imagés par 18 FDG et/ou par 18 F-MISO : le TEP au 18 F-MISO s’est révélé positif dans 7 des 9 lésions imagées tandis que le 18 FDG seulement dans une des 8 tumeurs étudiées. L’intérêt potentiel de ces traceurs serait donc de localiser des zones plus résistantes à la radiothérapie et sur lesquelles un surdosage serait utile. 9. Associations Différentes pathologies associées aux chordomes ont été rapportées. 9.1. Association chordome et sclérose tubéreuse de Bourneville La plus intéressante est l’association chordome et sclérose tubéreuse de Bourneville. La tuberous sclerosis complex (TSC) est une maladie autosomale dominante neuro-cutanée caractérisée par la prolifération anormale de tissu (hamartomes) dans de multiples organes en particulier le cerveau, la peau, le cœur le poumon et les reins. Les manifestations cliniques sont donc variables et notamment avec l’âge ; dans la plupart des cas, les premiers symptômes surviennent dans l’enfance. La TSC est due à une mutation inactivante des gènes suppresseurs appelés TSC1 et TSC2 qui encodent respectivement l’hamartine et la tubérine. La plupart des patients sont cependant des cas sporadiques provenant d’une nouvelle mutation, résultant en général d’une délétion avec perte de l’hétérozygotie. Les gènes TSC1 et TSC2 sont des constituants importants des voies de signalisations du mTOR. La perte ou l’inactivation de la fonction suppressive des gènes TSC induit une phosphorylation du mTOR et d’une cascade de molécules dont le résultat final est l’augmentation de la croissance et de la prolifération cellulaire [200]. L’association d’un tel syndrome génétique et du chordome peut donner des clés pour la compréhension de la pathogenèse du chordome. McMaster et al. [201], en 2011 ont recherché dans 17 registres américains (SEER) du National Cancer Institute tous les cas de chordome confirmés, chez des patients âgés de 18 ans ou moins, sur la période 1973–2007 ; ces registres couvrent environ un quart de la population des États-Unis. Ils ont relevé 65 cas de chordomes et les ont
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
comparés à 10 cas de chordomes associés à une TSC, retrouvés dans une revue de littérature exhaustive. Dans la série de 65 cas, l’âge moyen est de 12 ans (0–18 ans) dont 15 % entre 0 et 5 ans, 29 % de 6 à 11 ans et 56 % de 12 à 18 ans. L’âge moyen des localisations crâniennes est de 9 ans ; elle est de 13 ans pour le rachis et de 16 ans pour le sacrum. Sur l’ensemble de la série 64 % des chordomes sont crâniens, 26,6 % rachidiens et 9,4 % sacrés. Tous les chordomes de moins de 5 ans sont intracrâniens contre 80 % pour la tranche 6–11 ans et 55 % pour la tranche 12–18 ans. Le suivi moyen est de 51 mois avec une mortalité de 33 %. La survie à 5 ans est de 68 % et à 15 ans de 53 %. La mortalité est de 47 % à 15 ans pour les localisations crâniennes et rachidiennes mais de 100 % à 36 mois pour les localisations sacrées. On retrouve ici les caractéristiques des chordomes de l’enfant citées plus haut mais aucune donnée histologique particulière n’est donnée. Dans le groupe de 10 chordomes associés à une TSC publiés, les données sont très différentes. L’âge moyen est de 6,2 mois (0–16 ans). Neuf ont moins de 5 ans, et 7 moins de 2 ans ; un seul a plus de 5 ans (16 ans). On compte 5 localisations crâniennes, 1 rachidienne et 4 sacrées. Les localisations sacrées sont donc plus fréquentes que dans la population globale et de plus surviennent dans la période néonatale (âge moyen 2 jours). La survie est également bien meilleure puisque sur 7 cas dont l’avenir est connu, 4 des 5 patients opérés sont vivants et sans progression tumorale de 1 à 19 ans après intervention, 1 patient opéré et traité par proton l’est également à 5 ans ; enfin 1 patient ayant un chordome métastatique traité par chimiothérapie est aussi sans progression tumorale à 5 ans. Un seul patient opéré sans traitement complémentaire est décédé à 2 ans. Ceci donne une survie de 83 % avec un suivi médian de 5 ans. Il est également précisé que le pronostic des localisations sacrées est connu pour 2 d’entre elles et qu’elles vont bien sans récidive à 8 et 19 ans, ce qui est bien meilleur que pour les 6 cas de la série globale, tous décédés à 36 mois. Pour 3 des 10 patients, une mutation des gènes TSC1 ou TSC2 a été mise en évidence. L’intérêt de cette association réside dans le fait que si ces gènes sont également inactivés dans certains chordomes non associés à une TSC, on peut imaginer que la voie du mTOR est aussi impliquée dans les chordomes et donc que des inhibiteurs de cette voie pourraient être utilisés dans leur traitement. En fait, ce traitement a déjà été essayé et a démontré une certaine efficacité sur les astrocytomes de laTSC [202]. Pour les chordomes, il n’a pour l’instant été rapporté qu’une étude portant sur 50 cas (essentiellement sacrés) montrant l’activation de la voie mTOR dans 65 % mais sans passer par l’inactivation de TSC1 et TSC2. L’étude ne portait que sur des patients adultes et aucune autre étude ne semble avoir été réalisée sur une population pédiatrique. Inversement, il n’existe qu’un seul cas publié de chordome (intradural latéro-médullaire) associé à une TSC chez un adulte. La piste des gènes TSC et de la voie mTOR paraît néanmoins plus qu’intéressante. 9.2. Maladie d’Ollier ou le syndrome de Maffucci Autre association, celle de chordomes avec la maladie d’Ollier ou le syndrome de Maffucci, deux maladies apparentées et très rares qui comportent différentes localisations de chondrodysplasies. Le syndrome de Maffucci se différencie de la maladie d’Ollier par l’existence d’anomalies vasculaires y compris des hémangiomes. Les deux maladies peuvent être associées à des chondrosarcomes ainsi qu’à d’autres néoplasies non sarcomateuses, notamment intracrâniennes. Dans une revue de littérature exhaustive, Ranger et Szymczak [203] en 2009 ont recherché les associations de ces deux entités à des néoplasies intracrâniennes. Ils ont trouvé 24 cas de maladie d’Ollier associées pour 6 d’entre elles à des chondrosarcomes et pour 18 autres à des tumeurs gliales, et 22 syndromes de Maffucci dont 13 avec chondrosarcomes, 8 avec diverses tumeurs et 1 avec chondrosarcome et une autre tumeur.
31
Parmi ces autres tumeurs associées au syndrome de Maffucci, on trouve 5 gliomes, 1 esthésioneuroblastome, 1 adénome hypophysaire, 1 hemangioendothéliome et 1 chordome. En 1987, Liu et al. [204] avaient présenté une série de 55 patients porteurs d’une maladie d’Ollier dont 1 associée à un chordome et 15 autres essentiellement à des chondrosarcomes (n = 14). Ces associations de chordomes et syndrome de Maffucci ou maladie d’Ollier semblent être les deux seules rapportées à ce jour. S’agissant de maladies congénitales mais non héréditaires, des recherches d’anomalies chromosomiques ont été réalisées mais pour l’instant sans résultat. Néanmoins, étant donné la proximité des pathologies chondromateuses et chordomateuses, il est possible qu’un lien existe entre elles. À ce propos, McMaster et al., dans leur revue épidémiologique de 2001, mentionnent que 39 des 414 chordomes ont eu un autre cancer ce qui est conforme à la fréquence des cancers dans sa population mais deux de ces cancers sont des lésions osseuses : un chondrosarcome et un histiocytome. On peut mentionner également une famille publiée par Weber et Scott [205] en 2005 comprenant un père et deux fils porteurs d’un cancer gastrique ou intestinal et un troisième fils présentant un chordome. 9.3. Association avec la maladie de Crohn Au moins une publication [206] fait état de l’association d’un chordome avec une maladie de Crohn et spécule sur le lien génétique possible existant entre ces deux affections du fait d’anomalies connues sur les mêmes chromosomes 1p, 3p et 7q. 9.4. Association avec un kyste de la poche de Rathke Une autre association avec un kyste de la poche de Rathke a été rapportée. Il semble que le cas présenté par Li et al. [207] en 2011 soit le seul à ce jour. L’intérêt de cette association réside dans l’embryogenèse de la notochorde qui, après avoir cheminé dans le clivus puis en avant de lui, le retraverse pour se terminer près de la selle turcique. On peut donc concevoir qu’un chordome dont l’origine se situe près de l’extrémité céphalique de la notochorde puisse s’associer à une lésion sellaire. Dans le cas rapporté, un homme de 49 ans, le chordome présentait un kyste dans sa partie supérieure qui se révélera être un kyste de la poche de Rathke inclus dans la tumeur. 9.5. Secrétant de l’ACTH Une autre association particulièrement curieuse est celle d’un chordome du sacrum secrétant de l’ACTH et responsable d’un syndrome de Cushing [208]. Cet homme de 76 ans avait un hypercortisolisme biologiquement démontré qui s’est amélioré après l’exérèse incomplète du chordome ; le cortisol plasmatique s’est normalisé et l’ACTH a substantiellement diminué mais n’est pas revenu complètement à la normale. De plus les cellules du chordomes fixaient positivement l’ACTH. Un tel syndrome a été décrit dans des tumeurs carcinoïdes mais semble-t-il jamais associé à un chordome. 10. Localisations extra-axiales Il existe un certain nombre de chordomes localisés en dehors de l’axe primitif de la notochorde, c’est-à-dire en dehors des éléments osseux du clivus à la région sacrococcygienne. Une de ces localisations ne pose pas de problèmes de compréhension puisqu’elle est située sous la muqueuse du nasopharynx, en avant du clivus, dans une zone où la notochorde chemine normalement. En effet la notochorde sort de l’apex de l’odontoïde pour pénétrer la pointe du clivus ; elle traverse ensuite le clivus à sa jonction 1/3 moyen–1/3 inférieur pour se retrouver en avant du clivus sous l’endoderme qui va donner la muqueuse pharyngée. Elle va
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 32
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
enfin retraverser le clivus dans son 1/3 supérieur pour se terminer dans la région sellaire vers sa partie postérieure (lame quadrilatère). La première traversée du clivus se fait au voisinage de ce qui est appelé le canal médio-basal [209] tandis que la seconde est située en avant de la synchondrose sphéno-occipitale et en arrière du canal craniopharyngien. Qu’un chordome se développe entre ces deux traversées osseuses, au niveau du nasopharynx est donc parfaitement compréhensible. En pratique, il est néanmoins souvent difficile d’affirmer une origine nasopharyngée pour des chordomes souvent volumineux et ayant déjà envahi le clivus. Seuls des chordomes diagnostiqués tôt dans leur évolution, à un stade où aucune lyse osseuse n’est visible, peuvent être qualifiés de nasopharyngiens. C’est pourquoi tous les cas rapportés avant l’utilisation du scanner ou de l’IRM restent discutables. Il en est ainsi des deux cas de la publication classique de Wright [210]. Même s’il est affirmé qu’il n’y avait aucune lésion osseuse (no bone involvement), cette affirmation repose sur des radiographies standard et une impression opératoire (sans microscope). C’est le cas aussi de l’observation de Batsakis et Kittleson [211] en 1963, de Richter et al. [212] en 1975 et de Shugar et al. [213] en 1980. Dans les formes purement nasopharyngées, la masse tumorale est distincte de l’os ; il n’y a aucune érosion du clivus mais en revanche on peut souvent observer un aspect de scalloping de la table externe avec respect de la corticale, auquel s’associe un petit tractus bien visible traversant le clivus et rattaché à la masse tumorale. Lors de l’intervention, l’exérèse est assez simple et parfois même réalisée en bloc. Les auteurs insistent sur l’intérêt de réséquer ce tractus en fraisant la face antérieure du clivus au pourtour de ce tractus pour éviter les récidives. Coppens et al. [214] en rapportent 3 cas, qui plus est familiaux, révélés par une obstruction nasale, tous de sexe féminin, âgées de 5,8 et 32 ans. Les 3 patientes ont été opérées et sont sans récidive à 12, 14 et 54 mois. Aucun traitement complémentaire (radiothérapie) n’a été proposé. Il s’agissait d’authentiques chordomes sur le plan radiologique (avec notamment prise de contraste) et immuno-histochimique et non pas de tumeurs bénignes à cellules notochordales. Pour Coppens, les 6 cas de chordomes nasopharyngiens publiés précédemment sont différents dans la mesure où ils présentaient tous une destruction osseuse importante concernant le clivus, le rostre sphénoïdal ou l’ethmoïde [181,213,215–218]. Néanmoins, depuis Coppens, on retrouve au moins deux publications de chordomes nasopharyngiens extraosseux. La première par Nguyen et al. [219] en 2009 porte sur 5 cas observés entre 1997 et 2007, âgés de 8 à
65 ans (moyenne 43 ans) et de sexe ratio M/F à 1/1,5. Quatre sont localisés sur la ligne médiane et s’étendent en haut vers le sinus sphénoïdal et en avant vers le nasopharynx ; le cinquième a une extension plus latérale vers l’espace parapharyngé et le sinus maxillaire. En scanner, ils sont tous extraosseux avec un scalloping du clivus. Deux d’entre eux présentent des calcifications, et 3 sur 5, un tractus les reliant au clivus bien visible. Les 5 cas prennent le contraste en IRM. Tous ont été opérés avec fraisage de la zone de raccordement au clivus. Quatre sont sans récidive mais le temps de suivi n’est pas mentionné et un a présenté une récidive au niveau du tractus tumeur-clivus. Un seul a rec¸u un traitement complémentaire par protons. La seconde publication, par Yan et al. [182], comprend 5 cas histologiquement prouvés, observés entre 2004 et 2008 au Bejing Tongren Hospital et ayant bénéficié d’un scanner et d’une IRM. Ces 5 cas représentent 0,67 % des 890 tumeurs primitives des fosses nasales et du nasopharynx observés sur la même période. En imagerie, ces tumeurs faisaient en moyenne 4 centimètres sur 6, ne montraient aucune lyse osseuse et présentaient toutes des calcifications intratumorales. De plus, en IRM, toutes se rehaussaient après injection de gadolinium. Une des tumeurs avait une extension essentiellement vers la fosse nasale gauche. Les auteurs ne mentionnent en revanche rien à propos d’un éventuel tractus les reliant au clivus. Les 5 chordomes ont été opérés et n’ont pas eu de radiothérapie complémentaire. De fac¸on surprenante, tous ont récidivé dans l’année suivant l’exérèse ce qui les différencie des autres cas publiés qui semblent être de bon pronostic (Fig. 50). Ces formes de chordomes extraosseux sont rares mais ont l’avantage d’être de découverte précoce devant le plus souvent, une obstruction nasale et donc de pouvoir être réséquées de fac¸on beaucoup plus radicale, parfois même en bloc, que les autres localisations crâniennes. Ceci expliquerait effectivement un meilleur pronostic que celui des chordomes intra-osseux du clivus. On peut mentionner ici un chordome chez un homme de 52 ans localisé à la partie latérale du clivus avec essentiellement une masse dans la fosse temporale droite [220] ; à la demande du patient, une simple biopsie transclivale par voie endonasale a été d’abord réalisée. Une fois le diagnostic de chordome établi, il a accepté une intervention d’exérèse ; mais sur l’IRM répétée en préopératoire la tumeur s’était presque complètement extériorisée dans le pharynx. Il a donc été repris en endoscopie endonasale. À la suite de ce geste et d’une protonthérapie il n’a plus eu de progression tumorale à 44 mois. Il est sur que si tous les chordomes du clivus se
Fig. 50. Localisations extra-axiales : pharyngée. Extra-axial localizations of the Pharynx. D’après Yan et al. [182] ; publié avec l’autorisation de l’American Society of Neuroradiology, et des auteurs.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
transformaient spontanément en chordomes du pharynx, leur exérèse poseraient beaucoup moins de problèmes. Un certain nombre de chordomes localisés latéralement et non pas sur la ligne médiane ont été rapportés. Ils ne correspondent pas à une extension latérale d’une localisation médiane et font donc supposer une origine extra-axiale. C’est le cas de chordomes développés au niveau du foramen jugulaire ([221–224] : 2 cas [225] : 3 cas, [183]) (Fig. 51). Ces chordomes du foramen jugulaire peuvent prêter à confusion avec les tumeurs plus fréquentes de cette localisation : paragangliomes ou schwanomes. Un méningiome chordoïde du foramen jugulaire [226] a d’ailleurs été rapporté également. Quelques cas de chordomes de la région du cavum de Meckel, pouvant simuler un neurinome du trijumeau ont également été publiés [184,227–230]. Dans la série, certes ancienne, de Kendall [198] 15 % des chordomes se développent à partir de la pointe du rocher. L’explication qui est donnée de ces localisations latérales est la possibilité d’une bifurcation (Forking) de la notochorde embryonnaire [20]. 11. Chordomes familiaux Quelques rares formes familiales de chordomes ont été publiées. Elles sont intéressantes car elles ont fait l’objet d’études génétiques qui pourraient déboucher sur de nouvelles possibilités thérapeutiques. En 2006, Bhadra et Casey [231] ont rapporté 2 nouvelles familles s’ajoutant à 9 autres publiées depuis 1958 soit un total de 11 familles. Chacune de ces familles compte au moins deux membres atteints, la plupart sur deux ou 3 générations ; l’une d’entre elles en comporte 10 sur 3 générations. Seul Bhadra indique que ses deux familles proviennent d’une cohorte continue de 175 patients porteurs de chordomes et observés sur une période de 10 ans (1995–2005). Les 11 familles sont décrites de fac¸on plus ou moins détaillée ; on peut dire qu’il y a au moins 46 membres atteints par la maladie auxquels on peut ajouter deux patients qui ont présenté un astrocytome intracrânien. Sur ces 46 patients, on sait que 19 sont de sexe féminin et 12 de sexe masculin, que leur âge varie de 3 à 68 ans et que leurs localisations sont essentiellement intracrâniennes : 7 nasopharyngiennes et 24 clivales pour seulement 5 sacrées. Deux patients ont présenté plusieurs localisations au cours de leur vie ;
33
en particulier, l’un d’entre eux a présenté un chordome nasopharyngien à l’âge de 9 ans puis une récidive ou (un autre chordome) à l’âge de 42 ans dont il mourra à l’âge de 47 ans. Chez au moins trois de ces familles, une transmission sur un mode autosomal dominant peut être évoquée. En fait les modifications du génome et surtout les variations du nombre de copies sont un facteur important de la prédisposition à une maladie donnée lorsqu’elle est liée à des désordres chromosomiques. Ces variations du nombre de copies, en particulier les duplications transmissibles, sont rarement démontrées dans les cancers familiaux ; en revanche, elle semble pouvoir l’être dans les chordomes familiaux chez lesquels a été retrouvée une duplication du gène T. Initialement avait été démontré [232] un réarrangement du chromosome 1p36 comportant possiblement un gène suppresseur prédisposant à la survenue d’un chordome. La même étude a été ensuite reproduite sur une cohorte de 35 chordomes sporadiques et a confirmé l’implication du 1p36 dans le développement tumoral chez 31 d’entre eux. Une autre étude publiée par Kelley et al. [233] en 2001, portant sur la famille rapportée par Stepanek et al. [234] et sur deux autres familles, faisait ensuite ressortir le chromosome 7q33 comme un nouveau candidat potentiel prédisposant au chordome ; cette étude a d’abord été reprise et confirmée par Yang et al. [235] en 2005 mais ces mêmes auteurs, en 2009 [143,144], ont réévalué les membres de 7 familles en considérant que les résultats des études précédentes n’étaient pas cohérents puisque certains membres de certaines familles ne montraient pas les mêmes anomalies que les autres. Cette fois c’est le chromosome 6q27 qui est avancé avec chez tous les membres étudiés (n = 7) sans exception, de 4 familles sur 7, des duplications sur la même région de ce chromosome ; en revanche la duplication n’est retrouvée chez aucun des membres des 3 autres familles. La région minimale du locus de ce chromosome partagée par toutes les familles positives contient plusieurs gènes jouant probablement un rôle important dans le chordome et les cancers en général. Cependant l’un de ces gènes, le gène T, encode pour la brachyurie qui est un facteur de transcription spécifique de la notochorde. En effet il est exprimé dans le noyau des cellules de la notochorde dont il est un facteur important du développement [236]. Il a même été démontré que la brachyurie est spécifiquement exprimée dans les chordomes alors qu’elle ne l’est pas dans plus de 40 autres types de néoplasme explorés, y compris dans les chondrosarcomes [145]. Yang et al. ont de plus confirmé en étude quantitative PCR, les duplications du gène T sur
Fig. 51. Forme dédifférenciée en IRM avec aspect hypodense en T2 (Patient du Dr Manzo) MRI features of a dedifferentiated chordoma with hyposignal in T2 (thanks to Dr Manzo).
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
34 Tableau 6 Formes familiales de chordomes. Family forms of chordomas. Références
Membres
Localisation
Âge
Foote et al. [237]
1 frère + 1 sœur
Sacrum
Âge moyen (?)
Enin [238]
2 frères
Nasopharynx
Jeunes (?)
Kerr et al. [239], (3 générations)
1 homme
Nasopharynx
?
1 mère 1 fille
Nasopharynx Nasopharynx
? ?
Chetty et al. [240]
1 enfant + ?
Clivus
3 ans
Stepanek et al. [234], (3 générations)
1 homme
Sacrum
28 ans
1 sœur 1 nièce 1 cousin
Nasopharynx Clivus Nasopharynx
39 ans 20 ans 31 ans
1 père
Nasopharynx
9 + 42 ans
1 fille 1 fille 1 fille
Multicentrique Astrocytome Clivus
25 ans 12 ans 17 ans
10 membres
68, 56, 46, 28, 39, 30, 35, 20, 16, 6 ans
1 homme 1 fille 1 neveu
9 clivus 1 sacrum 1 nasopharynx 9 histo, 1 IRM Clivus Astrocytome Clivus
2 sœurs, 3 cousins, 1 cousine
?
?
1 femme
Clivus
46 ans
1 sœur
Clivus
1 cousin + 6 membres
Clivus Clivus
7 ans, 5 récidives, décédé 25 22 ans ?
1 femme
Clivus + sacrum
1 grand-mère 1 père
Clivus Clivus
Dalprà et al. [241] + Miozzo et al. [232], (2 générations)
Kelley et al. [233] Korczak et al. [242], (3 générations) Yang et al. [235] ; [143]
Yang et al. [235] ; [143], (3 générations) Bhadra et Casey [231], (2 générations)
Bhadra et Casey [231], (3 générations)
les 4 des 7 familles positives et les ont validées en testant leurs absences sur 100 contrôles sains. Bien entendu puisque 3 familles ne présentent pas ces duplications, cette duplication du gène T ne serait pas le seul facteur de prédisposition à la survenue d’un chordome ; il faudrait alors imaginer des altérations d’autres gènes ou d’autres mécanismes génétiques (Tableau 6). 12. Métastases Les métastases s’observent avec une fréquence variable selon les séries, au cours de l’évolution des chordomes. Les chiffres varient de 7 à 43 % [243–245]. Leur existence est connue depuis fort longtemps puisque la première métastase rapportée, l’a été en 1919 par Potoschnig (cité par Markwalder et al. [246] dans leur revue de littérature de 1919 à 1978). Tous les auteurs insistent sur le fait que ce ne sont pas les métastases qui entraînent le décès du patient mais presque toujours la récidive locale. D’ailleurs, McPherson et al. rapportent un délai de survie des patients après chirurgie initiale, équivalent chez les patients avec et sans métastases (106 mois). On peut souligner aussi le fait que nombre de métastases sont asymptomatiques et ne sont découvertes que lors du bilan d’une récidive, voire après le décès lors de l’autopsie [244]. Le plus souvent les métastases sont observées après récidives. Cependant, Kamel et al. [247] en 2005 rapportent une métastase cérébrale découverte avant toute récidive. Il est exceptionnel
46 ans 17 ans 12 ans
3 puis 6 ans Récidive 19, décédé 22 32 ans Décédé à 55 ans
également que le chordome primitif soit découvert après les métastases. Lountzis décrit un cas de métastases cutanées multiples chez un enfant de 20 mois dont la biopsie a permis le diagnostic de chordome puis la mise en évidence par IRM d’un chordome du clivus. Cet enfant avait par ailleurs les stigmates d’une sclérose tubéreuse de Bourneville. Néanmoins, le plus souvent c’est après une ou plusieurs récidives et un délai parfois très long qu’apparaissent les métastases. Loehn et al. [252] rapportent 1 cas de métastase mandibulaire plus 4 autres de la littérature apparues entre 18 mois et 6 ans. Bergh et al. [245] observent 17 récidives et 11 métastases (28 %) dans une série de 39 cas de chordomes sacrés et rachidiens suivis en moyenne 8,1 ans ; dans cette étude, le délai moyen de découverte des métastases est de 6 ans, presque toujours après une récidive. Il indique que la survie moyenne lorsqu’une métastase est découverte est de 0,2 ans. Pour McPherson et al., l’estimation par la méthode de Kaplan-Meier de la survie moyenne après diagnostic d’une métastase de chordome est de 7,6 mois. Heffelfinger et al. [243], dans une série plus ancienne (1973), indiquent un délai moyen de survenue de 2 ans pour les chordomes vertébraux, 2,5 ans pour les chordomes sacrés et entre 3 et 4 ans pour ceux de la base du crâne. Le plus long délai que nous avons retrouvé dans la littérature est de 12 ans pour des métastases cutanées multiples après un chordome sacré [248]. Pour McPherson et al. [174], le délai moyen d’apparition des 7 métastases de sa série de 37 chordomes sacrés et rachidiens avec un suivi de 10 ans, est de 6 ans également. L’estimation de ce délai par méthode de Kaplan-Meier est de
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
143,4 mois. Dans cette série, toutes les métastases sont survenues chez des patients en récidive et représentent 28 % de ces patients en récidive. McPherson et al. [174] précisent que 2 métastases sont survenues après résection en bloc contre 5 après résection par fractionnement tumoral. York et al. [249] observent dans une série de 40 chordomes sacrés, 12 % de métastases après exérèse monobloc et 25 % après exérèse par fractionnement. C’est le seul facteur de risque de survenue de métastase (et aussi de récidive) qui sorte de l’analyse de ces séries ; tous les autres facteurs, y compris histologiques, sont sans influence. Dans la série de McPherson et al. [174], existent 3 chordomes dédifférenciés ; aucun d’entre eux ne s’est accompagné de métastases. Les métastases sont le plus souvent localisées au niveau du poumon [250], du foie, des os (humérus [251], mandibule [252,253], de la peau [254,248] et parfois des ganglions [255]). Dans la revue de littérature de Chambers et Schwinn [244] portant sur 70 cas, 58 % des métastases sont pulmonaires, 33 % ganglionnaires, 22 % hépatiques, 17 % osseuses et 9 % musculaires. Mais ont aussi été décrites des localisations beaucoup plus surprenantes comme le péritoine [256], le cœur [257], le rein [258] ou les ovaires [259], le sein [260], le cerveau [247]. Seulement 7 cas de métastases cérébrales ont été publiés, toutes sauf une dans un contexte de métastases multiples [247]. Les métastases s’observent nettement plus souvent à partir des chordomes sacrococcygiens (73 %) que des chordomes de la base du crâne (9 %) [244]. Dans la série de McPherson et al. (n = 37), 5 patients avaient un chordome sacré, 1 un chordome cervical et un autre un chordome lombaire. Pour Markwalder, cette prédisposition serait liée aux grosses veines pré-sacrées qui permettent une diffusion systémique facile. 13. Essaimage tumoral Le chordome comme nombre de tumeurs malignes peut essaimer et produire des localisations à distances de différentes fac¸ons. L’essaimage le plus fréquent se fait le long de la voie d’abord. Un
35
autre essaimage se fait le long des voies d’écoulement du LCR ce qui suppose un chordome intradural ou ayant un prolongement intradural. Enfin un essaimage peut se faire au travers d’une dérivation du LCR. 13.1. Essaimage le long de la voie d’abord chirurgical L’essaimage le long de la voie d’abord chirurgical est le plus classique. Toutes les séries un peu importantes en comportent un petit pourcentage. Par exemple, Arnautovic´ et Al-Mefty [261] en observent 6 sur 82 chordomes de la base du crâne opérés. Fischbein et al. [173] en retrouvent 3 sur 70 cas. Fagundes et al. [262] en 1995 estiment à 5 % la probabilité d’un essaimage chirurgical. C’est un chiffre qui peut paraître important mais qui s’explique aisément par la voie d’abord utilisée. Il s’agit en effet dans 90 % des cas d’une voie transnasale ou transsphénoidale, donc étroite, avec la possibilité fréquente que des instruments frottent sur les parois. Les localisations secondaires sont donc en général observées dans le nez ou dans l’ethmoïde. Le délai dans lequel sont découvertes ces pseudo-métastases varie de quelques mois à 4 ans après l’intervention. Ce délai est donc nettement plus court que le délai moyen d’observation des véritables métastases qui est de 6 ans [245]. 13.2. Essaimage le long des espaces sous-arachnoïdiens L’essaimage le long des espaces sous-arachnoïdiens est également possible dans le cas de chordomes avec contingent intradural (Fig. 52). Il semble que cette occurrence ait été rapportée pour la première fois en 1954 par Holzner [263]. Depuis nous en avons colligé 10 autres cas. Tous les chordomes étaient initialement localisés au clivus sauf un au niveau de l’angle pontocérébelleux. Il s’agissait de 8 hommes et 2 femmes (un des cas n’est pas précisé). L’âge variait de 6 ans à 69 ans (moyenne : 46 ans). La dissémination se fait le plus souvent sur les racines de la queue de cheval (5 sur 8 connus, 2 sur le cône médullaire et 1 dans la région cervico-dorsale). Il faut
Fig. 52. Dissémination au long des espaces sous-arachnoïdiens au niveau de la queue de cheval. Seeding along the subarachnoid spaces at the level of the cauda equina. D’après Champeaux et al. [271] ; publié avec l’autorisation d’Elsevier-Masson SAS.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
36 Tableau 7 Essaimage le long du LCR. Seeding along the LCR. Références
Âge/sexe
Site initial
Site à distance
Délai
Holzner [263] Stough et al. [264] Plese et al. [265] Marigil et al. [266] Raffel et al. [267] Krol et al. [268] Forsyth et al. [269] Korinth et al. [74] Asano et al. [270] Champeaux et al. [271] Martin et Olson [272]
59/M 41/M 6/F 44/M 40/M 41/M ? 48/F 53/M 59/M 69/M
Clivus Clivus Clivus Clivus Clivus Clivus Clivus CPA Clivus Clivus Clivus
Cauda equina Th12-L1 ? ? Multiple (1) Cervical(2) Lombaire C7-Th1 Thoracolombaire Th4, 8, 9 et lombosacré Racine S1 Cauda equina
Autopsie 5 ans Autopsie Simultané 7 mois 1 an 2 ans ? ? 11 ans 6 ans ?
noter que 3 ont des localisations multiples : 1 cervical et lombaire, 1 dorsal (Th4, 8, 9) et lombosacré et un non précisé. Le délai de découverte de la ou des localisations à distance varie de 7 mois à 11 ans (moyenne : 4,3 ans). L’une d’entre elles a été diagnostiquée simultanément à la lésion du clivus. Deux disséminations par le LCR n’ont été identifiées qu’à l’autopsie. 13.3. Essaimage au travers d’une dérivation ventriculo-péritonéale Enfin, l’exceptionnel essaimage au travers d’une dérivation ventriculo-péritonéale n’a semble-t-il été observé qu’une seule fois par Figueiredo et al. [81] en 2011. Il a été mentionné plus haut dans le chapitre des chordomes intraduraux. En fait, c’est sur la récidive intracrânienne associée à une masse intrapéritonéale autour du cathéter, que le diagnostic de germinome initialement posé 16 ans plus tôt a été rectifié en faveur du chordome (Tableau 7). 14. Formes malignes ou dédifférenciées Le chordome peut se présenter sous 3 formes histologiques principales : classique ou conventionnelle, chondroïde et dédifférenciée. Cette dernière forme correspond à une forme conventionnelle dans laquelle des zones subissent une transformation en lésion de haute malignité de type variable : histiofibrome, fibrosarcome ou plus rarement ostéosarcome ou rhabdomyosarcome [273] (Fig. 51). Cette forme maligne ou sarcomateuse du chordome est rare ; depuis la première description par Debernardi en 1913 [274] environ 50 cas avaient été rapportés en 1987. Elle représenterait environ 1 % de tous les chordomes [275] et serait plus fréquente à la base du crâne qu’au niveau du sacrum [269,275]. Le chordome dédifférencié s’observe le plus souvent après une ou plusieurs récidives mais il est parfois présent d’emblée lors du diagnostic initial (formes primaires). Il a aussi été suggéré que la radiothérapie favorisait cette transformation maligne mais cela n’a jamais été clairement démontré [276,277,560]. Pour Morimitsu et al. [276], les chordomes dédifférenciés comportent une démarcation nette entre les zones conventionnelles et malignes, alors que lorsque existent des zones transitionnelles, le diagnostic de chordomes sarcomatoïdes serait plus adapté. Quelle que soit la forme, le pronostic est mauvais avec la survenue de métastases et une issue fatale chez la majorité des patients en moins d’un an [274,276,278–282]. Comme toujours il y a des exceptions ; ainsi l’un des cas rapportés par Meis et al. [274] présentait une petite zone dédifférenciée sur un mode osteosarcomateux et le patient survécut 76 mois. Hanna et al. rapportent 4 cas primaires sur une série de 29 cas (proportion tout à fait inhabituelle), dont l’un a survécu 63 mois. Inversement deux autres de ses patients sont décédés 7 et 9 mois après le traitement initial. Le quatrième est vivant sans récidive à un an. Hanna et al. font un lien entre le pronostic et l’importance du contingent dédifférencié. De plus il considère que
ce contingent dédifférencié peut être identifié en IRM. En effet dans un chordome conventionnel, la tumeur apparaît en hypersignal en T2 ; dans 3 de ses 4 cas, les zones indifférenciées sont clairement visibles car elles apparaissent en hyposignal au milieu des zones classiques, en hypersignal (Fig. 51). Cela semble avoir été démontré initialement par MacSweeney et al. [283]. Saifuddin et al. [284] utilisent cette information pour guider la biopsie. On retrouve là l’un des problèmes de l’analyse histologique et pronostique lié à la grande hétérogénéité de la masse tumorale qui peut comprendre de multiples secteurs très différents. Il a été de plus démontré que les compartiments tumoraux conventionnels restaient positifs pour la cytokératine 19 et la brachyurie alors que les zones dédifférenciées ne l’étaient plus, ce qui confirme bien la perte des caractéristiques du chordome et sa transformation en un autre type tumoral. Il est clair que la mise en évidence de zones dédifférenciées en préopératoire doit conduire à une exérèse la plus complète possible, voire monobloc ; sa confirmation histologique doit faire pratiquer systématiquement une radiothérapie complémentaire qui peut parfois se discuter après exérèse monobloc dans les formes classiques. Certains ont même proposé dans ces formes malignes une chimiothérapie adjuvante avant la radiothérapie [199,285]. 15. Épidémiologie Le chordome est globalement une tumeur très rare. Son incidence varie selon les études de 0,5 à 8 par million d’habitants et par an [286–288]. Ceci représenterait donc pour la France entre 30 et 480 nouveaux cas par an mais la vérité est probablement plus près du chiffre inférieur. Le registre américain (SEER) portant sur 400 cas observés en 22 ans (1973–1995) indique une incidence de 0,08 pour 100 000 [286], 0,08 chez les sujets de race blanche, 0,02 chez les sujets de race noire et 0,07 chez les autres (essentiellement asiatiques). Pour Mukherjee et al. [289,290] en 2011, 91,2 % des 414 chordomes rassemblés sur le même registre (SEER) sont de race blanche, 6,3 % asiatiques et 2 % afro-américains. Le chordome représente de 1 à 4 % des tumeurs osseuses malignes primitives [64,291]. Il compte pour 0,4 % des tumeurs primitives intracrâniennes dans le registre japonais (Kawaze) et pour 0,1 à 0,2 % des tumeurs de la base du crâne [292,293]. Dans l’étude coopérative de Fuentes et Benezech [294] de 1989 portant sur 206 tumeurs osseuses primitives du rachis, le chordome est la lésion prédominante chez l’adulte et la 4e chez l’enfant de moins de 15 ans. Le chordome est la 3e tumeur la plus fréquente en cervical mais la première en C1-C2 (suboccipital segment). Dans cette étude, le chordome compte pour 17 % de toutes les tumeurs osseuses primitives du rachis. En 2007, Kelley et al. [295] ont publié une revue de 2750 tumeurs osseuses primitives colligées dans le registre de Leeds (Leeds regional bone tumor registry) pendant 48 ans (1952–2000) en provenance de neurochirurgiens, d’orthopédistes et d’oncologistes. Seules 126 d’entre elles étaient
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
localisées sur le rachis avec le chordome comme tumeur la plus fréquente après le myélome et avant l’ostéosarcome. Considérant que la population sur laquelle a porté cette étude était de 3,5 millions d’habitants, cela voudrait dire que la France, environ 20 fois plus peuplée, aurait eu sur la même période 2520 tumeurs osseuses primitives du rachis et donc 60 nouveaux cas par an ; le chordome représentant 25 % environ des tumeurs osseuses, ce serait seulement 15 nouveaux cas qui seraient observés par an. Mukherjee et al. rassemblent 1892 tumeurs osseuses primitives malignes du rachis sur 30 ans (1973–2003) [290]. Le chordome (414 cas) vient en 4e position après le chondrosarcome (579 cas), le sarcome d’Ewing (469 cas) et l’ostéosarcome (430 cas). La distribution de la localisation est classiquement la suivante : 50 % sacrococcygienne, 35 % sphéno-occipitale et 15 % rachidienne depuis les publications de la Mayo Clinic par Heffelfinger et al. [243] et Dahlin [275] portant sur 282 cas. D’autres séries ont rapporté des chiffres identiques [288,296,297]. Mais ces rapports varient beaucoup en fonction du mode de recrutement. Dans le SEER report, il s’agit de registres par état colligeant la totalité des cas ; pour cette étude, la distribution est à peu près équivalente entre les trois principaux sièges du chordome : 29,2 % (117) au niveau du sacrum, 32 % (128) en intracrânien et 32,8 % (131) au niveau spinal. Sur l’ensemble des localisations il y aurait une légère prédominance masculine, (60 % d’hommes) avec une incidence à 0,1 pour 100 000 chez les hommes contre 0,06 chez les femmes. La localisation crânienne s’observe plutôt chez la femme (39 % contre 23,4 % pour les sacrées et 31,5 % pour les rachidiennes). Inversement l’homme a plutôt des localisations sacrées et rachidiennes, 33,2 et 33,6 % contre 27,7 % pour les localisations crâniennes. L’âge médian au moment du diagnostic est de 58,5 ans avec des extrêmes de 3 à 95 ans pour McMaster qui précise qu’il existe une augmentation progressive de l’incidence avec l’âge, le pic se situant pendant la 8e décade. Pour Mukherjee, c’est le chordome qui a l’âge moyen de diagnostic le plus élevé comparativement aux trois autres tumeurs osseuses les plus fréquentes : 59,9 ans pour le chordome (médiane : 62 ans), 50,8 pour le chondrosarcome (médiane : 50 ans), 48,3 pour l’ostéosarcome (médiane : 51 ans) et 19,2 pour le sarcome d’Ewing (médiane : 17 ans). D’une fac¸on globale, le chordome est rare chez le sujet jeune de moins de 40 ans (incidence : 0,2 par million) et encore plus en dessous de 10 ans. Pour McMaster, seulement 77 des 374 cas recensés (20,5 %) ont moins de 40 ans. L’ensemble des auteurs souligne que l’enfant représente environ 5 % de la totalité des chordomes. Bien que dans le registre SEER, le nombre de chordomes chez le sujet noir soit très petit (n = 9), il faut noter que 7 d’entre eux ont moins de 40 ans ; dans ce groupe de patients la médiane pour l’âge est à 27 ans contre 59 ans chez les sujets blancs. Le quartile d’âge le plus jeune comprend une majorité de chordomes crâniens (54,5 %) alors que le quartile le plus vieux a plutôt des chordomes sacrés (41,3 % contre 15,2 % crâniens). L’âge moyen des chordomes crâniens est de 49 ans contre 69 ans pour les chordomes sacrés. Enfin 25,8 % des chordomes crâniens ont moins de 35 ans ce qui n’est le cas que pour 7,7 % des chordomes sacrés. Sans doute est-il plus parlant de dire que dans cette étude portant sur 400 cas, seulement 2 des 117 chordomes sacrés ont entre 3 et 25 ans (1,7 %), 18 entre 26 et 48 ans et 97 au-delà de 49 ans (82,9 %) ; à l’inverse parmi les 128 chordomes crâniens, 18 ont entre 3 et 25 ans (14 %), 44 entre 26 et 48 ans et 66 plus de 49 ans (51,5 %). On aurait pu penser que l’incidence des chordomes s’est modifiée avec l’évolution des techniques histologiques et notamment de l’utilisation de l’immuno-histochimie qui permet maintenant de faire clairement la séparation entre chordomes et chondrosarcomes. En fait dans l‘étude de McMaster, l’incidence augmente modérément de 1973 à 1995 (de 0,6 à 0,8 pour 1 000 000) plus
37
probablement du fait des progrès de l’imagerie et donc de la détection des tumeurs. L’histoire naturelle des chordomes sans traitement est difficile à préciser mais la survie depuis le diagnostic est estimée inférieure à 2 ans. Dans la série McMaster, 97 % ont rec¸u un traitement, 48,5 % par chirurgie seule, 37,8 % par chirurgie plus radiothérapie sous une forme ou une autre et 13 % par radiothérapie isolée, le plus souvent proposée chez les sujets âgés et pour les localisations sacrées. La survie moyenne tous sexes, âges et localisations confondues est de 6,29 ans ; elle est un peu plus longue chez la femme que chez l’homme (7,25 contre 5,93 années) mais de fac¸on non significative. De même il n’y a pas de différence significative en termes de survie selon les localisations : 5,88 ans pour le rachis mobile, 6,48 pour le sacrum et 6,94 pour le crâne. On observe un pronostic un peu meilleur des chordomes crâniens chez la femme par rapport à l’homme mais là encore non significatif (7,7 ans contre 6,42). La survie relative à 5, 10, 15 et 20 ans, c’est-à-dire le rapport du taux de survie des chordomes par rapport à celui de la population générale de même sexe, âge et race est de 67,6, 39,9, 39,2 et 13,1 %. Là encore, il n’y a pas de différence selon la localisation : 64,7 % pour les chordomes crâniens à 5 ans, 67,2 % pour les rachidiens et 73,6 % pour les sacrés ; Il en est de même pour l’âge : la survie à 5 ans est de 62,1 % avant 25 ans, 44,1 % entre 25 et 48 ans, 69,2 % entre 49 et 71 ans et 50,7 % au-dessus de 71 ans. Enfin même conclusion pour le sexe ; chez les hommes la survie à 5,10 et 15 ans est de 65,1, 38 et 34,5 % alors que chez les femmes elle est de 71,4, 43,4 et 50,5 %. Les études chez l’enfant sont rares compte tenu de l’incidence très faible du chordome chez le sujet jeune. En 2010, Ridenour et al. [298] ont repris l’ensemble de la série de chordomes de la Mayo Clinic de 1910 à 2006. Parmi les 449 cas observés, seulement 35 ont moins de 25 ans (7,5 %). En fait, il s’agit d’enfants et de jeunes adultes dont le plus jeune a 8 ans ; la moyenne se situe à 17,3 ans. Il n’y a donc aucun très jeune patient (moins de 5 ans) dont plusieurs auteurs disent que leur pronostic est très mauvais [245,299–302]. À l’inverse, celui des enfants plus âgés et des jeunes adultes est meilleur que celui des adultes en général [303,304]. La série de la Mayo Clinic compte 18 garc¸ons et 17 filles répartis en 66 % sphéno-occipitaux, 20 % spinaux et 14 % sacrococygiens. Le taux de survie est de 63 % avec un suivi moyen de 10 ans et demi avec des extrêmes allant de 1 mois à 42 ans. Les auteurs notent 3 métastases (9 %). La survie est la meilleure pour les localisations rachidiennes (86 %) devant les crâniennes (65 %) et les sacrées (20 %). Ils mettent en parallèle la localisation et l’histologie, observant que tous les chordomes sacrés sont des formes atypiques, alors que la plupart des chordomes crâniens (74 %) sont des formes conventionnelles. L’un des problèmes de cette série est son hétérogénéité du simple fait de la longueur de la période d’observation (96 ans). Deux autres études, l’une par Borba et al. [299] en 1996 et l’autre par Hoch et al. [304] en 2006, ne rapportent que des localisations crâniennes. La série de Borba et al. est une revue de littérature des chordomes de moins de 21 ans comportant 75 patients auxquels ils ajoutent 4 cas personnels, observés là encore sur une longue période de temps : 1923–1995. On y compte 46 % de patients de sexe féminin et 54 % de sexe masculin. L’âge moyen est de 10 ans, le suivi moyen de 39 mois (1 à 300 mois) avec une survie de 56,8 %. Cette étude insiste beaucoup sur les différences histologiques observées dans cette catégorie de population qui rendraient compte des différences de pronostic. Les chordomes classiques (histologie conventionnelle) sont différenciés des chordomes chondroïdes (avec des aspects chondromateux) et des chordomes atypiques. Leur population globale se décompose en forme classique : 64,6 %, chondroïde : 13,5 % et atypique : 22,4 %. Globalement, tous les chordomes atypiques sont décédés contre 37,5 % des chondroïdes et 23,1 % des classiques. Si on considère ensuite le groupe d’enfants de moins de 5 ans (21 sur 75), on
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 38
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
observe 35 % de formes classiques, 65 % de formes atypiques et aucun chordome chondroïde. La localisation de ce groupe d’âge est essentiellement au niveau du clivus (19 sur 21) ; un est du nasopharynx ; le dernier est appelé « de la base du crâne ». La survie moyenne est de 31,5 % pour un suivi moyen de 25,5 mois. Tous les patients ayant une forme atypique sont décédés dans un délai moyen de 6,6 mois avec des extrêmes de 3 à 18 mois. En revanche tous ceux ayant une forme classique sont vivants dans un délai de 68 mois en moyenne (6–170 mois). Dans ce groupe âgé de moins de 5 ans, 11 patients sur 19 (58 %) ont présenté des métastases le plus souvent pulmonaires ou osseuses ; tous ces patients avaient une forme histologique atypique. Considérant maintenant les chordomes âgés de 5 à 20 ans, 85 % étaient localisés au niveau du clivus, 11 % dans la région parasellaire et 4 % dans le nasopharynx. Sur le plan histologique, les formes classiques sont prépondérantes (78,7 %) ; les formes chondroïdes comptent pour 17,1 % ; les formes atypiques sont finalement rares (4,2 %). Le suivi moyen est de 44,2 mois (1–300 mois) avec une mortalité de 34,5 % dans l’ensemble du groupe, de 18,7 % pour les formes classiques dont le suivi moyen est de 61,2 mois, 37,5 % pour les chordomes chondroïdes avec un suivi moyen de 67,8 mois et 100 % pour les atypiques. On n’observe des métastases que dans seulement 8,5 % des cas. Il apparaît clairement dans cette série qu’il existe un pronostic radicalement différent (mortalité et métastases) entre le groupe d’enfants de moins de 5 ans et ceux de 5 à 20 ans et que cette différence s’explique par la très forte proportion de formes atypiques de chordomes. Dans la série de Hoch et al. [304] sont rassemblés 73 cas de chordomes chez des enfants de moins de 18 ans observés au Massachusets General Hospital entre 1981 et 2003 soit 3,3 cas par an en moyenne. L’âge moyen est de 9,7 ans (1–18 ans) avec une distribution en faveur du sexe féminin (58 %). Dans cette série, on distingue les formes conventionnelles (classiques) majoritaires (58 %), les formes chondroïdes (23 %) et les formes cellulaires (19 %). Ces formes cellulaires comportent une forte densité cellulaire mais pas de matrice myxoïde ni d’architecture lobulée ; parmi ces formes cellulaires, les auteurs identifient 6 cas (8 %) qu’ils qualifient de faiblement différenciés ; la caractéristique principale est l’absence de vacuolisation cytoplasmique et de cellules physaliphores. On peut les rapprocher des formes atypiques de la série de Borba et al. Ils n’observent aucune forme non différenciée. Tous les malades ont été traités de fac¸on comparable, par chirurgie plus protonthérapie postopératoire. Le suivi moyen est de 7,25 ans (1–21 ans) avec une survie de 81 % pour l’ensemble de la série. Il y a 14 décès (9 de sexe féminin) parmi lesquels 5 des 6 formes faiblement différenciées dont 2 avec métastases pulmonaires. Le sixième patient avec forme faiblement différenciée est vivant un an après son diagnostic, mais avec des métastases lymphatiques cervicales. Les 9 autres décès sont des formes conventionnelles (6 cas, 14 %) dont un cas avec des aspects rhabdoïdes et des formes chondroïdes (3 cas, 18 %). Aucun décès n’est constaté dans les formes cellulaires. À titre de comparaison, les auteurs indiquent une mortalité de 55 % à 5 ans dans leur série de 125 adultes porteurs de chordomes de la base du crâne et traités de fac¸on similaire (chirurgie plus protons). On retrouve donc le mauvais pronostic des formes faiblement différenciées que l’on peut rapprocher des formes atypiques de la série de Borba et al. Les auteurs soulignent cependant, d’une part, la différence importante avec des formes d’aspect très voisin qu’ils appellent cellulaire et, d’autre part, le fait qu’aucun paramètre histologique sauf peut-être la nécrose, tel que l’aspect chondroïde, l’activité mitotique, l’atypie cytologique, ou le développement vasculaire n’est prédictif du pronostic dans les autres formes de chordomes et notamment de la survie. Ceci est plutôt surprenant si l’on observe que les formes faiblement différenciées comportent ces mêmes paramètres en quantité importante.
Ils constatent aussi que comme chez l’adulte le pronostic des formes conventionnelles et chondroïdes n’est pas significativement différent. Comme dans la série de Borba et al., Hoch relève que ces formes faiblement différenciées sont rencontrées chez les sujets très jeunes : 4,8 ans en moyenne avec un seul cas ayant plus de 5 ans et que les métastases y sont fréquentes (3 des 6 cas). Au final il déplore que les aspects histologiques de ces formes atypiques ne soient pas standardisés et que leur définition puisse varier d’un auteur à l’autre. 16. Radiothérapie (C.-H. Canova, F. Riet, S. Bolle, V. Calugaru, R. Dendale, J.-J. Mazeron, L. Feuvret) 16.1. Introduction Le défi thérapeutique pour les chordomes de la base du crâne est liée à la localisation anatomique en raison de la présence de nombreuses structures nobles alentours (vaisseaux, nerfs, tronc cérébral, moelle épinière). La première phase thérapeutique est neurochirurgicale et maximaliste afin de réduire le volume tumoral et de créer un espace suffisant entre la tumeur et les structures à risque afin d’optimiser l’irradiation [305]. Cette dernière est systématiquement recommandée afin d’améliorer le contrôle local. À ce jour, la protonthérapie reste la technique de radiothérapie de référence pour ces tumeurs nécessitant de hautes doses et situées dans une zone à haut risque de complications [306]. Parallèlement, grâce aux innovations technologiques en radiothérapie, de nouvelles méthodes d’irradiation sont en cours d’évaluation pour cette indication. D’autres modalités de radiothérapie telles que la radiothérapie stéréotaxique par Gammaknife ou Cyberknife avec de faibles effectifs montrent des résultats intéressants en termes de contrôle local mais il est difficile de proposer un arbre décisionnel précisant l’indication de ces techniques si différentes [307]. Dans cette revue, nous allons décrire ces différentes modalités dans la stratégie globale de prise en charge du chordome de la base du crâne. 16.2. La complémentarité entre le neurochirurgien et le radiothérapeute Le chordome est une tumeur à tropisme principalement locorégional ayant tendance à récidiver localement et possédant un pouvoir métastatique relativement faible [308]. Le traitement de référence comporte une chirurgie suivie systématiquement d’une radiothérapie. La difficulté de ce traitement est directement lié aux contraintes que pose la proximité immédiate des structures neurologiques et vasculaires Aussi, outre le contrôle local, la gestion préventive des effets secondaires liés au traitement est primordiale. Cette prise en charge reste donc aujourd’hui un défi pour les neurochirurgiens et les radiothérapeutes, même avec le développement de la microchirurgie et des nouvelles méthodes d’irradiation. Une exérèse macroscopiquement complète est obtenue dans 62 à 79 % mais l’imagerie postopératoire révèle souvent des reliquats [309]. Même dans les cas où celle-ci semble complète, les taux de rechute sont élevés, de l’ordre de 12 à 60 % [309,310]. La chirurgie première est fondamentale et ses objectifs sont triples : réduction maximale du volume tumoral, prévention des effets secondaires, et création d’un espace suffisant (idéalement de quelques millimètres) entre la lésion et les organes critiques de voisinage. Après l’intervention, le radiothérapeute est partagé entre le fait de délivrer une dose tumoricide au chordome et de respecter les contraintes de dose appliquées aux structures à risque avoisinantes. Le différentiel de dose est souvent important. Par exemple, si le chordome (dose prescrite 73,8 Gy) est en contact avec le tronc
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
cérébral (dose maximale tolérée : 64 Gy), la dose minimale rec¸ue par la tumeur est la dose maximale tolérée par la structure à risque. Par conséquent, une partie de la tumeur est sous-dosée avec un risque de rechute dans cette zone [311]. Si un espace est créé entre la tumeur et l’organe à risque, alors le risque de sous-dosage diminue et ceci d’autant plus que la distance est grande et le gradient de dose du rayonnement utilisé est élevé (distance millimétrique pour passer de 20 % à 80 % de la dose délivrée). De ces données, il apparaît clairement que la collaboration entre le neurochirurgien et le radiothérapeute est très importante. La série du centre de protonthérapie d’Orsay a démontré que les facteurs pronostiques du contrôle local étaient la dose minimale rec¸ue par la tumeur (imposée par les structures à risque de voisinage) et la proportion de la tumeur recevant la dose prescrite [311]. Le volume postopératoire (volume seuil de 25 mL) n’apparaît pas comme un facteur pronostique évident du contrôle local dans la série de l’institut Paul Scherrer en Suisse (centre de protonthérapie) [312]. Afin de répondre à ces prérogatives, certaines équipes chirurgicales usent d’une attitude « agressive » avec la réalisation de plusieurs temps opératoires à voies d’abord variées pour obtenir une réduction tumorale optimale, et l’associe parfois à un comblement de la perte de substance par l’interposition de graisse [313], malgré le risque d’ensemencement des greffons décrits par certains [261]. 16.3. Radiothérapie des chordomes 16.3.1. Radiothérapie par photons Devant les taux de rechute élevés obtenus après une chirurgie exclusive, il a été initialement proposé une irradiation adjuvante par photons. La survie sans progression était toujours inférieure à 40 % dans les séries, avec des taux aussi bas que 17 %. La proximité des organes à risque par rapport à la tumeur et les propriétés balistiques des photons empêchaient de délivrer des doses supérieures à 60 Gy au niveau de la tumeur, ce qui impactait directement le contrôle local comme ceci apparaît dans le Tableau 8. 16.3.2. Hadronthérapie Le terme d’hadron, dérivé du grec « ␣␦о␥ », signifie « force ». Les hadrons sont composés de quarks (particules élémentaires du noyau). Le terme hadron est utilisé en radiothérapie pour les protons et les neutrons qui sont les constituants des noyaux et par extension pour les noyaux atomiques légers comme les atomes hélium, oxygène, carbone, connus aussi sous le terme de « ions légers » ou « ions lourds » pour le néon et l’argon [318]. À ce jour, les protons sont utilisés en routine et les ions Carbone sont en cours d’évaluation dans deux uniques centres : à Chiba au Japon et à Darmstadt en Allemagne. 16.3.3. Utilisation des protons 16.3.3.1. Aspect clinique. Les premières études cliniques d’irradiation par des protons remontent aux années 1950 suite à la découverte de leurs propriétés physiques. L’utilisation des protons est justifiée par leurs caractéristiques physiques et non biologiques. Leur effet biologique est quasi identique à celui des photons. La protonthérapie permet d’augmenter la dose dans la tumeur et d’épargner au maximum les organes critiques avoisinants grâce aux données balistiques de ces particules [311]. En raison de leur masse élevée, ces dernières diffusent très faiblement latéralement en dehors du faisceau. Lors de leur parcours, les particules de protons déposent une quantité croissante d’énergie pour s’arrêter brutalement en fin de trajectoire (appelé pic de Bragg). Cette particularité physique est fondamentale pour expliquer le gradient de dose qui peut être obtenu à proximité d’un organe critique. La dose varie de 10 à 15 % par millimètre de tissu traversé [311]. Les protons ont en effet permis une augmentation de la dose totale, une meilleure conformation des isodoses à la tumeur, et une
39
meilleure protection des tissus sains. Il a alors été montré que le contrôle local était amélioré et le risque de toxicité acceptable dans de très nombreuses séries. C’est pourquoi, depuis plusieurs années, l’irradiation par protons est devenue la technique d’irradiation de référence dans la prise en charge des chordomes de la base du crâne après chirurgie [306]. Les taux de survie sans progression étaient de 58 à 78 % à 5 ans (Tableau 9). 16.3.3.2. Tolérance de la protonthérapie. Les contraintes de dose appliquées aux organes à risque sont bien établies aujourd’hui pour la majorité des structures. Il peut arriver selon la topographie de la lésion tumorale, que l’hypophyse et l’oreille interne homolatérale à la tumeur ne soient pas protégées. Puisqu’un traitement substitutif peut être proposé en cas de toxicité (hormonal, auditif), la priorité est appliquée à la qualité de l’irradiation de la tumeur et non pas à la protection de ces deux structures. Ce raisonnement ne s’applique pas aujourd’hui aux autres structures nobles alentours. Aujourd’hui, les séries de protonthérapie sont les plus nombreuses, et le recul en termes de suivi des patients est le plus conséquent. Les effets secondaires tardifs de la radiothérapie (par définition, 6 mois après la fin de la radiothérapie et pouvant survenir des années plus tard de fac¸on imprévisible) commencent à être bien décrits. 16.3.3.3. Tolérance encéphalique temporale. En raison de la localisation du chordome, les régions temporales et les régions hippocampiques sont systématiquement irradiées à des niveaux de dose variables. Leur atteinte peut se manifester par une altération des fonctions neuropsychiques telles que la mémoire, les émotions et l’apprentissage. L’étude de Santoni et al. [327], comportant 96 patients, a montré des taux de complications neuropsychiques, respectivement à 2 et 5 ans, de 8 et 13 % pour ce type de traitement. L’étude de Glosser et al. [328], portant sur 17 patients irradiés jusqu’à 66 Gy ECO pour des tumeurs de la base du crâne, n’a retrouvé aucun effet secondaire cognitif précoce ou tardif ni de nécrose temporale chez les patients qui ne présentaient pas de récidive. Les résultats rapportés sont très variés, dépendant du nombre de patients, du suivi, des critères d’évaluation utilisés. À ce jour, aucune donnée dosimétrique n’est disponible pour proposer des recommandations en termes de contraintes de dose pour les lobes temporaux [329]. 16.3.3.4. Tolérance du tronc cérébral et de la moelle épinière. Debus et al. [330] ont étudié la tolérance du tronc cérébral chez 367 patients traités pour un chordome ou un chondrosarcome. Dixsept cas ont présenté une toxicité attribuable à l’irradiation avec une symptomatologie comportant différents tableaux de paralysies sensitivomotrices selon le niveau d’atteinte lésionnel. Quatrevingt-dix pour cent des patients souffraient de ces troubles dans les trois ans suivants l’irradiation. Parmi les trois patients décédés directement de cette complication, la symptomatologie avait débuté après 30 mois et le délai entre l’apparition des symptômes et le décès a été d’environ cinq mois. L’analyse de cette étude a permis de mettre en avant plusieurs facteurs pronostiques de cette complication : une dose d’irradiation supérieure à 60 GyECo dans plus de 0,9 cc de tronc cérébral, un antécédent de diabète et le nombre d’interventions chirurgicales antérieures à l’irradiation. Pour la moelle épinière, une analyse dosimétrique a étudié les histogrammes doses volumes et l’homogénéité de la dose chez 85 patients présentant une tumeur vertébrale cervicale. L’étude a montré 13 complications sensitivomotrices médullaires de grade 1–2 et quatre complications de grade 3 pour des doses au centre et à la surface de la moelle de respectivement, 55 à 58 GyECo et 67 à 70 GyECo. L’analyse multivariée a montré qu’aucun paramètre dosimétrique n’était associé à un risque surajouté de lésion médullaire. Le seul facteur significatif de lésion médullaire a été le nombre d’interventions chirurgicales [331].
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
40 Tableau 8 Séries d’irradiations des chordomes par photons. Photon irradiation of chordoma. Séries
Nombre de patients
Type de radiothérapie
Dose en Gy
Médiane de suivi en années
Survie globale à 5 ans ± 10 ans
Survie sans progression (%)
Magrini et al. [314] Forsyth et al. [269] Romero et al. [315] Catton et al. [316] Zorlu et al. [317]
12 39 18 24 18
Photons seuls Photons seuls Photons seuls Photons seuls Photons seuls
58 50 50,1 50 60
6 8,3 3,1 5,2 3,6
58 et 35 % respectivement 51 et 35 % respectivement 38 % Médiane de survie à 62 mois 35 %
25 39 17 23 23
Pour les deux structures évoquées ci-dessus, le nombre de chirurgies apparaissait comme un facteur de risque de toxicité. Il se pose toutefois la question du contexte de ces chirurgies : soit des chirurgies multiples suite à de multiples récidives non irradiées, soit une stratégie globale chirurgicale avec plusieurs voies d’abord afin d’obtenir une exérèse optimale avant une irradiation. Dans ce dernier cas, il semble que le gain apporté par la qualité de la chirurgie, même en plusieurs temps, soit supérieur aux risques de cette pluralité chirurgicale. A contrario, les gestes répétés en raison de l’absence d’une irradiation postopératoire immédiate sont à l’évidence plutôt délétère. 16.3.3.5. Tolérance hypophysaire. Pai et al. [332] ont étudié les complications endocriniennes chez 107 patients traités pour des tumeurs de la base du crâne avec des protons. Les endocrinopathies radio-induites ont été évalués respectivement à cinq et dix ans, avec 72 et 84 % d’hyperprolactinémie, 30 et 63 % d’insuffisance thyroïdienne, 29 et 36 % d’hypogonadisme, et 19 et 28 % d’hypocorticisme. Les doses supérieures à 50 GyECo au niveau du système hypothalamo-hypophysaire et 70 GyECo dans la glande hypophysaire semblaient être des facteurs de risque de ces complications. Aucun trouble de la fonction post-hypophysaire de type diabète insipide n’a été décrit. 16.3.3.6. Tolérance des voies optiques. Les voies optiques sont aussi des organes radiosensibles, souvent placés à proximité ou au contact de la lésion tumorale. Habrand et al. [333] ont montré que le taux de complications visuelles chez 20 patients atteints de tumeurs au niveau du clivus, était de l’ordre de 10 % pour une dose de 55 GyECo et de plus de 20 % pour des doses délivrées aux nerfs optiques ou au chiasma optique supérieures à 60 GyECo. Ceci souligne l’apport majeur d’une chirurgie optimale dans cette région pour limiter le volume résiduel postopératoire à proximité ou tout du moins au contact. 16.3.3.7. Tolérance cochléaire. La surdité radio-induite est une complication souvent décrite [334]. Cependant, les critères sont rarement définis. Schoenthaler a montré que pour deux tiers des patients qui ont souffert d’une perte auditive, l’oreille interne avait
rec¸u une dose d’irradiation supérieure à 62,7 GyECo. Une atteinte de la cochlée homolatérale à la tumeur relève certainement plus de la nécessité de traiter au mieux la tumeur et alors de l’impossibilité de protéger la cochlée que de la notion de toxicité (non souhaitée) par elle-même. 16.3.3.8. Tolérance des nerfs crâniens. À partir d’une analyse dosimétrique, Urie et al. [334] ont utilisé un système de planification en trois dimensions, pour étudier les complications nerveuses chez 27 patients et 594 structures nerveuses délinéées. Ils ont retrouvé seulement 17 souffrances nerveuses chez cinq patients. Le risque de complications était de 1 % à 60 GyECo et de 5 % à 70 GyECo. 16.3.4. Utilisation du carbone L’utilisation des ions carbone représente une modalité intéressante. En effet, ils possèdent les avantages physiques des protons (pic de Bragg) et une efficacité biologique relative supérieure, intéressante pour les tumeurs radio résistantes. Des résultats prometteurs ont été obtenus au Japon et en Allemagne. Mais cette technologie reste expérimentale et peu disponible dans le monde. En Allemagne, 96 patients atteints de chordomes de la base du crâne avec un résidu macroscopique postopératoire important ont été irradiés par ions Carbone à la dose de 60 GyECO délivrés en 20 fractions sur une période de 3 semaines. Avec un suivi médian de 31 mois, 15 patients ont présenté une récidive, le taux de contrôle local à 5 ans était de 70 % et la survie globale de 88,5 % à 5 ans. En termes de toxicité tardive, 4,1 % des patients ont présenté une neuropathie des nerfs crâniens de grade 3 et 7,2 % ont présenté une encéphalopathie temporale de grade 1–2. La dose délivrée par les ions carbones est biologiquement équivalente à un dose égale ou supérieure à 75 Gy equivalent cobalt et semble augmenter le contrôle local [307]. Un intérêt particulier est à porter dans l’avenir sur ce type de traitement en termes d’efficacité au long cours mais aussi en termes de toxicité, pour laquelle les données sont encore éparses. 16.3.5. Radiothérapie en conditions stéréotaxiques 16.3.5.1. Radiothérapie par Gammaknife. Le Gammaknife est un système d’irradiation dédié à la neurochirurgie, c’est-à-dire une
Tableau 9 Séries d’irradiation par protons. Proton irradiation. Type de radiothérapie
Dose en GyECO
Médiane de suivi en mois
Survie globale à 5 ans ± 10 ans
Survie sans progression à 5 ans
45
Protons ± photons
59,4–80
62 %
59 %
Austin-Seymour et al. [320] Benk et al. [321] Hug et al. [322] Munzenrider et Liebsch [323]
68 18 58 621
Protons ± photons Protons ± photons Protons ± photons Protons ± photons
Médiane 69 Médiane 69 (55,8–75,6) Moyenne 70,7 66,8
33 patients suivi > 12 mois 34 72 NC 41
Noël et al. [311] Igaki et al. [324] Fuji et al. [325] Rombi et al. [326]
100 13 8 19
Protons ± photons Protons ± photons Protons ± photons Protons
67 72 63 74
31 69,3 42 46
82 % 68 % 79 % 80 à 5 ans 54 à 10 ans 80,5 % 66,7 % 100 % à 3 ans 81 %
58 % 78 % 59 % 73 à 5 ans 54 à 10 ans 53,8 % à 4 ans 42 % 100 % à 3 ans 89 %
Séries Berson et al. [319]
Nombre de patients
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
41
Tableau 10 Séries de radiochirurgie. Radiosurgery. Séries
Nombre de patients
Histologie tumorale
Suivi médian
Taux de contrôle tumoral au cours du suivi
Survie globale
Muthukumar et al. [335] Pamir et al. [336] Feigl et al. [337]
15
40
73 %
NC
23 17
72 % 93 %
NC NC
Krishnan et al. [338]
29
9 CD 6 CS 7 CD 3 CD 10 CS 25 CD 4 CS
54 57,6
NC
Martin et al. [339]
28
Liu et al. [340] Ito et al. [52]
31 19
18 CD 10 CS 31 CD 19 CD
90 76 (6–102) 87,2 après la chirurgie initiale
75 % 32 % de contrôle à 5 ans 62 % (5 ans) 80 % (5 ans) 21,4 % (5 ans) 47,9 % (5 ans)
7 13
radiothérapie en conditions stéréotaxiques en dose unique pour les lésions crâniennes exclusivement. Cet appareil peut être utilisé en traitement adjuvant des chordomes de la base du crâne en situation postopératoire, ou après radiothérapie classique en cas de récidive tumorale. La dose médiane prescrite sur l’isodose 50 % est comprise entre 12 et 16 Gy dans les principales études. Le contrôle local est augmenté de manière significative dans les différentes études (Tableau 10). Dans la série d’Ito et al. [52], 11 patients sur 19 atteints d’un chordome du clivus opérés, ont présenté une récidive. Un traitement par Gammaknife a été effectué pour les 11 récidives et tous les patients étaient vivants au terme des 5 ans de suivi avec un index de Karnofsky moyen de 89,5 %. Dans d’autres séries, le contrôle local variait de 21 % à 93 %. Il faut noter que ces séries comportent peu de patients, et un recul faible. Il est aussi important de rappeler que la radiochirurgie peut se proposer pour des tumeurs de petit volume (inférieur à 14 cc soit 3 cm de diamètre) et situées à distance des voies optiques. 16.3.5.2. Radiothérapie par Cyberknife. Le Cyberknife est un accélérateur linéaire miniaturisé fixé à un bras robotisé piloté par ordinateur permettant d’orienter les faisceaux dans toutes les directions possibles avec une précision de positionnement inférieur à 1 mm. Un système couplé d’imagerie permet un guidage en temps réel, avec recentrage immédiat des faisceaux d’irradiation par le robot. Le Cyberknife est une modalité thérapeutique intéressante pour toutes les localisations axiales et extra-axiales du chordome qui se pratique avec un hypofractionnement, c’est-à-dire avec des doses par fraction supérieure à 2,25 Gy. Dans l’étude d’Henderson et al. [341], la dose recommandée était de 40 Gy en 5 fractions sur le volume tumoral macroscopique avec une marge de 1 cm. Le faible nombre de séries et les faibles effectifs ne permettent pas d’établir de recommandations à ce jour quant à la place du Cyberknife dans le traitement du chordome (Tableau 11). Toutefois, cette technologie de haute précision couplée à une imagerie embarquée laisse envisager un avenir à confirmer dans les ré-irradiations de chordome ou encore dans des études d’efficacité avec modification du fractionnement. 16.3.5.3. Radiothérapie en condition stéréotaxique avec fractionnement classique. Hauptman et al. [343] se sont intéressés à l’irradiation en conditions stéréotaxiques adjuvante avec un accélérateur linéaire de 10 patients atteints de chordome de la base du crâne. L’irradiation s’est effectuée par fraction de 2 Gy par séance avec des doses maximales totales variant entre 53 et 84 Gy. Six
62 % 75,8 % à 5 ans 100 % à 5 ans
tumeurs sur dix sont restées stables ou ont diminué après une dose moyenne de 57,7 Gy, parmi lesquels deux ont bénéficié d’une arc-thérapie dynamique. Le suivi moyen a été de 54 mois. Les effets secondaires de l’irradiation stéréotaxique fractionnée ont été une endocrinopathie et une neuropathie d’un nerf crânien chez deux patients différents. L’équipe d’Heidelberg a rapporté un taux de contrôle local à 5 ans de 50 % après une irradiation stéréotaxique normo-fractionnée pour une dose totale de 66,6 Gy chez 37 patients avec un seul cas de toxicité avec atteinte du tronc cérébral [344]. 16.4. Conclusion La prise en charge du chordome de la base du crâne nécessite une expertise neurochirurgicale et radiothérapeutique concomitante. La microchirurgie doit être maximaliste au niveau des organes critiques tels que le tronc cérébral, la moelle épinière, l’appareil opto-chiasmatique afin d’améliorer le contrôle local et la prise en charge secondaire par le radiothérapeute ; en limitant toutefois les risques de par cette complémentarité. La protonthérapie est actuellement la deuxième composante du traitement standard dans la prise en charge des chordomes. Plusieurs autres techniques de radiothérapie se sont développées et pourront constituer des alternatives, soit à cause de la rareté des centres de protonthérapie dans le monde, même si l’émergence de nouveaux centres est importante, soit par l’intérêt intrinsèque de ces techniques de haute précision. Des études comparatives randomisées seront nécessaires pour mieux définir la place des différentes techniques de radiothérapie dans la stratégie globale. 17. Biologie moléculaire Malgré un traitement chirurgical agressif et en dépit d’une exérèse complète voire en bloc, une récidive est quasiment inéluctable ; un traitement complémentaire est donc nécessaire. Les différentes radiothérapies utilisées aujourd’hui semblent ne pouvoir que retarder, mais non pas empêcher, la récidive. Les différents essais de chimiothérapie utilisant les protocoles préconisés dans le traitement des sarcomes, n’ont apporté que peu ou pas de bénéfice en termes de survie ou de récidive. Les thérapies ciblées basées sur la biologie moléculaire de la pathogenèse, de la croissance et de la prolifération tumorale est en plein développement dans tous les cancers et également dans le chordome. Pour celui-ci, les données commencent à s’accumuler et on voit apparaître quelques
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
42 Tableau 11 Séries de traitement par Cyberknife. Treatment by Cyberknife. Séries
Nombre de patient
Localisations
Place de la radiothérapie
Suivi médian
Henderson et al. [341]
18
35 (24–40)
20
Adjuvant : 17 Traitement premier : 1 Adjuvant : 11 Récidives : 9
46 mois (24–40)
Jiang et al. [342]
Base du crâne : 7 Rachis : 8 Sacrum : 3 Base du crâne : 13 Rachis : 4 Sacrum : 3
34 mois (2–131)
32,5 (18–50)
essais cliniques. C’est sur ces données que sont basés les espoirs soit de thérapies néoadjuvantes qui pourraient réduire le volume tumoral avant la chirurgie, soit de thérapies complémentaires postopératoires qui permettraient de réduire l’agressivité chirurgicale. Comme pour de nombreux cancers, des anomalies chromosomiques ont pu être détectées dans la plupart des chordomes [345]. Ces anomalies sont représentées par des altérations du nombre de copies d’ADN, soit sous forme de pertes, observées le plus souvent sur les bras chromosomiques 9p, 3p et 1p soit sous forme de gains sur 7q, 20,5q et 12q. Il faut rappeler que le gène T de la brachyurie en 6q27 et du CD 24 sont sélectivement exprimés dans la quasitotalité des chordomes tout comme les cytokératines. Les délétions seraient plus fréquentes que les amplifications [346,347]. Ces altérations auraient également une valeur pronostique [348] ; selon Almefty et al. [349], le taux de survie sans récidive à 5 ans serait de 84 % en l’absence d’anomalies chromosomiques et seulement de 34 % en cas de caryotype anormal. Pour l’instant, les altérations chromosomiques, hormis celles concernant la Brachyurie, sont trop disparates pour en tirer d’éventuelles conclusions thérapeutiques. C’est plutôt sur les perturbations (secondaires aux anomalies chromosomiques) des voies de transduction et de transcription que les recherches paraissent les plus prometteuses. Néanmoins, jusqu’à présent, tous les essais de traitement inhibant spécifiquement une de ces voies, n’ont apporté que des résultats modestes faisant d’ailleurs s’orienter aujourd’hui plutôt vers des combinaisons de traitement à base d’inhibiteurs de différentes étapes de ces voies de transduction. La première étape des voies de transduction concerne la Tyrosine Kinase dont le récepteur (RTK) est l’une des familles de protéines les plus étudiées dans différents cancers et dans le chordome. Il existe au moins 58 RTK différents mais agissant tous par le même mécanisme. Les RTK sont les éléments les plus importants par lesquels des facteurs extracellulaires (essentiellement des facteurs de croissance) vont stimuler la croissance et la prolifération tumorale via une cascade de facteurs jusqu’au noyau de la cellule (Fig. 53). L’activation par phosphorylation des RTK se fait par l’intermédiaire d’un ligand correspondant à différents facteurs ; les plus importants mis en évidence sont l’epidermal growth factor (EGF), le transforming growth factor (TGF), le platelet-derived growth factor (PDGF) et l’hepatocyte growth factor (c-MET). Tous ces facteurs sont exprimés dans une majorité de chordomes et interviennent dans la régulation de la prolifération cellulaire. Le RTK activé induit l’activation de différentes voies vers le noyau. Les voies les plus classiques sont celles empruntant soit PI 3 (phosphoinositide 3-kinase), AKT, mTOR (mammalian target of rapamycine), soit le système rénine-angiotensine (RAS), la mitogen-activated protein kinase (MEK) et l’extracellular signal-regulated kinase (ERK) soit enfin la protéine activatrice du signal tranducer et activator of transcription (STAT 3). En fait, il existe de nombreux mécanismes par lesquels une dysrégulation dans la cascade RTK jusqu’au noyau de la cellule aboutit à une transformation maligne et à sa prolifération. On peut citer :
Dose en Gy
Contrôle local
Survie globale
59,1 % à 65 mois
74,3 % à 65 mois
Adjuvant : 81,8 % Récidives : 28,6 %
52,5 % à partir du premier traitement par CK
la surexpression des facteurs de croissance, ligands des RTK, ou une mutation aboutissant à une activation continue ou encore une mutation avec amplification des gènes. Un exemple est représenté par le gène TSC (sclérose tubéreuse de Bourneville) qui peut être inactivé par une surexpression de l’EGFR induisant ensuite une activation de PI 3 puis de AKT et de mTOR. L’inhibition des protéines TSC active le mTOR et déclenche la croissance cellulaire et la prolifération tumorale. C’est le probable mécanisme conduisant à l’association Sclérose Tubéreuse et chordome. Un autre exemple s’observe avec l’hétérozygotie du gène 1p, fréquente dans les chordomes et possiblement à l’origine de l’activation du gène mTOR localisé en 1p36,2. Par conséquent, l’utilisation thérapeutique d’inhibiteur du mTOR (rapamycin analogs ou sirolimus) paraît logique dans les chordomes ayant une surexpression de l’EGFR, une inactivation du complexe TSC1/2 et une activation du mTOR. C’est ce qui a été essayé chez 10 patients ne répondant pas à une inhibition du PDGFR (imatinib) par Stacchiotti et al. [350] en 2009 avec une réponse partielle pour 7 d’entre eux à 3 mois. Sur des lignées cellulaires (UCH-1), Schwab et al. ont utilisé un inhibiteur simultanément de la PI 3 et du mTOR, le PI-103 et a obtenu une diminution de la prolifération en induisant une apoptose [351]. En fait depuis quelques années, différents essais cliniques ont été réalisés avec différents inhibiteurs. Le premier en date fut l’imatinib, inhibiteur du PDGFR sur la base des résultats obtenus sur d’autres cancers et notamment le cancer gastro-intestinal et la leucémie myéloïde chronique [352,353]. Il a ensuite été testé sur le chordome [199,354] chez 6 puis 18 patients avec des réponses assez modestes : diminution de la prise de contraste chez 11 patients et diminution du volume tumoral chez seulement 2 des 18 patients ; néanmoins la plupart des patients se sont améliorés cliniquement et l’effet s’est prolongé pendant un an. Une autre étude [355], multicentrique sur 56 patients a montré une stabilité tumorale dans 70 % des cas. La médiane sans progression tumorale était de 32 semaines avec 38 % des cas sans progression tumorale à un an. Il faut reconnaître que si ces résultats ne sont pas très impressionnants, il s’agissait dans la majorité des cas de traitements donnés à titre compassionnel chez des patients porteurs de chordomes en phase avancée ayant épuisé les autres modalités thérapeutiques. Plusieurs « case reports » ont également porté sur des inhibiteurs de l’EGFR [356–358] tels que le cétuximab, le géfitnib et l’erlotinib. Pour l’instant l’inactivation du récepteur c-MET, retrouvée dans environ 80 % des chordomes crâniens et rachidiens [359,360] n’a pas été explorée, bien qu’elle ait montré une certaine efficacité dans d’autres cancers [361]. Puisque la cascade impliquée dans la plupart des chordomes est celle de PI 3/AKT/mTOR [362,363], son blocage en l’un de ces points paraît pouvoir être plus efficace que celle des facteurs d’activation de la RTK. En effet, compte tenu du nombre de RTK, l’inactivation
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
43
Fig. 53. Schéma des différents facteurs de transduction et de transcription intervenant dans la croissance et la prolifération cellulaire depuis la membrane cellulaire avec les différents récepteurs qui activent la Tyrosine Kinase (PDGFR, EGFR, c-MET) et les cascades intracellulaires principales notamment PI3K, Akt, mTOR et STAT3. Scheme of the different factors of transduction and transcription modifying the tumoral growth and cell proliferation from the cell membrane to the nucleus. It shows the receptors activating the Tyrosin kinase (PDGFR, EGFR, c-MET) and the intracellular cascades, essentially: PI3K, Akt, mTOR, and STAT3. D’après Barry et al. [569] ; publié avec l’autorisation de Wolters Kluwer.
de l’un d’entre eux laisse les autres possiblement actifs. Les RTK activant presque toujours la même cascade, l’idée d’agir sur un des facteurs de cette cascade paraît plus satisfaisante. Il existe plusieurs inhibiteurs du mTOR : sirolimus, RAD001, CCI-779 qui sont en cours d’études [364] dans plusieurs essais cliniques. Il a également été testé un inhibiteur du STAT3 qui est retrouvé sous sa forme activée dans de nombreux chordomes y compris et de fac¸on encore plus importante dans les formes récidivantes et métastatiques. Pour Yang et al. [144], il existe une corrélation entre le niveau d’expression du Stat3 et le pronostic. Ils retrouvent le Stat 3 exprimé chez les 70 patients étudiés. De plus, ils ont utilisé le SD-1029 sur 3 lignées cellulaires différentes de chordomes et obtenue par inhibition du STAT3 un arrêt de la croissance cellulaire avec apoptose. Ils ont également montré un effet synergique du SD-1029 et du cisplatine ou de la doxorubicine sur la mort des cellules de chordomes. L’inhibition du STAT3 par cet agent paraît d’autant plus intéressant que les cellules normales semblent tolérer parfaitement la perte de la fonction du STAT3. Mais là encore on se heurte à un nouvel écueil : l’existence d’un effet «feed back» négatif qui fait que les facteurs en amont du facteur inactivé, sont eux hyperactivés. C’est probablement le cas de PI 3/AKT en amont du mTOR inactivé. Par conséquent on se tourne maintenant vers soit des inhibiteurs agissant à plusieurs niveaux comme le PI-103 bloquant le mTOR mais aussi l’AKT soit des combinaisons d’inhibiteurs agissant à différents niveaux ; par exemple inactivation des facteurs d’activation des RTK et du mTOR. Une étude par Stacchiotti et al. [350] a ainsi testé l’association iminitab (PDGFR) plus sirolimus (mTOR) sur 10 patients réfractaires à l’iminitab seul, et obtenu une réponse, là encore, pas très importante. Ce type d’association a également été essayé dans les gliomes [365–367]. Un gène suppresseur naturel, le PTEN (phosphatase et tensine homologue), pourrait être le candidat de ce type d’association thérapeutique. PTEN inhibe le passage PI3 vers AKT ; lorsqu’il disparaît ou est muté, AKT est activé ainsi que la suite de la chaine et notamment mTOR. Une perte ou une mutation du gène de PTEN a été démontré dans de nombreux cancers : 40 % des gliomes et 25 % des
chordomes. Ces chordomes comme les gliomes déficients en PTEN s’avèrent résistants aux monothérapies. En revanche, l’association d’un inhibiteur de l’EGFR à un inhibiteur du mTOR a montré dans les glioblastomes un meilleur effet sur la prolifération tumorale que l’un d’entre eux utilisé isolément [361]. On ne fera que rappeler les espoirs que donne la Brachyurie, marqueur très spécifique des chordomes et dont l’inhibition in vitro entraîne la régression tumorale (cf le chapitre sur la Brachyurie). Il faut ajouter que pour certains, il reste une place pour les chimiothérapies classiques isolée ou associée aux chimiothérapies ciblées ; par exemple imatinib et cisplatine [354,368–371]. Une autre technique utilisant l’injection intratumorale de carboplatine dont la concentration est renforcée par de l’épinéphrine a été rapportée par l’équipe de Dijon [372]. Il semble que l’on puisse ainsi induire une nécrose tumorale avec réduction volumique (de 42 %) mais elle nécessite d’être fréquemment répétée ; dans le cas rapporté, 11 injections ont été réalisées en 18 mois. Une autre publication [373] rapporte le traitement de 7 patients par injections percutanées (22 au total) dans des chordomes sacrococcygiens récidivants d’un mélange de pingyamycin et de lipiodol. Avec un suivi allant de 10 à 26 mois, les auteurs observent une régression tumorale dans tous les cas sans complication particulière. Au total, le besoin d’une chimiothérapie complémentaire est évident et en particulier pour les chordomes de la base du crâne pour lesquels l’exérèse chirurgicale est difficilement complète. Pour l’instant, les essais thérapeutiques ont surtout porté sur des chordomes récidivants en fin d’évolution avec peu de succès. Néanmoins, des progrès importants ont été obtenus dans la compréhension des mécanismes qui régulent la prolifération cellulaire et la croissance tumorale de différents cancers, ce dont a profité le chordome. Il paraît démontré que ce sont des associations d’inhibiteurs agissant en différents points des voies de la transduction intracellulaire qui ont le plus de chance d’être efficaces. Les combinaisons possibles sont multiples (association d’inhibiteurs des RTK, d’inhibiteurs de RTK et mTOR, d’inhibiteurs mTOR et PI 3/AKT, etc.) ; peut -être faut-il trouver celle adaptée à chacun des cas de chordomes en fonction des facteurs qu’ils expriment.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 44
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
18. Thérapie ciblée : prise en charge systémique des formes avancées et métastatiques, une revue de la littérature (E. Boissier, V. Calugaru, S. Vignot, S. Bolle, R. Dendale, L. Feuvret) 18.1. Historique Très peu d’études ont été réalisées pour évaluer l’efficacité de la chimiothérapie, du fait de la rareté de la pathologie et de la difficulté de mettre en œuvre des études prospectives homogènes. En pratique, la chimiorésistance de ces tumeurs est reconnue même si des résultats positifs et isolés ont pu être rapportés avec les anthracyclines, les agents alkylants, le cisplatine et la thalidomide [285,369]. Les séries rapportant l’utilisation d’anthracyclines dans le cadre de la prise en charge des chordomes en progression sont nombreuses et retrouvent une certaine efficacité [285,369,374,375]. Plus récemment, une étude de phase II prospective a évalué l’intérêt du 9 nitrocamptothecin à la dose de 1,25 mg/m2 (inhibiteur de la topo-isomérase) chez 51 patients atteints de chordomes, de tumeurs gastro-intestinales et de sarcomes. Un seul patient sur les 15 ayant un chordome a présenté une réponse objective. Pour l’ensemble des patients atteints de chordomes la survie sans progression était de 47 % à 3 mois et de 33 % à 6 mois [376]. Les principaux effets secondaires retrouvés étaient l’hématotoxicité, une asthénie et des troubles digestifs (nausées et diarrhées). Les mécanismes expliquant cette chimiorésistance ne sont pas clairs. Ji et al. [377] ont retrouvé la surexpression de deux gènes, connus pour être des gènes de chimiorésistance dans les cancers (hypoxia-inducible factor 1 ˛ [HIF-1˛] et multidrug resistanceassociated protein 1 [MRP1]). Ces deux gènes pourraient aussi être impliqués dans le cadre des chordomes. Le niveau de prolifération habituellement bas de ces tumeurs pourrait également intervenir ainsi que la diffusion plus ou moins bonne des agents au sein de la lésion, notamment après irradiation. 18.2. Nouveautés Elles concernent la génétique et les voies de signalisation intra- ou extracellulaires. 18.2.1. Génétique L’analyse cytogénétique des chordomes a révélé la présence de caryotypes complexes, comme dans les sarcomes, avec principalement des caryotypes diploïdes, ou parfois hypodiploïdes. Au sein de ces caryotypes, de nombreux réarrangements à la fois en nombre et en structure ont été constatés. Le plus souvent, il a été observé, sur certaines régions, une perte des chromosomes 3, 4, 10, 13 [378]. Plus rarement, des gains au niveau des chromosomes ont aussi été identifiés, au niveau des chromosomes 5q, 7 et 20. Aucune amplification de gènes n’a été retrouvée. Les gènes suppresseurs de tumeurs CDKN2A et CDKN2B situé en 9p21,3 peuvent être délétés. Ces anomalies ont été confirmées par la méthode d’Hybridation In Situ en Fluorescence (FISH) dans plus de 70 % des patients atteints de chordomes. Ces gènes pourraient constituer une étape majeure dans l’oncogenèse des chordomes [347]. Dans l’étude de Miozzo et al. [232], il a été identifié la perte de l’hétérozygotie chez deux sœurs, au niveau du gène 1p36, qui serait un gène suppresseur tumoral, et qui a été retrouvé dans les formes familiales de chordomes. Mais seulement quelques cas isolés de formes familiales ont été décrits dans la littérature, repris dans la revue de Bhadra [231] en 2006. Le faible nombre de formes familiales recueillies rend l’interprétation de ces données prudente. Des études récentes ont montré une hyperexpression du gène T (Brachyury) dans les chordomes du sacrum. Une liaison entre la duplication du gène T (Brachyury) et les chordomes familiaux a
été trouvée par Yang et al. [143], mais il n’existe pas à ce jour d’application thérapeutique suite à la mise en évidence de ces remaniements chromosomiques. 18.2.2. Voies de signalisations Parallèlement aux études génétiques, la surexpression de plusieurs protéines pouvant jouer un rôle crucial dans l’oncogenèse des chordomes ont été décrites [379–382]. Ces protéines sont à l’origine de l’activation en cascade de différentes voies de signalisations modulant la prolifération tumorale et la survie cellulaire. Ces mécanismes pourraient être bloqués par des inhibiteurs en cours de développement, ce qui constituerait alors de nouvelles armes thérapeutiques dans les chordomes avancés. On peut retrouver, dans la littérature, la description du rôle essentiel des récepteurs tyrosines kinases (RTK), avec plus spécifiquement les récepteurs des facteurs de croissance plaquettaires (principalement PDGFRB), les récepteurs KIT, EGFR, IGFR et MET [356]. Ces récepteurs peuvent être activés par 3 mécanismes : • activation par son ligand spécifique, le plus fréquent ; • mutations-gains de fonction ; • amplification génique du récepteur qui peut être responsable d’une hyperexpression du récepteur. L’activation du récepteur par l’un de ces mécanismes va être responsable de sa dimérisation puis de sa phosphorylation dans son domaine intracellulaire. Il en résulte une activation de protéines spécifiques, qui à leur tour vont activer d’autres voies de signalisations intracellulaires. 18.3. Récepteurs à activité Tyrosine Kinase (RTK) 18.3.1. Platelet-derived growth factor receptor ˇ (PDGFRB) Le PDGFRB est une protéine transmembrannaire, composée d’une partie extra cellulaire et d’une partie intracellulaire. Son activation va jouer un rôle primordial dans la prolifération cellulaire et la différentiation embryonnaire. La PDGFRB, par rapport aux autres RTK, a la particularité de favoriser la croissance tumorale par l’activation de l’angiogenèse. En 2004, Casali et al. [550] ont démontré l’expression de PDGFRBéta par RT-PCR au niveau de 6 cas de chordomes avancés avec pour quatre d’entre eux une hyperexpression et une phosphorylation de cette molécule. Plus récemment, en 2010, Tamborini et al. [379] ont observé parmi 22 cas de chordomes, une activation de PDGFRB dans 95 % des cas. Son activation serait due à une boucle autocrine/paracrine avec surexpression du ligand PDGF. À ce jour, aucune mutation spécifique n’a été retrouvée pour ce récepteur. 18.3.2. Epidermal growth factor receptor (EGFR) L’EGFR est un récepteur connu pour être impliqué dans la genèse de nombreux cancers. À ce jour, il est reconnu comme proto-oncogène dans les cancers des voies aéro-digestives supérieures [383], dans le cancer du sein [384], du poumon [385], du côlon [386] et des tumeurs gliales malignes [387]. Il s’agit d’un récepteur transmembranaire dont le principal ligand est l’epidermal growth factor (EGF) mais aussi le transforming growth factor ˛ (TGF␣) et d’autres facteurs de croissance. L’interaction spécifique ligand-récepteur va entraîner l’activation du récepteur EGFR. Celui-ci va être reconnu par de nombreuses protéines possédant un domaine spécialisé appelé Src Homology 2 (SH2). Ces protéines, porteuses du domaine SH2, seront capables d’activer la voie des MAP kinases et la voie des PI3K. L’EGFR est impliqué principalement dans la tumorogenèse et dans la croissance tumorale. L’étude de Dewaele et al. [380] a observé chez 39 patients une hyperexpression de l’EGFR dans 26 cas. Il s’agissait dans 80 % des
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
cas de tumeurs avancées. Ces résultats sont confirmés par la série de Shalaby et al. [381] avec 173 chordomes analysés parmi lesquels une expression EGFR est observée dans 69 % des cas, avec forte suspicion du rôle d’un signal EGFR aberrant, après analyse par FISH. Tout comme le PDGFRB, l’EGFR n’a pas été retrouvé muté dans les chordomes.
18.3.3. Insuline growth factor receptor (IGFR) Ce récepteur transmembranaire jouerait un rôle dans la prolifération, la différenciation, la survie cellulaire, par protection de l’apoptose et la migration cellulaire. Il va activer les voies RAS/MAPK et PI3K/AKT. Mitsuhashi et al. [382] ont analysé l’expression du récepteur IGF1 et ont trouvé une hyperexpression de l’IGFR1 dans les chordomes. Ces résultats ont été confirmés par Sommer et al. [388], avec 41 % des tumeurs de sa série qui exprimaient l’IGFR. Le ligand IGF est connu pour être un marqueur de chimiorésistance dans certaines tumeurs dont les sarcomes [389]. Récemment, Scheipl et al. [390] ont démontré chez 50 patients atteints de chordomes une coexpression de l’IGFR 1 (76 %) et de l’IGF (92 %). Conjointement, une corrélation entre le volume tumoral et l’intensité de l’expression de IGF1R a été mise en évidence pour les tumeurs localisées (38).
18.3.4. MET Il s’agit d’un RTK qui est normalement activé lors de l’embryogenèse et de fac¸on pathologique dans de nombreuses tumeurs. Son ligand principal est le hepatocyte growth factor (HGF). Les récepteurs MET sont principalement exprimés dans les tissus chondroïdes, articulaires, cartilagineux et les tissus notochordaux, pouvant expliquer leur expression dans les chordomes [391]. Sa dérégulation favorise les capacités de survie, de prolifération, de motilité et de morphogenèse des cellules épithéliales, permettant le développement tumoral et la progression métastatique [346,392]. Pour Naka et al. [393], c-MET est exprimé dans 70 % au moment du diagnostic et dans 88 % des récidives de chordomes de la base du crâne. L’expression isolée de c-MET était corrélée à l’expression d’un marqueur épithélial, la cytokératine de faible poids moléculaire CAM5,2, au jeune âge du patient, et à un bon pronostic chez les patients atteints de chordomes de la base du crâne. Cependant la co-expression HGF/c-MET, par sécrétion paracrine, est associée à une agressivité tumorale, surtout en cas de rechute et est donc un facteur de mauvais pronostique [393,394].
18.3.5. KIT KIT est un RTK jouant un rôle majeur dans la prolifération tumorale. Son principal ligand est le Stem Cell Factor (SCF). Il est exprimé dans de multiples cancers chez l’homme (GIST, séminomes, mastocytoses, carcinomes adénoïdes kystiques) [395,396]. Il a été trouvé de fac¸on moins fréquente dans les chordomes mais semble jouer un rôle primordial dans le développement tumoral, principalement dans la survie, la prolifération et la différentiation cellulaire [199,356,397].
18.3.6. Voie mTOR Ces différents récepteurs activés vont entraîner principalement l’activation secondaire de deux voies : PI3K/AKT et RAS/MAPK, qui à leur tour vont activer la voie Mammalian Target of Ripammycin (mTOR) et ses protéines régulatrices de la transcription : S6K/S6 et 4 E-BP1. Dans les chordomes, les RTK seraient activés, principalement par expression paracrine et autocrine du ligand. Tamborini et al. [379,397] ont suggéré d’utiliser une association d’inhibiteurs des RTK et d’un inhibiteur mTor afin d’optimiser le contrôle tumoral.
45
18.4. Les molécules existantes 18.4.1. Imatinib L’imatinib mésylate est un inhibiteur pharmacologique des récepteurs PDGF, KIT et de protéine de fusion Bcr-Abl. Il est actuellement utilisé dans le traitement des leucémies myéloïdes chroniques et des tumeurs stromales digestives. La première utilisation dans les chordomes a été rapportée en 2004 par Casali [550] chez six patients atteints d’un chordome exprimant PDGFR avec une réponse tumorale sous forme de diminution de prise de contraste en imagerie ou de la fixation de FDG au PET. Ces résultats ont été confirmés par une étude prospective de phase II multicentrique incluant 55 patients [355]. Ces patients atteints de chordomes à un stade avancé, présentaient une hyperexpression de PDGFR . Une réponse partielle selon les critères RECIST était rapportée chez 2 % des patients et une stabilité chez 70 % des patients avec une médiane de survie sans progression de 9,1 mois. Un bénéfice clinique est observé dans 64 % des cas. En dehors d’une faible hématotoxicité, le principal effet secondaire est une rétention d’eau avec œdème périorbitaire (25 % des cas). Cette inhibition sélective du PDGFR par l’imatinib, chez les patients présentant un chordome avancé avec expression PDGFR est la première thérapie moléculaire ciblée ayant pu montrer une activité. 18.4.2. Imatinib et cisplatine Après une réponse initiale à l’imatinib, une nouvelle progression peut apparaître et l’association de l’imatinib à la dose de 400 mg/j à du cisplatine à faibles doses (25 mg/m2 par semaine) peut s’avérer efficace, confirmant les données in vitro de l’effet du cisplatine (Casali). Chez 4 des six patients de la série de Casali [550], a été observée une réponse tumorale dont deux avec une diminution tumorale radiologique. L’efficacité du cisplatine en monothérapie n’ayant pas été démontrée, ceci pourrait supposer une action synergique entre l’imatinib et le cisplatine dont le mécanisme n’est pas clair à ce jour [398]. 18.4.3. Imatinib et sirolimus Le sirolimus ou rapamycine est un immunosuppresseur de la protéine mTOR. Cet inhibiteur va entraîner un blocage du cycle cellulaire et de l’angiogenèse [399]. Des dérivés de la rapamycine (temsirolimus, everolimus) sont actuellement utilisés dans le traitement des cancers du rein [400], du sein et dans les lymphomes du manteau. Ces agents sont également en cours d’évaluation dans la prise en charge des cancers de l’endomètre et certains sarcomes. Stacchiotti et al. [350] ont analysé l’efficacité de l’association imatinib (400 mg/j) plus Siromilus (2 mg/j) en deuxième ligne après échec de l’imatinib seul, dans une série de 10 patients présentant un chordome. Une réponse tumorale a été observée chez 7 patients, avec pour 4 d’entre eux une réponse de plus de 10 % selon les critères de Choi et al. [24]. Un autre patient était considéré comme stable et l’autre progressait. Selon les critères de RECIST, un patient avait une réponse partielle, sept patients une stabilité et un patient une progression tumorale. Au niveau du PET-TDM, sept patients étaient en réponse radiologique. Le bénéfice clinique (défini selon RECIST par la somme de réponse complète [RC] + réponse partielle [PR] + stabilité [SD] ≥ 6 mois) était de 89 % à 6 mois. Les principaux effets secondaires étaient une hématotoxicité, des infections de grade 3 et une mucite de grade 1–2. 18.4.4. Anti-EGFR L’erlotinib et le géfitinib sont des inhibiteurs sélectifs du récepteur EGFR. Ils bloquent la transduction du signal et a priori la multiplication cellulaire. Leur indication est reconnue dans les cancers pulmonaires non à petites cellules, notamment chez les patients mutés EGFR et dans les cancers pancréatiques.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 46
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Le cétuximab est un anticorps monoclonal humain qui bloque le récepteur EGF. Il n’y a pas eu de phase 2 utilisant des anti-EGFR dans les chordomes avancés. Il ne s’agit que de cas isolés. Deux cas d’association du cétuximab et du géfitinib sont rapportés dans la littérature. Le premier cas était celui d’un patient atteint d’un chordome sacré avec des métastases pulmonaires ayant présenté une réponse partielle pendant 9 mois [356]. Le deuxième cas était celui d’un patient avec un chordome du clivus ayant présenté une réponse tumorale de l’ordre de 40 % à 4 mois [357]. Concernant l’erlotinib, deux cas sont décrits dans la littérature. Singhal et al. [358] ont observé, chez un patient, une réponse tumorale de plus de 30 % à 3 mois. Launay et al. [401] ont également constaté une réponse tumorale de 53 % à 3 mois et de 70 % à 6 mois chez un patient. Dans les deux cas, la réponse a été maintenue plus de 11 mois. Ces cas isolés témoignent du rôle potentiel du ciblage de la surexpression de l’EGFR qui doit être encore explorée. 18.5. Autres options thérapeutiques Une alternative au traitement systémique pourrait être l’injection intratumorale de carboplatine associée à l’épinéphrine permettant d’améliorer l’effet antitumoral du carboplatine. Il a été observé chez un patient une réponse partielle avec une diminution de 42 % du volume tumoral sur l’imagerie et une bonne réponse clinique avec nette amélioration de la compression médullaire [372]. L’association chirurgie et chimiothérapie intratumorale a permis d’obtenir un bon contrôle local chez cet unique patient et peut être une piste de recherche. À ce jour, il n’a pas été retrouvé de données sur l’intérêt de l’utilisation d’un traitement systémique en néoadjuvant de la chirurgie ou de la radiothérapie. Ce traitement pourrait réduire le volume tumoral avant chirurgie et faciliter l’exérèse maximale. En cas de radiothérapie, le traitement néoadjuvant pourrait permettre d’optimiser les champs d’irradiation afin de protéger d’avantage les organes à risques. De même, on a très peu de données sur l’intérêt d’un traitement systémique concomitant à la radiothérapie, afin d’augmenter l’effet des radiations ionisantes. Rhomberg et al. [402] ont utilisé la radiothérapie par photons couplés au razoxane (un inhibiteur de topoisomerase II) qui a un fort pouvoir radiosensibilisant, en bloquant les cellules en G2/M, la phase la plus radiosensible du cycle cellulaire. Parmi les patients traités, il y avait 13 chondrosarcomes et 5 chordomes. La dose moyenne utilisée a été de 63 Gy pour les chordomes. Le razoxane a été débuté 5 jours avant la radiothérapie et administré par voie orale pendant toute la durée de l’irradiation à raison de 2 comprimés de 125 mg par jour, le premier comprimé 1 h avant la radiothérapie et le deuxième le soir. Les résultats sont encourageants avec un taux de contrôle local et une survie globale de 100 % à 5 ans pour les chordomes, et ceci avec une excellente tolérance du razoxane. 18.6. Conclusion La connaissance de la biologie des chordomes permet de mieux comprendre les différents mécanismes indispensables à la prolifération et à la survie tumorale. Les premières études publiées semblent prometteuses et pourraient être le début d’une nouvelle ère thérapeutique dans la prise en charge des chordomes avancés ou métastatiques, par les thérapies moléculaires ciblées. En première ligne, il pourrait être intéressant d’initier un traitement par imatinib en complément du traitement local par chirurgie et radiothérapie. En cas de récidive, l’intérêt des associations imatinib et cisplatine ou imatinib et inhibiteur de mTOR pourrait être discuté. Il s’agit d’utilisations hors AMM et ces indications doivent être discutées collégialement. Une expertise oncologique est indispensable pour la prescription de ces molécules onéreuses et pour la gestion
de leurs toxicités particulières. Il serait essentiel de colliger prospectivement les résultats afin d’affiner les données sur l’efficacité de ces différentes options dans le traitement des chordomes. Dans tous les cas, l’inclusion dans des essais thérapeutiques doit être favorisée autant que possible. Cependant, du fait de la rareté de la pathologie, peu de patients peuvent être inclus dans des essais et les résultats sont souvent biaisés par l’inclusion de groupes d’analyse très hétérogènes.
19. Revue des grandes séries 19.1. Chordomes intracrâniens Les symptômes révélant un chordome sont bien sûr fonction de la localisation le long du clivus, allant de signes endocriniens pour les formes juxtasellaires aux troubles de la phonation et de la déglutition pour ceux proches du foramen magnum ou du foramen jugulaire. Il faut néanmoins souligner la grande fréquence d’une diplopie par atteinte oculomotrice soit au niveau du sinus caverneux soit du clivus. L’atteinte le plus souvent observée est celle du VI avec cette particularité qu’elle est parfois transitoire, régressant spontanément après quelques semaines pour souvent réapparaître ensuite et de fac¸on définitive. Cette symptomatologie oculomotrice intermittente faisait et fait encore souvent évoquer un diagnostic de sclérose en plaque avec le risque de retarder la réalisation d’une IRM. Le délai diagnostique est des plus variables avec une tendance à la diminution du fait de la facilité d’accès actuelle à une imagerie performante. En dépit de cela, les chordomes sont très souvent découverts alors qu’ils ont déjà atteint une taille conséquente, en moyenne de 4 cm au moment du diagnostic, selon diverses séries. Dans toutes les grandes séries, il existe un nombre non négligeable de patients déjà traités préalablement dans un autre centre, le plus souvent par chirurgie parfois par radiothérapie uniquement, avec un délai variant de quelques semaines à quelques années. Ces grandes séries comportent toutes plusieurs facteurs d’hétérogénéité qui rendent l’analyse de leurs résultats difficile. Outre qu’elles contiennent des patients primaires et d’autres en récidive, elles combinent souvent des localisations différentes (crâne, rachis mobile et sacrum), des modalités thérapeutiques variées (chirurgie seule, radiothérapie seule ou combinaison de chirurgie et de diverses formes de radiothérapie). À ceci s’ajoute l’hétérogénéité de comportement biologique très variable d’un chordome à l’autre. Il est difficile, à moins de séries très importantes, de lisser ces disparités ou de faire des sous-groupes suffisamment nombreux pour tirer des conclusions fiables. À notre sens, seule la méta-analyse réalisée par Di Maio et al. [403] en 2011 peut prétendre apporter des réponses utiles. Cette méta-analyse a porté sur 10 ans, de 1999 à 2009, avec comme critères de sélection : un diagnostic histologique affirmé, des chordomes du clivus et de la base du crâne, une série consécutive publiée entre 1999 et 2010, des informations sur le taux de survie global et sans récidive à 5 ans et une indication sur les modalités thérapeutiques et notamment sur le type de radiothérapie réalisée, le cas échéant. Partant de 248 publications potentielles, ils en ont retenu 23 soit un total de 807 patients. Les séries comptent de 11 à 100 patients. L’âge moyen est de 51,2 ans ; le suivi moyen de 53,6 mois. Le taux de résection complète (absence de résidu sur l’imagerie postopératoire) varie de 0 à 73,7 %. Le taux de survie à 5 ans est globalement de 78,4 % (variant de 61,5 à 100 %) et sans récidive de 50,8 % (variant de 15 à 80 %). Sur la base d’une analyse Kaplan-Meier des données individuelles additionnées, le taux de survie global à 5 et 10 ans est de 70 et 63 % et le taux de survie sans récidive de 54 et 26 %.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Tous les patients ont été opérés et certains également radiothérapés. Onze centres ont utilisé la photonthérapie fractionnée, 9 les protons, 6 le Gammaknife et 3 les ions Carbone. En fait dans une même série, plusieurs types de radiothérapie ont pu être pratiqués. La plupart ont utilisé une radiothérapie en cas de résidu postopératoire démontré et tous les centres sauf un n’en ont pas fait en cas de résection considérée comme complète. Il ressort de cette méta-analyse que le taux de survie sans récidive à 5 ans est nettement meilleure lorsqu’une exérèse complète a pu être réalisée : 87 % contre 50 % en cas d’exérèse incomplète (p < 0,0001) ; de même la survie globale passe de 95 % à 71 % (p < 0,001). À 10 ans, la résection complète donne un taux de survie globale de 95 % contre 53 % et la survie sans récidive 47 % contre 25 %. Le risque de récidive à 5 ans est 3,83 fois supérieur après résection incomplète et le risque de mortalité à 5 ans est 5,85 fois plus élevé. L’analyse des traitements complémentaires ne montre pas de différence significative sur le taux de survie global et sans récidive à 5 ans selon le mode de radiothérapie utilisée (n = 517 patients). Dans un sous-groupe peu important (n = 58) de patients avec résection complète, la survie sans récidive à 5 ans après chirurgie avec (n = 22) ou sans (n = 36) radiothérapie complémentaire n’est pas statistiquement différente. De cette analyse, il faut retenir le facteur pronostique majeur que représente une résection complète. L’intérêt de la radiothérapie complémentaire est difficile à affirmer. Compte tenu du caractère quasiment inéluctable de la récidive, peut-être la radiothérapie ne fait-elle, en cas de résection complète, que retarder sa survenue. Il faudrait des études avec un suivi plus long pour pouvoir le dire. En cas de résection incomplète, l’hétérogénéité des groupes de patients concernant l’importance de la résection et le type de radiothérapie fait qu’aucune conclusion pertinente ne peut être tirée. Des études randomisées avec et sans radiothérapie ou avec un type de radiothérapie contre un autre sont en cours [404]. Peut-être apporteront-elles des réponses. Il faut ajouter à ces facteurs de pronostic, l’agressivité biologique très variable d’un chordome à l’autre et pour un même chordome d’un secteur à l’autre. Sur une série courte de 19 chordomes du clivus, Ito et al. [60] trouvent une relation significative du MIB-1 avec la durée sans progression de la maladie et une limite optimale de valeurs du MIB-1 à 3,44 %. À l’inverse aucun autre facteur et en particulier l’extension tumorale et le type de résection n’a d’influence sur la survenue de récidives. Cependant, d’autres auteurs soulignent l’absence de valeur pronostique des index de prolifération (Ki67 ou MIB-1). Une autre méta-analyse a été publiée en 2010 avec des critères similaires [405]. Cette fois, les auteurs ont retenu 760 patients ayant suffisamment d’informations sur 2000 cas possibles. Ils ont subdivisé ces patients selon l’âge (inférieur et supérieur à 21 ans ; n = 322 et 348), selon l’histologie (chordomes classiques : n = 429 et chondroïdes : n = 32) et selon le traitement (chirurgie seule : n = 226 ou associée à une radiothérapie : n = 128). Le taux de récidive était supérieur chez les sujets de plus de 21 ans (74 % contre 60 %), dans les cas de chordomes classiques (77 % contre 38 %) et chez ceux traités par chirurgie seule (79 % contre 60 %). Les mêmes auteurs [405] ont également publié d’autres résultats de cette méta-analyse, ne conservant cette fois que 560 patients pour analyser les taux de survie actuariels à 5 et 10 ans. Là encore ils ont subdivisé les patients selon l’âge, l’histologie et le traitement, mais pour l’âge, ils ont considéré 3 sous-groupes : < 5 ans, entre 5 et 40 ans et > 40 ans). Le taux de survie pour l’ensemble de la série est de 63 % et 16 % à 5 et 10 ans. Il n’y a pas de différence entre les patients de plus ou moins 40 ans mais en revanche le taux de survie est meilleur à 5 ans pour les patients âgés de plus de 5 ans : 66 % contre 14 % pour le groupe de moins de 5 ans. Dans cette nouvelle étude, l’histologie ne fait pas de différence sur le taux de survie à
47
5 ans : 45 % pour les chondroides contre 67 % pour les formes classiques (p = 0,06) ; il en est de même pour le traitement : 54 % pour la chirurgie seule contre 56 % pour la chirurgie associée à la radiothérapie. La contradiction avec leur article publié un an plus tôt est évidente ; elle semble s’expliquer par une méthode d’analyse plus rigoureuse dans l’article le plus récent. Enfin, une autre analyse [406] repose sur 962 chordomes répertoriés dans le SEER américain (Surveillance, Epidemiology and End Results database) entre 1973 et 2005. Les données sont assez grossières mais on peut dire que la chirurgie améliore indiscutablement le taux de survie global des patients. En revanche, le taux de récidives et la morbidité associée aux multiples réinterventions font poser la question de l’intérêt de ces chirurgies répétitives. On peut illustrer les limites des études portant sur une seule série d’un seul centre, y compris quand elles sont importantes par les dernières publiées. Ainsi celle de l’université de Whashington (Seattle, États-Unis) par Di Maio et al. [407] en 2012 comporte 95 chordomes de la base du crâne. Ce chiffre est tout à fait respectable mais la série est divisée en deux groupes : 56 patients traités entre 1988 et 1999 et 39 patients entre 2000 et 2011. Le taux de résection complète est similaire (68 et 74 %) mais les complications postopératoires plus rares dans le groupe le plus récent. Il n’y a pas de différence du taux de survie sans récidive mais une amélioration de la survie globale à 5 ans (93 % contre 64 %). La différence essentielle dans la prise en charge consiste en une radiothérapie systématique dans la période récente y compris après résection complète alors que seules les exérèses incomplètes étaient irradiées dans la première période. Seuls 22 % ont été irradiés dans la première période contre 67 % dans la seconde. Dans cette étude, le mode de radiothérapie a été très variable comprenant des protons dans 19 %, des photons dans 4 %, du Gammaknife dans 4 %, du Cyberknife dans 2 % et de l’IRMT dans 1 %. Si l’on peut penser que la radiothérapie a amélioré les résultats, on ne peut rien dire de l’avantage éventuel d’un mode de radiothérapie par rapport à un autre. Les meilleurs résultats obtenus sont sans doute aussi liés aux progrès des techniques chirurgicales mais on peut aussi noter que dans la période récente, 39 % (n = 15) des patients étaient pris en charge alors qu’ils étaient en récidive contre 66 % (n = 37) dans la première période. Cela suffit à expliquer la diminution du taux de complications notamment les lésions nerveuses (48 % contre 10 %) et vasculaires (14 % contre 3 %). Il est également intéressant de remarquer que dans cette série, le nombre de chirurgie par patient est peu différent d’une période à l’autre. Une seule intervention a été réalisée chez 50 patients, deux chez 37 patients, 3 chez 7 et 4 chez un patient. Une autre grande série de Pékin [408] comporte 106 chordomes de la base du crâne mais l’analyse ne porte que sur les 79 cas ayant eu un suivi correct. L’âge moyen est de 35,6 ans (7 à 65 ans) incorporant donc une population pédiatrique. Le suivi moyen dépasse à peine 5 ans (63,9 mois). La série s’étend sur 12 ans (1993–2005). Une radiothérapie complémentaire a été effectuée chez 40 patients entre 10 et 42 mois après la chirurgie sous la forme le plus souvent d’une radiothérapie stéréotaxique (Gammaknife ou Linac). Aucune explication n’est donnée pour expliquer le long délai entre chirurgie et radiothérapie. À 1, 3, 5 et 10 ans, le taux de survie est de 87, 79, 67 et 59 % et le taux de récidive de 19, 35, 53 et 88 %. Les éléments qu’ils retrouvent comme étant de mauvais pronostic sont une chirurgie (21 %) ou une radiothérapie antérieure (14 %), (autrement dit les formes en récidive), les formes dédifférenciées et une résection incomplète (86 %) (Tableaux 12 et 13). 19.2. Les chordomes du sacrum Les chordomes du sacrum sont supposés représenter au moins un tiers de tous les chordomes ; pour certains ce serait la localisation la plus fréquente. Dans notre expérience, ils comptent pour à peine quelques pour cent. Ce sont sans doute les orthopédistes qui les
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
48 Tableau 12 Principales séries de chordomes de la base du crâne. Principal series of chordoma in the base of the skull.
Ito et al. [52] Sen et al. [409] Takahashi et al. [410] Samii et al. [293] Schultz-E [307] Almefty et al. [177] Tzortzidis et al. [411] Krishnan et al. [338] Pamir et al. [336] Noël et al. [311] Pallini et al. [412] Debus et al. [344] Hug et al. [322]
Durée
n
Âge
Résection totale (%)
5A OS (%)
5A DS (%)
Suivi (mois)
1992–2007 1991–2005 1996–2007 1979–2002 1998–2005 1990–2006 1988–2004 1990–2002 1986–2001 1993–2002 1988–2002 1990–1997 1992–1998
15 71 32 49 96 89 74 25 26 100 22 37 33
43,1 40,7 41,4 39,1 47 38,3 ? 45 40,5 53 50,3 49 48,7
80 58,5 0 49,4 0 45 71,6 0 23,1 16 42,3 0 3
100 75 92,5 65 88,5 74,8 82,4 ? 76,9 80,5 61,5 82 78,8
47,8 64 29,3 15 70 51,4 41 32 46,2 53,8 50 50 59
82,4 66 36,3 63 31 48 96 57,6 48,5 31 62,8 27 33,2
recrutent. Pourtant on ne retrouve qu’une seule publication en provenance de centres franc¸ais sur les chordomes du sacrum dans la littérature depuis l’année 2000 [413] et aucune sur les 12 dernières années. Dans cette publication, sont rapportés seulement 11 cas observés sur 25 ans. Les différents orthopédistes interrogés ne parlent que de quelques cas dans leur expérience. Néanmoins dans la littérature, toutes les grandes séries proviennent de centres orthopédiques. Il est vrai que les séries de chordomes sacrés publiés ne sont pas considérables, même lorsqu’elles sont très étalées dans le temps : Bergh et al. [245] 39 cas du rachis dont 30 sacrés sur 30 ans ; Fuchs et al. [414] 52 cas en 21 ans ; Stacchiotti et al. [350] rapportent 108 chordomes provenant de 2 centres en 28 ans ; Hsieh et al. [415] 20 cas de chordomes du rachis mobile et du sacrum sur 5 ans ; Ruggieri et al. [416] 56 cas sur 30 ans et Clarke et al. [417] 36 cas sur 4 centres en 5 ans. Au mieux cela représente 2 cas observés par centre et par an. L’âge moyen est d’environ 55 ans dans les séries citées plus haut. Il existe en général une prédominance masculine : 34 contre 18 pour Fuchs et al. ; 32 contre 24 pour Ruggieri ; 91 pour 47 femmes pour Stacchiotti. Néanmoins, Bergh et al. comptent 22 femmes pour 17 hommes. La symptomatologie révélatrice est le plus souvent une douleur locale, parfois augmentée par la pression (position assise). Il peut exister aussi des signes de radiculopathie déficitaire du nerf sciatique ou des troubles sphinctériens. Le délai diagnostique est souvent long : 27 mois pour la série de la Mayo Clinic [414] avec des extrêmes de 1 à 180 mois ; 2 ans en moyenne pour la revue de la littérature de Sciubba et al. [418] et même 3 ans pour Moojen et al. [419]. Les tumeurs sont souvent découvertes à un stade avancé ; Stacchiotti et Fuchs donnent un diamètre moyen de 9 cm au moment du diagnostic avec des extrêmes de 6 à plus de 15 cm. La limite supérieure qui conditionne la possibilité d’avoir ou non des troubles sphinctériens en pré- et postopératoire est variable selon les séries, voir Tableau 14.
Tableau 13 Survie globale (survival) et sans la maladie (disease free) comparée selon le mode de radiothérapie. Global survial and disease free time comparing the type of radiotheray used.
Proton Beam Gammaknife Carbon Ion RT fractionnée
Nombre
5-year survival (%)
272 64 106 75
76,7 74,8 88,5 77,4
D’après Di Maio et al. [403].
± ± ± ±
4,5 7,4 5,9 8,6
5-year disease free (%) 57 41,9 72,9 58,4
± ± ± ±
4,8 7,3 6,9 9,9
La limite supérieure en S3 telle que la donne Ruggieri correspond à la limite de résection avec (> S3) ou sans (< S3) troubles sphinctériens. L’ensemble des auteurs considèrent en effet que S3 est le niveau critique. Si S3 est conservé, peu ou pas de troubles sphinctériens sont observés. Bergh et al. indiquent que si S2 est lésé, il y a 8 chances sur 10 que survienne un problème de sphincter anal pouvant aller jusqu’à imposer une colostomie. Il en a réalisé 11 sur 30 cas de chordomes sacrés dont 9 sont également secondaires à une résection rectale. Pour la vessie, si S3 est intact, il n’observe aucun trouble ou alors a minima. Si la résection remonte jusqu’à S3 inclus, 5 malades ont un problème «majeur» dont une sonde à demeure et 1 un problème «mineur». Au-dessus de S3, 18 patients ont un problème «majeur» dont 7 sondes à demeure et 1 n’a qu’un problème «mineur». Sciubba donne les mêmes limites entre S2 et S3. Une résection caudale par rapport à S3 donne parfois des problèmes d’érection. Au-dessus les problèmes d’érection s’associent très fréquemment aux problèmes sphinctériens. C’est aussi ce que mentionne Biagini et al. [421]. Pour Stener et Gunterberg [422], une continence fécale et urinaire n’est possible que si au moins une des deux racines S2 est préservée. Les chordomes sacrés n’ont aucune particularité radiologique que ce soit en Scanner et en IRM. Un certain nombre d’auteurs proposent une biopsie à l’aiguille avant la résection chirurgicale. Ils la considèrent comme utile pour la stratégie, fiable dans ses résultats et sans risque si elle est faite sur le tracé probable de l’incision chirurgicale ultérieure. Sciubba indique une fiabilité de 92 à 96 %. Bergh et al. font systématiquement une biopsie à l’aiguille fine et contre-indique formellement les biopsies larges et encore plus celles faites en transrectal. Il semble que la culture de la biopsie soit surtout le fait des centres orthopédiques y compris en France. Dans le diagnostic des tumeurs osseuses primitives ou secondaires, la biopsie aspiration à l’aiguille fine donne d’excellents résultats pour Bommer et al. [423] avec seulement 10 faux négatifs sur 450 biopsies et 0,2 % de faux positifs. La stratégie thérapeutique est chirurgicale dans toutes les séries qui toutes insistent sur l’intérêt d’une résection complète et si
Tableau 14 Limite supérieure d’extension des chordomes sacrés par série. Upper limit of the extent of the chordoma by series.
Bergh et al. [245] Ruggieri et al. [416] Clarke et al. [417] Fuchs et al. [414] Samson et al. [420] Total
L5
S1
S2
6
16
2 2 0 10
8 8 2 34
4 > S337 0 24 2 30
S3 4 9 10 8 31
S4
S5
0 < S319 12 7 5 24
0
> S3 : 111 ; ≤ S3 : 81.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
5 1 1 7
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
possible en bloc. Les deux seuls facteurs pronostiques qui ressortent de toutes les séries sont parfois le volume tumoral mais toujours les marges de résection. La résection large (wide margin), en général en bloc, est systématiquement opposée aux résections marginales et intra-lésionnelles. Ceci revient à dire que les troubles sphinctériens sont le prix à payer pour obtenir une survie sans récidive. Pour réaliser une résection large et en bloc, il est le plus souvent proposé un abord postérieur pour les chordomes ne dépassant pas S3. En revanche, un abord combiné antérieur et postérieur est utilisé pour ceux dépassant S3. Certains (Fuchs) considèrent que même audessous de S3, l’abord combiné est préférable. Sa série, observée sur 20 ans, est divisée en deux périodes de 10 ans ; dans la deuxième décade, un plus grand nombre d’abords combinés sont réalisés avec de meilleurs résultats en termes de survie et de récidive. À l’inverse, McLoughlin et al. [424] et Clarke et al. [417] décrivent une technique chirurgicale avec un abord uniquement postérieur, permettant une résection en bloc quelle que soit la limite supérieure (Fig. 54A et B). Ces résections en bloc sont impressionnantes et sont parfois complétées par une reconstruction osseuse entre les deux ailes iliaques. Néanmoins, la majorité des chirurgiens n’en réalise pas et pour autant n’observe que peu de problèmes de solidité et de stabilité. Des fractures de fatigue sont rapportées 6 fois sur 30 interventions par Bergh et al. [245] alors qu’il ne fait jamais de reconstruction malgré 22 chordomes remontant au-delà de S2, et 3 fois sur 52 interventions par Fuchs et al. [414] avec 34 chordomes atteignant S2 ou S1. L’essentiel semble être de préserver les articulations sacro-iliaques. Dans le cas contraire une reconstruction lombaire est nécessaire [425–429,579,581]. D’autres complications sont également à craindre et notamment les problèmes de cicatrice et d’infections ; 17 sur 52 pour Fuchs et al. [414] ; 37 sur 56 pour Ruggieri et al. [416], et 9 sur 36 pour Clarke et al. [417]. Ruggieri et al. reprennent 82 patients porteurs de tumeurs du sacrum dont 55 chordomes et 27 tumeurs à cellules géantes (TCG). Dans cette série, les chordomes sont réséqués en bloc alors que les TCG ont une exérèse intralésionnelle. Aucune infection postopératoire n’est observée dans les TCG ; en revanche 23 des 55 chordomes en présentent une nécessitant une reprise chirurgicale. L’infection survient le plus souvent dans le mois suivant l’intervention mais 7 n’apparaissent qu’entre 1 et 6 mois. Le germe en cause est en règle, un entérocoque, Escherichia coli ou Pseudomonas aeruginosa. Les complications vasculaires sont assez rares (2 lésions des veines iliaques pour Ruggieri). Ce sont néanmoins des interventions souvent hémorragiques pour lesquelles il a même été proposé en peropératoire, une interruption transitoire de l’aorte abdominale par ballonnet [430] ; d’autres réalisent une embolisation préopératoire [431,432]. La récidive, quel que soit le type de traitement (résection en bloc ou non), est inéluctable. Cependant, après une résection large, elles sont généralement plus tardives. Jeanrot et al. [413] observent 9 récidives sur 11 patients survenues entre 5 mois et 8 ans. Seuls deux malades ont eu une résection en bloc et ce sont ceux qui ont eu la récidive la plus tardive (8 ans). Ruggieri dans sa revue de littérature indique que le risque de récidive locale est de 5 à 17 % après chirurgie large alors qu’il varie de 71 à 81 % en cas de résection marginale ou intra-lésionnelle ; par ailleurs il mentionne un allongement du délai entre chirurgie et récidive. Bergh et al. réalisent 23 résections larges et observe 4 récidives et 6 décès par métastase, alors que 13 des 16 résections marginales ou intra-lésionnelles récidivent et 4 décèdent. En revanche, le taux de métastases est similaire (26 et 31 %). Fuchs et al. rapportent une seule récidive sur 21 résections complètes et, en revanche, 22 sur 31 résections « inadéquates ». Dans presque toutes les séries, le facteur pronostique qui ressort avec le plus d’évidence est la qualité de la résection. Seul Samson
49
et al. [420] indiquent que pour eux, seule la taille du chordome joue un rôle. La plupart des auteurs n’utilisent pas la radiothérapie lorsque la résection a été large, et la réserve pour les résections incomplètes ou les récidives. Il est généralement considéré que la radiothérapie apporte quelque chose dans ces deux indications. Bergh et al. par exemple rapportent 3 cas de chirurgie intra-lésionnelle suivie de radiothérapie avec des récidives à 2,7, 6,5 et 9,2 ans. La limite supérieure du chordome n’est jamais un facteur pronostique. En revanche, il est souvent mentionné que les malades primaires ont une meilleure évolution que les patients transférés après une première chirurgie dans un autre centre [245,433]. Le tableau suivant récapitule les principales données des plus grandes séries de la littérature (survie, récidive, résection) (Tableau 15). 19.3. Les chordomes du rachis mobile Les séries de chordomes du rachis mobile sont beaucoup moins nombreuses que celle du sacrum et encore moins de la base du crâne, même si l’on prend en compte les publications orthopédiques. Comme pour les localisations sacrées, on pourrait douter de leur réelle fréquence quel que soit le chiffre retenu qui va de 13 à 30 % selon les auteurs. La réalité semble être autour de 15 %. Il y a sans doute plusieurs explications à cela dont 2 principales. L’une tient au fait que les localisations lombaires sont souvent regroupées avec celles du sacrum, et de la même fac¸on, les localisations de la charnière craniocervicale incluant le clivus inférieur sont regroupées soit avec celles de la base du crâne soit avec celles du rachis cervical. Une série relativement importante (37 cas de 1994 à 2008) regroupe même 9 chordomes sacrococcygiens et 28 chordomes cervicaux [436]. Il est donc difficile d’isoler les chordomes lombaires et cervicaux. L’autre explication est lié à la prise en charge des lésions vertébrales par de nombreux centres neurochirurgicaux ou orthopédiques différents contrairement aux autres localisations plus souvent concentrées dans des centres «experts» : orthopédiques pour les chordomes sacrés et neurochirurgicaux pour ceux de la base du crâne. L’expérience de chaque centre est donc souvent trop limitée pour justifier une publication ne portant que sur les chordomes. Ainsi l’équipe du Queen Square à Londres [437] rapporte 97 cas de la charnière craniocervicale incluant le rachis cervical supérieur et la partie basse du clivus observés dans 2 centres sur une période de 25 ans (1982–2007) ; Carpentier et al. [438] et Carpentier et al. [313] publient une série de 36 cas observés à Lariboisière sur 11 ans dont 28 de la charnière (Clivus, C1, C2) et seulement 8 du reste du rachis cervical ; Bjornsson et al. [439] présente la série de la Mayo Clinic comprenant 40 cas observés sur 57 ans (1933–1990). Sundaresan et al. [440] colligent en 27 ans (1949–1976) 54 chordomes dont 18 du rachis mobile. Stacchiotti et al. [433] rapportent 138 chordomes sacrés et spinaux colligés dans deux centres entre 1980 et 2008 dont seulement 21 lombaires et 9 cervico-thoraciques. Toutes les séries, sauf 2, ne comportant que des chordomes du rachis mobile ne dépassent pas 15 patients : Wang et al. [441] : 14 cervicaux en 19 ans ; Barrenechea et al. [442] : 7 cervicaux en 14 ans ; Klekamp et Samii [443] : 9 cervicaux en 17 ans ; Murali et al. [444] : 8 cervicaux. Les deux séries les plus importantes sont celles de Bjornsson et al. [439] qui compte 40 cas (19 cervicaux, 14 lombaires et 7 thoraciques) mais sur 57 ans et celle de Boriani et al. [445] avec 52 cas (15 cervicaux, 7 thoraciques et 30 lombaires) là encore sur près de 50 ans (1954–2002). Leur hétérogénéité est donc évidente. Il n’y a pas de véritables séries sur le rachis lombaire encore moins sur le rachis thoracique. Pour ce dernier seulement 30 cas ont pu être répertoriés depuis 1902 par Fontes et O’Toole [446] en 2012. La plupart des publications sont des «case reports» ; 12 sont ainsi des cas isolés et 18 proviennent de séries
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 50
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 54. A. Exérèse monobloc d’un chordome du sacrum de L5 à S3. B. Schéma de la technique d’exérèse monobloc par abord postérieur. A. En bloc resection of a sacral chordoma from L5 to S3. B. Scheme of the en bloc resection technique by a posterior approach. D’après McLoughlin et al. [424] ; publié avec l’autorisation de Wolters Kluwer.
mélangeant toutes les localisations du rachis mobile soit un total de 146 chordomes. La localisation thoracique représenterait donc 12 % du rachis mobile et autour de 1 % de la totalité des chordomes. Il est encore plus difficile de faire une évaluation des chordomes lombaires et par voie de conséquence de celle des chordomes cervicaux. Bjornsson et al. présentent 40 chordomes dont 19 cervicaux (47,5 %), 14 lombaires (35 %) et 7 thoraciques (17,5 %) ; Boriani et al. sur 52 chordomes : 15 cervicaux (29 %), 30 lombaires (57,5 %) et 7 thoraciques (13,5 %) ; pour Bergh et al. : 39 chordomes dont 30 sacrés, 5 cervicaux et 1 thoracique ; pour Stacchiotti : 108 sacrés, 21 lombaires et 9 cervico-thoraciques. Wellinger [447–449] collige dans une revue de littérature (dont la publication de Leman
et al. [450] en 1965), 148 cas du rachis mobile ; parmi ces 148 cas, 60 sont cervicaux (40 %), 32 thoraciques (21,6 %) et 56 lombaires (38,4 %). Sundaresan et al. [440] publient une série personnelle de 54 cas pris en charge de 1949 à 1976, dont 36 sacrés, 11 lombaires, 2 thoraciques et seulement 5 cervicaux. Finalement c’est l’étude coopérative franc¸aise de Fuentes et Benezech [294] qui paraît la plus fiable pour apprécier la répartition des chordomes en tout cas en milieu neurochirurgical. Ils collectent 206 tumeurs primitives du rachis incluant 14 chordomes sacrés et 23 du rachis mobile dont 10 cervicaux (5 sous-occipitaux), 2 thoraciques et 11 lombaires soit respectivement 43,5, 8,7 et 47,8 %. Il paraît raisonnable de conserver l’idée que les cervicaux et
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
51
Tableau 15 Résultats des principales séries de chordomes du sacrum. Results from the principal series of chordoma of the sacrum.
Samson et al. [420] n = 21 Cheng et al. [434] n = 23 Jeanrot et al. [413] n = 11 Bergh et al. [245] n = 39 (30 S) Baratti et al. [435] n = 28 Fuchs et al. [414] n = 52 Stacchiotti et al. [433] n = 138 (108 S) Ruggieri et al. [416] n = 56
Récidive
Meta
DcD
19 %
19 %
19 %
OS 5A
OS 10A
DFS 5A
DFS 10A
Résection large
77 %
50 %
11 (52 %)
86 %
49 %
58 %
22 %
7 (30 %)
0%
2 (18 %)
81 %
27 %
63 %
64 %
18 %
18 %
40 % 6 ans 60 %
30 % 6,2 ans
25 %
84 %
64 %
36 %
88 %
49 %
60 % 8 ans 60,6 %
24 %
11 (39 %)
44 %
31 %
75 %
52 %
59 %
46 %
21 (40 %)
42 %
32 %
36 % 7,8 A 50 %
78 %
54 %
48 %
26 %
48 (35 %)
46 %
30 %
97 %
71 %
65 %
52 %
31 (60 %)
31 % 9,5 A
23 (59 %)
DcD : décédé ; OS : overall survival (à 5 ans et 10 ans : 0S 5A et 0S 10A) ; DFS : disease free survival (à 5 ans et 10 ans : DFS 5A et DFS 10A) ; Resect : résection ; S : sacrum pour les deux séries de Stacchiotti et al. [433] et Bergh et al. [245] qui comptent aussi des chordomes du rachis. DcD: death; OS5A: overall survival at 5 years; OS10A: overall survival at 10 years; DFS5A: disease free survival at 5 years; DFS10A: disease free survival at 10 years; resec: resection; S: sacrum for the 2 series of Stacchiotti et al. [433] and Bergh et al. [245] which include also chordomas of the mobile spine.
lombaires sont prédominants et à peu près équivalents avec environ 40 % chacun alors que le rachis thoracique ne compte que pour 15 %. Les chordomes du rachis lombaire sont plus souvent observés par les orthopédistes (moins de signes neurologiques) et ceux du rachis cervical par les neurochirurgiens. Il n’y a pas de vraie différence avec les autres chordomes concernant l’âge et le sexe : prédominance masculine peut-être plus marquée : 37 hommes et 15 femmes pour Boriani et al. [445] mais 14 hommes et 14 femmes sur les 28 chordomes cervicaux de Zhou ; âge moyen un peu plus jeune (de 34,4 à 59 ans). Le délai diagnostique moyen varie de 6 mois (Wang [441]) à 14 mois [439]. La symptomatologie est longtemps limitée à des douleurs locales plus souvent que radiculaires. Les signes déficitaires n’apparaissent que tardivement. Au moment du diagnostic, la douleur locale reste prépondérante (100 % pour Boriani et al., 93 % pour Wang et 86 % pour Choi) ; la douleur radiculaire s’observe dans environ 50 % des cas mais seulement dans 11 % pour Boriani et al. et les signes de myélopathie, le plus souvent débutants varient de 18 à 71 % (31 % pour Boriani et al.). Pour les localisations cervicales hautes (charnière craniocervicale), s’ajoute souvent à ces symptômes, une obstruction pharyngée avec dysphagie et dysphonie. La tumeur n’intéresse en général qu’une seule vertèbre ; c’est le cas dans 85 % des cas de l’étude radiologique de de Bruïne et Kroon [451] portant sur 14 patients (3 cervicaux, 4 thoraciques et 7 lombaires). Dans la revue des 30 cas du rachis thoraciques, seuls deux cas sont pluri-vertébraux Les chordomes lombaires sont également souvent monovertéral (hormis les formes lombosacrées). Les chordomes cervicaux paraissent plus souvent pluri-vertébraux ; dans la série de Barrenechea et al., 4 concernent 2 vertèbres, 3 s’étendent sur 3 niveaux et 1 sur quatre niveaux ; dans celle de Zhou, 11 sont monovertébraux, 9 bivertébraux, 5 trivertébraux, 2 quadrivertébraux et un s’étendait du clivus à C7. La chirurgie fait de plus en plus souvent appel à des résections en bloc, en particulier pour les formes monovertébrales. D’ailleurs beaucoup parmi les publications récentes sur les chordomes du rachis concernent les techniques en général combinées (abords antérieur et postérieur) d’exérèse monobloc. Pour le rachis cervical : [452–460]. On peut ajouter Massimiliano et Giulio [461] en 2011 qui rapportent l’exérèse en bloc d’un chordome cervicothoracique étendu sur 6 niveaux.
Pour le rachis thoracique et lombaire : [462–469]. Néanmoins, une série plus importante est celle de Boriani et al. qui mentionne 18 exérèses en bloc sur les 52 chordomes du rachis observés de 1954 à 2001 et surtout réalisées dans la période récente. Tous les auteurs qui publient sur ce sujet suggèrent que l’exérèse en bloc est sans doute préférable car elle donnerait de meilleurs résultats en termes de survie et de récidives. Pour autant, compte tenu de la rareté des séries et de leur petit nombre, la supériorité de l’exérèse monobloc sur l’exérèse par morcellement extra capsulaire (au-delà des limites tumorales) n’est pas vraiment démontrée. Quoiqu’il en soit, l’exérèse large (et peut-être monobloc) paraît supérieure à l’exérèse intra-lésionnelle incomplète ; ainsi dans la série de Boriani et al., 12 des 18 résections en bloc sont sans récidive à 8 ans en moyenne (de 48 à 155 mois) ; les 6 autres qui, soit avaient été opérés préalablement dans un autre centre, soit avaient des limites d’exérèse contaminées, ont récidivé et l’un est décédé. Les 16 exérèses intra-lésionnelles mais extracapsulaires ont toutes récidivé sauf 4. Les 14 autres, ayant eu soit une exérèse par morcellement intracapsulaire avec ou sans radiothérapie soit une radiothérapie seule, ont tous récidivé en moins de deux ans et sont décédés ensuite plus ou moins rapidement. Dans la série de Boriani et al. [445], il y a au total 32 récidives soit 66 %, 19 fois avant 2 ans et 30 fois avant 5 ans ; la récidive s’observe dans 100 % des cas entre 18 et 20 mois s’il s’agit de chirurgie palliative intra-lésionnelle ou de radiothérapie seule (I) ; dans 75 % à 30 mois pour les exérèses extracapsulaires suivies de radiothérapie (II) ; dans 50 % à 51 mois pour les exérèses en bloc mais contaminées suivies de radiothérapie (III) et dans 20 % entre 56 et 94 mois pour les exérèses larges et en bloc (IV). Les malades sont décédés suivant les mêmes modalités, 11 fois sur 14 (I), 8 fois sur 16 (II) et 1 fois sur 18 (III et IV). Par contre, il y a peu de métastases, une dans les tissus mous, 4 dans les os et 13 dans les poumons, soit un total de 18 métastases mais sans que l’on sache s’il y avait des métastases multiples chez certains malades. Elles surviennent dans un délai variant de 1 à 119 mois et toujours après des exérèses intra-lésionnelles sauf une observée après exérèse en bloc. Cloyd et al. [457] font une revue de littérature des tumeurs cervicales réséquées en bloc et retrouve 18 cas dont 12 chordomes localisés de C2 à C7 et envahissant une ou deux vertèbres. Ils indiquent un taux de survie sans maladie de 73,5 % à 5 ans pour ces patients. Trois patients sont vivants et présentent la maladie, 2 sont décédés de la maladie et les 13 autres sont vivants sans
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 52
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
signe de maladie avec un suivi allant de 12 à 149 mois (en moyenne 47 mois). Dans la série de Zhou (37 cas sacrés et cervicaux), si on extrait les 28 cervicaux, tous ont eu une exérèse intra-lésionnelle plus ou moins complète dont 15 suivis de radiothérapie ; 15 sont des patients primaires, les autres ayant déjà été opérés de une à 4 fois dans un autre centre. Le suivi moyen est de 43 mois (6–196). Une seule métastase est observée. On compte 12 décès liés à la maladie sauf un postopératoire, 4 perdus de vue, 3 vivants avec la maladie et 8 vivants sans maladie. L’analyse statistique est faite en combinant les 9 chordomes sacrés et fait ressortir en univarié que les facteurs de mauvais pronostic sont les limites d’exérèse inadéquates, une intervention précédente dans un autre centre et l’extension sur plusieurs vertèbres. En analyse multivariée, seules les limites d’exérèse et l’extension tumorale sont des facteurs de mauvais pronostic indépendants auxquels il faut ajouter l’atteinte du rachis cervical haut (16 des 28 chordomes cervicaux). Ce dernier facteur avait déjà été souligné par notre équipe [154]. Il semble donc important de faire une exérèse la plus complète possible et de préférence monobloc. En revanche, en cas de récidive l’exérèse en bloc ne paraît pas justifiée de même que lorsque l’extension tumorale est trop importante. Boriani et al. considèrent qu’il est préférable dans ces cas de chercher à faire une exérèse par morcellement mais extracapsulaire suivie de radiothérapie ; néanmoins, ils soulignent que ce type d’exérèse par morcellement n’est pas idéal au vu de 5 récidives sur 6 patients traités en récidive et de 5 récidives sur 8 exérèses en bloc mais contaminées. Pour eux, une exérèse en bloc contaminée n’est pas meilleure qu’une exérèse intra-lésionnelle mais extra capsulaire avec un risque chirurgical moindre. À titre d’indication et pour souligner la lourdeur des exérèses en bloc, dans sa revue de littérature des exérèses en bloc au niveau cervical, Cloyd et al. indiquent des durées opératoires allant de 6 à 17 heures et des pertes sanguines de 600 à 8700 mL. Pour discuter des modalités d’exérèses, la plupart des auteurs orthopédiques s’appuie sur une classification appelée WBB (Weinstein-Boriani-Biagini [549]) qui segmente la vertèbre en secteurs radiaires tout autour de la vertèbre et concentriques de la surface vers la profondeur avec un item particulier pour l’artère vertébrale ; l’item D, le plus profond, correspond à l’atteinte de la dure-mère qui doit alors être réséquée pour faire une exérèse complète. Boriani [445] est une fois de plus la seule série (n = 52) à donner ces détails : atteinte de toute la vertèbre dans 10 cas, du seul corps vertébral dans 18 cas, du corps et d’un pédicule dans 10 cas, du corps et de deux pédicules dans 12 cas et de l’arc postérieur dans 2 cas. L’extension se fait jusqu’à la dure-mère dans 39 cas. La plupart des chordomes du rachis mobile sont localisés sur le corps vertébral, les pédicules et les massifs articulaires. Néanmoins quelques cas localisés à l’arc postérieur ont été rapportés : 2 cas dans la série de Boriani et al. [445], un cas par Chadha et al. [470] en 2005 et un autre par Kamal et al. [471] en 1984. Une autre classification proposée par Enneking et al. [472] permet de comparer les chordomes, assimilés aux sarcomes de bas grade, aux autres sarcomes de bas (I) et de haut (II) grade et selon qu’ils restent intra- (A) ou extra- (B) compartimentaux ou ont une extension à distance régionale ou métastatique (III). La Fig. 55 montre ce que seraient idéalement les différents types d’exérèse ; ceci paraît éventuellement applicable sur les membres, exceptionnellement sur le rachis, jamais au niveau du crâne. Les courbes de survie qui sont données par Enneking et al. ne paraissent pas non plus adaptées aux chordomes qui sont classés dans les grades IA (13,5 %), IB (82,5 %) ou III (4 %) et devraient donc avoir un bien meilleur pronostic selon cette classification. Cette revue des séries de chordomes permet de penser que l’exérèse la plus complète possible est le but à atteindre ; elle doit être faite en bloc lorsque c’est raisonnablement possible sinon par morcellement mais extra capsulaire. L’exérèse en bloc est de moins en moins envisageable lorsque l’on prend les localisations de bas en haut,
c’est-à-dire du sacrum où elle est fréquemment possible à la base du crâne où elle ne l’est quasiment jamais ; elle est assez souvent raisonnable en lombaire (chordome limité à une partie d’une seule vertèbre) mais rarement en cervical (chordome pluri-vertébral et étendu dans et hors des vertèbres) (Tableaux 16 et 17). À titre anecdotique mais néanmoins intéressant, il faut mentionner le cas rapporté par Radl et al. [484] d’un homme de 24 ans présentant un chordome au niveau de C2 mesurant 2,5 × 2 × 4 cm révélé par des paresthésies des mains et du thorax puis des troubles sphinctériens. Deux biopsies percutanées sont réalisées mais non contributives puis une troisième à ciel ouvert par hémi-laminectomie de C1 confirmant le diagnostic de chordome. Le patient est traité par dexamethasone avant une intervention d’exérèse mais présente de la fièvre. Quand il est opéré, on trouve un abcès à E. Coli qui est drainé. Il est traité par Ciprofloxacine pendant 3 semaines permettant la guérison de l’infection. Un premier contrôle IRM à 2 semaines montre la disparition complète de la tumeur ; ceci sera confirmé par d’autres contrôles IRM, le dernier à 24 mois. Aucune image résiduelle n’est visible. Les auteurs spéculent sur l’effet immuno-thérapeutique de l’infection produisant des cytokines voire sur celui des stéroïdes administrés au total pendant 12 semaines ou même de l’antibiothérapie.
20. Analyse de la série Lariboisière De 1992 à 2012, soit sur une période de 20 ans, 135 patients porteurs de chordomes (CH) ont été pris en charge à Lariboisière. En fait, ce sont 136 CH qui ont été traités car l’un des patients a présenté une deuxième localisation cervicale en C5, 22 ans après une localisation à la charnière craniocervicale (CCC), ce qui exclut pratiquement la possibilité d’une métastase. Cette série comprend 4 localisations principales : • la base du crâne (B) incluant essentiellement la région sellaire et caverneuse ainsi que les 2/3 supérieurs du clivus avec des extensions variables latéralement vers le rocher et la fosse temporale, en avant vers le sinus sphénoïdal et le pharynx et en arrière vers le tronc cérébral et le diencéphale (n = 58) ; • la charnière craniocervicale (CCC) comprenant le 1/3 inférieur du clivus et les deux premières vertèbres cervicales, là encore avec des extensions variables vers le foramen jugulaire, le pharynx et la jonction bulbo-médullaire (n = 47) ; • le rachis mobile mais notre série ne comprend que des localisations cervicales (RC) à l’exception de deux CH lombaires regroupés avec les CH sacrococcygiens (n = 23) ; • la région lombosacrée (RLS) (n = 8). L’analyse a été faite pour chacune des localisations, mais aussi, pour certains items, en regroupant soit toutes les localisations (en excluant cependant les CH RLS car trop peu nombreux et trop particuliers), soit seulement certaines localisations, par exemple : CCC et RC ou CCC et B. Dans tous les groupes, quelle que soit la localisation, certains patients ont été pris en charge directement à Lariboisière, d’autres après un geste effectué dans un autre centre. Dans ce dernier cas, soit le geste était une simple biopsie ou une exérèse partielle réalisée moins de 6 mois avant son transfert à Lariboisière et le patient était également considéré comme primaire ; soit le geste était une exérèse quelle que soit l’importance, mais datant de plus de 6 mois (le délai moyen varie de 25 à 40 mois selon les localisations) avec une progression tumorale, et le patient était alors considéré comme secondaire. Le Tableau 18 détaille les modalités (primaire ou secondaire) de prise en charge selon les localisations.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
53
Fig. 55. A. Définition des différents types d’exérèse d’un sarcome des parties molles. B. Définition des différents types d’exérèse d’un sarcome osseux. C. Probabilité de survie du chordome et des sarcomes selon leur type et leur extension. A. Definition of the different modalities of resection of soft tissues sarcomas. B. Definition of the different modalities of resection of osseous sarcomas. C. Survival probability of chordoma and sarcomas according to type and extension. C : d’après Enneking et al. [472] ; publié avec l’autorisation de Wolters Kluwer.
Tableau 16 Principales données des chordomes du rachis mobile. Principal results on the chordoma of the rachis mobile. P
n
Âge
Res
Rec
Murali et al. [444] Bjornsson et al. [439]
1971–1981 1933–1990
8C 40 :7 T 19 C,14 L
47 56
– SubT
5/8
Klekamp et Samii [443] Carpentier et al. [313]
1971–1994 1989–2000
9C 36 (14 Rec)
45 39,6
Boriani et al. [445]
1954–2001
59
35 %
66 %
Barrenechea et al. [442]
1992–2006
52 :30 L 7 T, 15 C 7C
34,4
6/7
30 %
Choi et al. [437] Wang et al. [441]
1982–2007 1989–2006
97 C + CCJA 19 C + CCJA
54
0S5A
RFS5A
57 %
Suivi 0–46 A
63 % DcD 42 % DcD À 5 ans 100 % 58 %
Meta
80 % 1aire 50 % 2aire 50 %
55 % 85,7 %
5%
70 % 1aire 0 % 2aire 23 % à 8A
0
1–11 A
18
3–155 M
70 % à 2A
30 %
50 %
0
23 M 7–169 50,4 M 58,6 M 8–120
P : période d’observation ; n : nombre de cas ; Res : résection complète ; Rec : récidive ; OS5A : survie à 5 ans ; RFS5A : sans évolution à 5 ans ; Meta : métastase ; 1aire : malade primaire ; 2aire : malade en récidive ; C : cervical ; T : thoracique ; L : lombaire ; CCJA : charnière craniocervicale ; SubT : exérèse subtotale. P: study period; n: number of cases; Rec: recurrence; OS5A: overall survival at 5 years; RFS 5A: recurrence free survival at 5 years; Meta: metastasis; 1aire: primary; 2aire: secondary; C: cervical; T: thoracic; L: lumbar; CCJA: cranio-cervical junction; SubT: subtotal.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
54 Tableau 17 Principales données des chordomes thoraciques. Principal results on thoracic chordoma.
Buraczewski et Rudowski [473] Levowitz et al. [474] Sundaresan et al. [440] Schwarz et al. [475] Cotler et al. [476] De Bruine et Kroon [451] Ahrendt et Wesselhoeft [477] Bjornsson et al. [439] Taki et al. [478] Murphy et al. [479] Bergh et al. [245] Topsakal et al. [480] Smolders et al. [192] Boriani et al. [445] Delgado et al. [481] Wang et al. [482] Cho et al. [483] Fontes et O’Toole [446]
Période
n total rachis
n thoracique
Âge/sexe
Niveau
1957 1966 1979 1985 1983 1988 1992 1993 1996 1998 2000 2002 2003 2006 2008 2008 2009 2012
1 1 18 1 14 1 2 40 1 1 12 1 10 52 1 1 1 1
1 1 2 1 4 1 2 6 1 1 1 1 1 7 1 1 1 1
14/F 39/F
T4 T2
15/F
T3
68/F 37/2 M 6 M/1 M 25/F 59/M 40/M 44/F
T7 T4
Le début de la maladie a été considéré au moment du diagnostic (qu’il soit fait à Lariboisière ou non). Il a été envisagé de le considérer au début des symptômes mais, si pour la plupart des patients, le délai diagnostique ne dépasse pas quelques mois, pour un nombre non négligeable d’entre eux, il est de plusieurs années (délai le plus long : 213 mois soit près de 18 ans pour les CH B, 47 mois pour les CH CCC et 84 mois pour les CH RC). Ces délais ont été vérifiés et semblent authentiques ; ils correspondent à des patients négligents ou ayant des difficultés de prise en charge du fait de leur origine géographique, mais aussi à des patients présentant des symptômes peu invalidants ou transitoires (diplopie). La qualité de l’exérèse a été appréciée lors de la première prise en charge (que ce soit à Lariboisière ou dans un autre centre). Cette première exérèse a pu être réalisée en un ou plusieurs temps chirurgicaux et même en un ou plusieurs centres. Pour uniformiser et surtout simplifier l’analyse qui autrement conduirait à de multiples sous-groupes de petite taille, la radiothérapie a été considérée de fac¸on univoque quel que soit le moment où elle a été effectuée lors de la prise en charge ; le plus souvent après la première exérèse et en général après une exérèse aussi complète que possible. Elle a le plus souvent été réalisée à l’aide de protons isolément ou en combinaison avec des photons (n = 76), mais parfois sous la forme d’une radiothérapie conventionnelle (n = 17) ou d’une radiochirurgie (Cyberknife ou Gammaknife) (n = 7). 20.1. Chordomes de la base du crane On compte 58 patients (25 femmes, 33 hommes, sexe ratio M/F = 1,32), âgés de 46,4 ± 17 ans (extrêmes de 8 à 74 ans). Le symptôme initial le plus fréquent est une diplopie (n = 43) par atteinte d’un nerf oculomoteur (l’abducens le plus souvent).
46/M 30/M 9/M 89/M
T2 T8 T1 + T12 T4 T7
T4 T3 T10
Cette diplopie est fréquemment transitoire et ne devient définitive qu’après un ou plusieurs épisodes. Le deuxième symptôme sont les céphalées (n = 19), puis viennent les troubles visuels (acuité ou champ visuel) n = 15, les déficits d’autres nerfs crâniens : V = 6, VII = 2, VIII = 6, Nerfs mixtes = 6 ; une obstruction nasale est rapportée 5 fois, un trouble endocrinien 3 fois et un déficit moteur 4 fois. Lorsque le patient est pris en charge à Lariboisière, que ce soit en première ou deuxième intention, la diplopie est quasi constante (n = 54), avec 35 atteintes du VI dont 2 bilatérales, 14 du III et 5 du IV ; les céphalées sont notables 23 fois. On retrouve les autres atteintes avec la même fréquence avec néanmoins un peu plus d’obstruction nasale (n = 8) et de troubles endocriniens n = 10 sans doute du fait des patients en récidive. Le délai diagnostique moyen est de 11,2 ± 35 mois, avec des extrêmes allant de 0 à 213 mois (17,7 ans). Le CH était purement extradural chez 21 patients et s’étendait en intradural chez 37 autres (64 %) L’exérèse (lors de la première prise en charge) a été partielle dans 24 % des cas, subtotale dans 47 % et totale dans 29 %. Les résidus tumoraux lors d’exérèse incomplète étaient le plus souvent situés au niveau du sinus caverneux (n = 30) et devant le tronc cérébral (n = 6). L’exérèse a été réalisée 39 fois en un temps et un seul abord chirurgical, 3 fois avec deux temps, 2 fois avec 3 temps et une fois 4 temps ; l’endoscopie endonasale a été utilisée 26 fois ; enfin deux fixations craniocervicales ont été nécessaires. À noter que 18 patients ont subi un test d’occlusion de la carotide interne préopératoire dont 13 étaient bien tolérés et conduisant à 5 occlusions préventives. La mortalité opératoire est nulle ; la morbidité postopératoire inclut 2 complications ischémiques liées à des perforantes sur des
Tableau 18 Les modalités de prise en charge. The types of treatment. Prise en charge
Primaire Direct Complément Sous-total Secondaire Total
Total
52 35 87 (64 %) 49 (36 %) 136
Répartition selon la localisation Base
CCC
RC
RLS
24 20 44 (77 %) 14 (23 %) 58
16 10 26 (55 %) 21 (45 %) 47
8 2 10 (43 %) 13 (57 %) 23
4 3 7 (87,5 %) 1 (12,5 %) 8
CCC : charnière craniocervicale ; RC : localisations cervicales ; RLS : région lombosacrée. CCC: cranio-cervical junction; RC: cervical spine; RLS: lumbo-sacral spine.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
patients en récidive et 10 méningites. Il a fallu mettre en place 6 dérivations ventriculaires externes et 9 internes. Deux patients ont nécessité une trachéotomie transitoire. Une réintervention a été nécessaire chez 4 patients pour un hématome extradural (1 cas), une fuite de LCR (2 cas) et un épistaxis (1 cas) et il faut ajouter une embolisation d’hémostase. Douze patients ont séjourné en réanimation de 1 à 20 jours. La durée d’hospitalisation a été en moyenne de 26 ± 25 jours. Une radiothérapie complémentaire a été réalisée dans 79 % des cas ; 12 patients n’ont eu aucune radiothérapie. Parmi les patients irradiés, 93 % ont rec¸u des protons, 5 % une radiothérapie conventionnelle et 2 % une radiochirurgie. Au contrôle réalisé 3 à 6 mois après la chirurgie, la symptomatologie s’est le plus souvent nettement améliorée puisqu’il ne reste plus que 11 paralysies oculomotrices, 6 troubles visuels, 5 déficits endocriniens, 2 atteintes du V, une seule atteinte des nerfs mixtes et une atteinte du facial. Treize patients sont asymptomatiques. Le suivi à long terme est de 78 ± 79 mois avec 22 décès soit 39 %, une seule métastase à 5 ans et 21 récidives (37 %). Le délai moyen d’apparition d’une récidive est de 79 ± 88 mois. Le délai moyen du décès est de 94 ± 85 mois et celui de la survie sans progression de 64 ±71 mois. Une récidive est observée dans 66,5 % des cas après exérèse partielle, dans 30,7 % des cas après exérèse subtotale et dans 25 % des cas après exérèse totale. Le décès est observé dans 50 % des cas après exérèse partielle, dans 42 % des cas après exérèse subtotale et dans 19 % des cas après exérèse totale. Sur 40 patients analysables, 27 ont un résidu stable ou pas de résidu en IRM lors du dernier contrôle alors que 13 sont en progression tumorale. 20.2. Chordomes de la charnière craniocervicale Ce groupe comprend 47 patients (18 femmes, 29 hommes, sex-ratio M/F = 1,61) âgés de 36 ± 16 ans avec des extrêmes de 11 à 70 ans. Les symptômes initiaux les plus fréquents sont les douleurs locales (n = 42) et l’atteinte des nerfs mixtes (n = 17) et on note une obstruction nasale 9 fois et des troubles moteurs 2 fois. À l’arrivée à Lariboisière, sont observées 28 atteintes du XII (7 bilatérales), 10 du XI (2 bilatérales), 14 du X (1 bilatéral), 11 du IX (1 bilatéral) ; les autres atteintes nerveuses sont plus rares : diplopie : 5 cas ; V : 1 cas ; VII : 2 cas ; VIII : 2 cas. Une obstruction nasale est rapportée 16 fois et des cervicalgies 29 fois. À l’examen on retrouve 5 déficits moteurs et 9 troubles sensitifs divers. Aucun trouble sphinctérien n’est observé. Le délai diagnostique est de 9,7 ± 13 mois avec des extrêmes allant de 0 à 47 mois. La moitié des CH de la CCC sont extraduraux (n = 24) et 23 ont une extension intradurale. L’exérèse a été partielle dans 29 % des cas, subtotale dans 48 % et totale dans 23 %. Chez 35 patients un seul abord a été effectué alors que 2 ont été nécessaires chez 6 patients, 3 chez 4 patients et 5 ou 6 une fois chacun. L’endoscopie endonasale a été utilisée 5 fois Dix-huit tests de clampage de l’artère vertébrale, tous bien tolérés, ont été effectués mais aucun clampage préopératoire. Néanmoins, l’artère vertébrale a été sacrifiée 6 fois en cours d’intervention. Une fixation a été réalisée dans 60 % des cas : craniocervicale chez 25 patients, antérieure chez 3 autres. Ces fixations ont été effectuées 3 fois avant l’exérèse, 12 fois après et 13 fois simultanément. Il n’y a pas de mortalité opératoire. La morbidité comprend 8 problèmes de cicatrice, 5 méningites, 5 troubles de déglutition, 2 paralysies du XII, 4 Claude Bernard-Horner, 5 déficits moteurs et une plaie de l’œsophage. Douze trachéotomies et 7 gastrostomies ont été nécessaires. Enfin, il faut signaler une embolie pulmonaire. Une réintervention a du être réalisée chez 6 patients pour différents problèmes : une rupture de l’artère vertébrale, un saignement
55
pharyngé, deux infections locales, une collection liquidienne et une fuite de LCR. Une dérivation ventriculaire externe a été mise en place 14 fois en per- ou postopératoire et deux dérivations internes. Dix-sept patients ont du faire un séjour en réanimation, 9 de moins de 3 jours, 3 de 3 à 15 jours et 3 de plus de 15 jours. La durée d’hospitalisation moyenne est de 35,1 ± 37 jours avec des extrêmes allant de 5 à 180 jours. Une radiothérapie a été réalisée chez 38 patients (85,7 %) dont 26 par protons (68,4 %), 2 par radiochirurgie et 8 par radiothérapie standard. Le contrôle effectué entre 3 à 6 mois plus tard retrouve une atteinte persistante des nerfs mixtes IX et X chez 15 patients, 6 paralysies du XII, une du XI, 2 paralysies faciales et une atteinte oculomotrice. Cinq patients se plaignent de douleurs locales. Des métastases sont observées chez 8 patients : cutanées (n = 2), pulmonaires (n = 2), ganglionnaires (n = 5), musculaire (n = 1), tentorielle (n = 1) et rachidienne (n = 1). Une intervention pour exérèse de ces métastases a été réalisée chez 7 patients. Deux essaimages ont eu lieu : un sur la queue de cheval et un dans les fosses nasales Le suivi moyen est de 74 ± 57 mois avec 26 décès (59 %) et 26 récidives (59 %). Le délai moyen de survenue des métastases est de 58,5 ± 73 mois, celui des récidives est de 37 ± 34 mois et celui du décès de 62,5 ± 38,5 mois. La survie sans progression est de 46,5 ± 48 mois. Une exérèse partielle est suivie d’une récidive chez 85,7 % des patients et du décès chez 69 %. Une exérèse subtotale conduit à 57 % de récidives et 62 % de décès, une exérèse totale s’associe à 30 % de récidives et 30 % de décès. Un résidu stable ou une absence de résidu sur l’IRM du dernier contrôle est observé chez 54,5 % des patients alors qu’une progression tumorale existe dans 45,5 % des cas.
20.3. Chordomes du rachis cervical On compte 23 patients (10 femmes, 13 hommes, sexe ratio M/F = 1,3), âgés de 43,8 ± 14,8 ans (extrêmes : 13 et 67 ans). Le symptôme initial le plus fréquent est une douleur locale souvent associée à une raideur cervicale (n = 18). Des signes de myélopathie sont présents 7 fois, des signes radiculaires 7 fois également, des paresthésies 3 fois, des troubles de la déglutition ou de la voix 3 fois ; enfin une masse cervicale est notée une fois. Lors de la présentation à Lariboisière (de première ou seconde intention), le malade présente 22 fois des douleurs locales, 10 fois des signes de myélopathie, 8 fois des signes radiculaires, 11 fois des manifestations sensitives variables, des troubles sphinctériens une fois, une dysphonie ou une dysphagie 2 fois et enfin une masse cervicale une fois. Le délai diagnostique est de 10,1 ± 18,5 mois avec des extrêmes de 0 à 84 mois (7 ans). Le CH avait 5 fois sur 23 une extension intradurale (22 %). Il n’intéresse qu’une vertèbre dans 3 cas, deux vertèbres dans 7 cas, trois vertèbres dans 8 cas, quatre vertèbres dans 3 cas, cinq vertèbres dans 1 cas et six vertèbres dans un autre cas. Environ la moitié des CH C sont situés sous C4 (n = 12) et l’autre moitié est localisée entre C4 et C2. L’exérèse lors de la première prise en charge a été partielle dans 10 % des cas, subtotale dans 54 % et totale dans 36 %. La plupart des exérèses réalisées à Lariboisière l’ont été en un temps (21/23). Seules deux exérèses ont été réalisées en 2 temps. Parmi les exérèses effectuées en un temps, trois ont utilisé 2 voies d’abord et une 3 voies d’abord. Parmi 10 artériographies, 4 tests de clampage de l’artère vertébrale ont été effectués sans occlusion, tous bien tolérés. Néanmoins, 5 artères vertébrales ont été sacrifiées en peropératoire.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 56
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Une racine nerveuse a du être sacrifiée 4 fois (1 racine C3, une racine C4 et 2 racines C5), auxquelles il faut ajouter un nerf récurrent. Dix fixations ont été réalisées, 6 antérieures, 4 postérieures dont une craniocervicale, 8 fois dans le même temps opératoire et 2 fois, 3 et 15 jours après l’exérèse. La mortalité opératoire est nulle. Chez 6 patients, on a observé des complications : 1 infection, 1 méningocèle, 1 méningite, 1 problème de vis, 1 Claude Bernard-Horner et 2 dysphonies. Une seule dérivation externe, internalisée ensuite a été posée. Deux trachéotomies ont été nécessaires, retirées 1 mois et 1,5 mois plus tard. Trois patients (les deux patients ayant eu une trachéotomie et un patient présentant une myasthénie) ont séjourné en réanimation. La durée d’hospitalisation a été en moyenne de 18,4 jours (6 à 104 jours). Une radiothérapie complémentaire a été réalisée dans 15 cas (79 %), 9 fois (60 %) par protonthérapie, 5 fois par radiothérapie conventionnelle et une fois par Cyberknife. Lors du contrôle à 3–6 mois, on retrouve essentiellement 5 cas de douleurs locales, 2 dysphonies, une myélopathie et une douleur de désafférentation. Le suivi à long terme est de 80 ± 61 mois avec 10 décès (45 %), 6 métastases (27 %) et 14 récidives (64 %). Les métastases sont ganglionnaires (4 fois), pulmonaire (1 fois) et sous-cutanée (1 fois). Le délai moyen d’apparition des récidives est de 53 ± 43 mois ; celui d’apparition d’une métastase de 31 ± 21 mois et d’un décès de 84 ± 53 mois. La durée moyenne de survie sans progression tumorale est de 49,5 ± 46 mois. Après exérèse partielle on observe une récidive dans 50 % des cas et un décès dans 100 %. Après exérèse subtotale, la récidive est présente dans 66,5 % des cas et le décès dans 58 %. L’exérèse totale s’accompagne d’un taux de récidive de 50 % et de décès de 12,5 %. Sur 18 patients analysables, 14 ont un résidu stable ou pas de résidu en IRM lors du dernier contrôle et 4 sont en progression tumorale. 20.4. Chordomes lombosacrés La série ne comporte que 8 CH lombosacrés (2 femmes, 6 hommes) d’âge moyen : 57,9 ans (extrêmes 40–77 ans). Le symptôme initial est 5 fois une douleur locale (parfois une coccygodynie), une fois une radiculalgie, une fois une masse palpable et une fois un déficit radiculaire. À l’arrivée à Lariboisière, on note 1 déficit moteur, 7 troubles sensitifs, 4 radiculalgies, 3 troubles sphinctériens. Il y a deux localisations lombaires (en L2 pour l’une et L3 pour l’autre), et 6 localisations sacrées ; 4 s’étendent du coccyx à S1 (1 cas), à S2 (2 cas), à S3 (1 cas) ; les deux autres vont de S3 à S5 et de S4 à S5 ; il n’y a aucune extension intradurale. Le CH envahit toujours l’arc antérieur du rachis et s’étend sur l’arc postérieur 6 fois. Il y a 6 extensions extra-rachidiennes dont 4 antérieures vers le pelvis (rectum). Le délai diagnostique est de 13,2 ± 16 mois (extrêmes 1 à 45 mois). Toutes les exérèses sont totales (sauf une partielle), 7 réalisées en un temps et une en 2 temps : 6 par abord postérieur, 1 par abord antérieur (L2) et 1 par double abord antérieur et postérieur (L3). Il y a eu deux exérèses monobloc (en L3 et S3-coccyx). Les 2 CH lombaires ont également eu une fixation. Aucune complication opératoire n’a été observée mais deux patients ont nécessité une reprise chirurgicale, une fois pour déplacement de la greffe osseuse et une fois pour un hématome. La durée d’hospitalisation est de 13 jours en moyenne (de 6 à 21 jours). Les 8 patients ont été irradiés, 3 par radiothérapie standard, 3 par protonthérapie, et 2 par Cyberknife. Le contrôle neurologique à distance montre la persistance d’un déficit moteur, de 2 troubles sphinctériens et de 3 radiculalgies.
Le suivi moyen est de 54,5 ± 44 mois avec des extrêmes de 8 à 115 mois. Il n’y a ni décès ni métastase dans le suivi de ces CH ; une seule récidive a été observée à 96 mois chez le seul patient n’ayant pas eu une exérèse complète. La survie sans progression est de 52 ± 40,5 mois (extrêmes : 8 et 109 mois). Sur 7 patients contrôlés à distance, 6 n’ont aucun résidu visible en IRM et 1 a un résidu stable. 20.5. Analyse comparative des groupes 20.5.1. Délai diagnostique moyen Le délai diagnostique moyen des différents groupes est très comparable, autour de 10 mois avec cependant des écarts considérables d’un patient à l’autre. Certains patients ont été diagnostiqués très rapidement, voire en urgence le jour même de l’installation du premier symptôme ; d’autres ne se sont présentés que de nombreuses années après, et ce quel que soit le groupe considéré, le maximum étant plus de 17 ans. Ceci suppose qu’au moins certains CH ont une évolution très lente, ne provoquant une aggravation clinique que très progressivement. 20.5.2. Délai de suivi moyen Le délai de suivi moyen (du diagnostic au dernier contrôle ou au décès) est également très peu différent d’un groupe à l’autre, de 74 à 80 mois, là encore avec des extrêmes très éloignés, mais confirmant l’homogénéité de la série et la grande variation d’évolutivité d’un CH à l’autre (Tableau 19). 20.5.3. Délais sans progression, de décès, de métastase et de récidive L’analyse des délais sans progression, de décès, de métastase et de récidive fait ressortir un meilleur pronostic des CH de la Base avec des délais plus longs pour tous les items. De même, le nombre de décès, de métastase ou de récidive est nettement moindre pour les CH de la Base du crâne que pour les CH de la CCC ou du RC. Inversement, ce sont les données des CH de la CCC qui sont les plus mauvaises. En fait sur la base de ces données, les CH de la CCC se comparent plutôt aux CH du RC qu’à ceux de la Base. Lorsque l’on regroupe toutes les localisations, le délai moyen sans progression est de 4 ans et demi, le délai de décès de 6 ans et demi, celui des métastases de 4 ans et celui des récidives de 4 ans et demi. Environ un malade sur deux récidive et/ou décède pendant les 6 ans et demi du suivi moyen et 15 % présentent une métastase. L’analyse de la qualité d’exérèse indique clairement qu’une exérèse complète s’associe à un bien meilleur pronostic qu’une exérèse incomplète, même subtotale (Tableau 20). Sur l’ensemble de la série, une exérèse totale s’associe à 20,5 % de décès et 28 % de récidive contre 52,5 et 47,5 % après exérèse subtotale et 63 et 75 % après exérèse partielle. Cette différence est encore plus nette si on ne considère que les CH de la Base. La répartition dans les différents groupes selon l’exérèse (partielle, subtotale et totale) est assez proche avec environ 25 % d’exérèse partielle ou totale et 50 % d’exérèse subtotale. Seuls les CH du RC ont une proportion plus faible d’exérèse partielle (10 %) et plus forte d’exérèse totale (36 %). On peut se poser la question de l’intérêt d’une radiothérapie secondaire et en particulier de la protonthérapie considérée comme le traitement de choix, avec, comme corollaire, la question de savoir si une exérèse subtotale peut être compensée par rapport à une exérèse totale en y adjoignant une protonthérapie. En fait, il semble bien que la radiothérapie par protons améliore la survie des patients puisqu’une exérèse totale suivie d’une protonthérapie est associée à une mortalité de seulement 7 % contre 100 % avec une radiothérapie standard et 66,5 % sans radiothérapie. De même, le pourcentage de récidive après exérèse totale et protons est de 26 % contre 100 % après radiothérapie standard et 66,5 % sans radiothérapie
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
57
Tableau 19 Principales données évolutives des différents groupes de chordomes. Principal evoluative results from the different groups of chordoma. Delai (mois)
Répartition selon la localisation RC n = 23
CCC n = 47
Base n = 58
CCC + RC n = 70
CCC + base n = 105
CCC + base + RC n = 128
Diagnostic Suivi
10,1 80
9,7 74
11,2 78
9,8 76
10,6 76,5
10,5 77
Sans progression Décès Métastase Récidive
49,5
46,5
64
48
56
54,5
84 31 53
62,5 58,5 37
94 79
68 47,5 43
78 58,5 56
78,5 48 55,5
Nombre décès Nombre métastase Nombre récidive
10 (45 %) 6 (27 %)
26 (59 %) 10 (23 %)
22 (39 %) 1 (2 %)
36 (54,5 %) 16 (24 %)
48 (47,5 %) 11 (10,8 %)
58 (47 %) 17 (14 %)
14 (64 %)
26 (59 %)
21 (37 %)
40 (60,5 %)
47 (46,5 %)
61 (49,5 %)
CCC : charnière craniocervicale ; RC : localisations cervicales. Délai diagnostique : date du premier symptôme–date du diagnostic ; délai de suivi : date du diagnostic–date du dernier contrôle ou du décès ; délai sans progression : date du diagnostic–date de récidive ou métastase ou dernier contrôle ; délai de décès : date du diagnostic–date du décès ; délai de métastase : date du diagnostic–date de métastase ; délai de récidive : date du diagnostic–date de récidive. CCC: cranio-cervical junction; RC: cervical spine; délai diagnostic: time between first symptom and diagnosis; délai de survie: time between diagnosis and last follow-up or death; délai sans progression: time between diagnosis and recurrence or metastasis or last control; délai de décès: time between diagnosis and death; délai de métastase: time between diagnosis and metastasis; délai de récidive: time between diagnosis and recurrence.
Tableau 20 Qualité d’exérèse. Excision quality. Type d’exérèse
Répartition selon la localisation RC (%)
CCC (%)
Base (%)
CCC + RC (%)
CCC + base (%)
CCC + base + RC (%)
DcD/partielle DcD/SubT DcD/totale
100 58 12,5
69 62 30
50 42 19
73 60,5 22
60 51 23
63 52,5 20,5
REC/partielle REC/SubT REC/totale
50 66,5 50
85,7 57 30
66,5 30,7 25
29 48 23
24 47 29
n partielle n SubT n totale
10 54 36
75 47,5 28 22,7 50 27
22,5 49 28
CCC : charnière craniocervicale ; RC : localisations cervicales ; pourcentage de patients décédés après exérèse partielle : DcD/partielle, après exérèse subtotale : DcD/SubT et après exérèse totale : DcD/Totale ; pourcentage de récidives après exérèse partielle : REC/partielle, après exérèse subtotale : REC/SubT, et après exérèse totale : REC/Totale ; n partielle : nombre d’exérèse partielle ; n SubT : nombre d’exérèse subtotale ; n totale : nombre d’exérèse totale. CCC: cranio-cervical junction; RC: cervical spine; DCD/partielle: percentage of death after partial resection; DCD/SubT: percentage of death after partial resection; DCD/totale: percentage of death after total resection; REC/partielle: percentage of death after partial resection; REC/SubT: percentage of death after subtotal resection; REC/totale: percentage of death after total resection; n partielle: number of partial resection; n SubT: number of subtotal resection; n totale: number of total resection.
Cependant, le faible nombre de patients rend l’utilisation de ces résultats très fragile : 27 pour la protonthérapie, 3 pour la radiothérapie standard et 3 pour l’absence de radiothérapie. Après exérèse subtotale, les résultats sont très voisins quelle que soit la modalité de radiothérapie utilisée. La mortalité est de 50 % avec protons, 37 % après radiothérapie standard et 54 % sans radiothérapie ; la récidive s’observe dans 50 % après protons, 37 % après radiothérapie standard et 54 % sans radiothérapie. Là encore le nombre de patients : 38 avec protons, 8 avec radiothérapie standard et 11 sans radiothérapie, rend les résultats discutables (Tableau 21). On peut inverser l’analyse en comparant l’ensemble des patients ayant eu des protons : le taux de décès est de 7 % en cas d’exérèse totale contre 50 % en cas d’exérèse subtotale et celui de récidive de 26 % contre 50 %. En reprenant tous les patients n’ayant pas eu de protons, le taux de décès est de 83 % (5/6 patients) après exérèse totale et 47 % (9/19 patients) après exérèse subtotale ; les taux de récidive sont exactement les mêmes : 83 % (5/6 patients) et 47 % (9/19 patients). La réserve sur le petit nombre de patients dans chacun des groupes n’ayant pas eu de protons s’applique ici encore Finalement, les protons semblent bien améliorer les résultats en termes de mortalité et de récidive chez les patients ayant eu une
exérèse complète. Par contre, lorsque l’exérèse est subtotale, les résultats sont identiques (autour de 50 % de mortalité et de récidives) quel que soit le type de radiothérapie proposée voire en l’absence de radiothérapie. Faut-il conclure qu’il existe un volume résiduel minimal très faible au-delà duquel les protons ne sont pas efficaces ?
Tableau 21 Résultats selon la qualité de l’exérèse (partielle, subtotale ou totale) et le type de radiothérapie réalisée (protonthérapie, radiothérapie standard et sans radiothérapie). Results on excision quality (partial, subtotal, or total) and the type of radiotherapy used. Exérèse+
Nombre
RAS
Récidive
Décès
Totale + proton SubTotale + proton Totale + standard SubTotale + standard Totale ss RxTT SubTotale ss RxTT
27 38 3 8 3 11
70 % 37 % 0/3 37 % 1/3 36 %
26 % 50 % 3/3 37 % 2/3 54 %
7% 50 % 3/3 37 % 2/3 54 %
Ss RxTT : sans radiothérapie ; RAS : rien à signaler. ssRxTT: no radiotherapy; RAS: free of progression.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
58
A
B
C
D
E
F
Fig. 56. Courbe A : courbe actuarielle de survie globale et sans progression pour l’ensemble de la série. Courbe B : courbe actuarielle de survie globale et sans progression des CH de la base et du groupe CH du rachis cervical et charnière craniocervicale. Courbe C : courbe actuarielle de survie globale et sans progression pour l’ensemble de la série, selon que les patients sont plus ou moins âgés que la médiane (44 ans). Courbe D : courbes actuarielles pour les CH de la base du crâne de survie globale (ligne supérieure) et sans progression (ligne inférieure) en fonction (de gauche à droite) de la résection complète ou non, de la prise en charge primaire ou secondaire, d’une protonthérapie ou non et de l’âge. Courbe E : courbes actuarielles pour les CH du rachis cervical et de la charnière craniocervicale regroupés, de survie globale (ligne supérieure) et de survie sans progression (ligne inférieure) en fonction (de gauche à droite) de la résection totale ou non, de la prise en charge primaire ou secondaire, d’une protonthérapie ou non et de l’âge. Courbe F : courbe actuarielle de survie globale et sans progression pour l’ensemble de la série selon que la prise en charge a été primaire ou secondaire. Courbe G : courbe actuarielle de survie globale et sans progression pour l’ensemble de la série selon qu’une protonthérapie a été réalisée ou non. Courbe H : courbe actuarielle de survie globale et sans progression pour l’ensemble de la série en fonction de l’exérèse (totale ou non totale). Courbe I : courbe actuarielle de survie globale et sans progression sur l’ensemble de la série selon qu’a été réalisée soit une résection incomplète seule, soit une résection incomplète associée à une protonthérapie, soit une résection totale avec protons.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
59
Fig. 56. (Suite )
Ces données basées sur des moyennes de fréquences et de délai d’apparition, et comportant souvent des écarts-types importants, demandent à être confirmées par des courbes actuarielles. 20.6. Analyse des courbes actuarielles 20.6.1. Taux de survie globale et sans progression Si l’on considère l’ensemble de la série, la courbe de survie globale (courbe A) comporte deux parties. La première durant les 4 premières années montre une chute rapide du nombre de survivants (40 %) ; la deuxième qui s’étend de 4 ans à plus de 20 ans est horizontale. Ceci confirme l’existence de CH présentant une évolutivité très différente ; certains sont très agressifs entraînant le décès quelle que soit la qualité de la prise en charge et les autres beaucoup moins. À l’appui de cette affirmation, on peut
mentionner l’exemple, dans notre série, d’un patient opéré et non radiothérapé, récidivant 11 ans plus tard et d’un autre opéré et radiothérapé récidivant après 21 ans. C’est également ce que l’on observe sur la courbe actuarielle de survie sans progression de la maladie (Fig. 56, courbe A) avec, là encore, une cassure, certes moins marquée, à 7 ans alors qu’il reste 30 % des patients qui n’ont pas récidivé. La deuxième partie de la courbe présente une pente beaucoup plus faible mais ne s’horizontalise pas complètement. Si on sépare les CH de la base du groupe des CH du Rachis cervical et de la charnière craniocervicale, la courbe de survie globale (Fig. 56, courbe B) n’est pas significativement différente (p : 0,45). En revanche, la survie sans progression (courbe B) l’est nettement (p = 0,0053). Ceci semble bien confirmer le meilleur pronostic des CH de la base du crâne.
A. Actuarial curve of global survival and without progression for all the series. B. Actuarial curve of global survival and without progression for the groups basal CH and cervical rachis CH, and craniocervical hinge. C. Actuarial curve of global survival and without progression for all the series, depending on whether the patient is older or younger that the median age (44). D. Actuarial curves of global survival for the group CH of the base of the skull (upper line) and without progression (lower line) as a function (from left to right) of the resection, complete or not, primary or secondary support with proton therapy or not, and age. E. Actuarial curves of global survival for groups with CH of the cervical rachis, and of the craniocervical hinge (upper line) and survival without progression (lower line) as a function (from left to right) of resection, total or not, primary or secondary support with proton therapy or not, and age. F. Actuarial curve of global survival and without progression for all of the series according to whether the treatment has been primary or secondary. G. Actuarial curve of global survival and without progression for all the series according to whether or not proton therapy was used or not. H. Actuarial curve of global survival and without progression for all the series as a function of excision (total or non-total). I. Actuarial curve of global survival and without progression for all the series according to whether an incomplete resection was performed, or an incomplete section associated with proton therapy, or a total resection with protons.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 60
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Différents paramètres ont ensuite été analysés en courbe actuarielle : l’âge supérieur ou inférieur à la médiane, le fait que la prise en charge ait été primaire ou secondaire, le type de résection (complète ou non) et le traitement par protonthérapie ou non ; cela a été fait dans trois cohortes : • l’ensemble de la série ; • les CH de la base du crâne ; • le groupe des CH du rachis cervical et de la charnière craniocervicale regroupés. 20.6.2. Âge Considérant l’âge, avec une médiane à 44 ans pour l’ensemble de la série (Fig. 56, courbe C), 47 ans pour les CH de la base (Fig. 56, courbe D) et 38 ans pour ceux du RC et de la CCC (Fig. 56, courbe E), on ne retrouve aucune différence significative que ce soit en termes de survie globale ou de survie sans progression. Tous les p sont supérieurs à 0,15. 20.6.3. Prise en charge primaire ou secondaire Pour l’ensemble de la série, la prise en charge primaire ou secondaire n’influence pas le taux de survie globale (Fig. 56, courbe F) (p = 0,9927) ; en revanche, la survie sans progression (courbe F) est très nettement modifiée (p = 0,0001). Pour les CH de la base et pour le groupe CH RC + CH CCC, l’influence de cette prise en charge est également significative, là encore uniquement pour la survie sans progression : respectivement p = 0,0440 et 0,0052. Inversement, la survie globale n’est pas significativement différente : respectivement p = 0,6892 et 0,9841 (Fig. 56, courbes D et E). Ceci confirme qu’un malade en récidive (prise en charge secondaire) voit son pronostic en termes de récidive amélioré par une prise en charge agressive : exérèse radicale et protonthérapie chaque fois que cela est possible. Le troisième paramètre étudié concerne l’association de la chirurgie à une protonthérapie. Pour l’ensemble de la série, le fait d’associer une protonthérapie à l’exérèse chirurgicale plutôt qu’à une autre forme de radiothérapie ou de n’en faire aucune, améliore significativement le taux de survie globale (p = 0,05), mais pas la survie sans progression (p = 0,29) (Fig. 56, courbe G). Dans le groupe de CH de la Base, elle améliore le taux de survie globale et sans progression : respectivement p = 0,0464 et 0,0346 alors qu’elle ne modifie ni l’un ni l’autre dans le groupe CH du RC et de la CCC : respectivement p = 0,1770 et 0,6569 (Fig. 56, courbes D et E). Il est difficile de tirer des enseignements de ces courbes actuarielles concernant ce paramètre « Protons » 20.6.4. Qualité d’exérèse Le quatrième paramètre est celui de la qualité de l’exérèse, totale ou non. Pour ce paramètre, la résection totale améliore la survie globale et sans progression pour l’ensemble de la série (Fig. 56, courbe H), respectivement p = 0,0020 et 0,0012, et pour le groupe RC et CCC, respectivement 0,0064 et 0,0021 (Fig. 56, courbe E) alors que ce n’est pas le cas dans les CH de la base, respectivement p = 0,115 et 0,199 (Fig. 56, courbe D). Néanmoins, les courbes pour les CH de la base sont très nettement disjointes avec à 5 ans une différence très marquée ; c’est la survenue de nombreux événements dans les 20 premiers mois qui expliquent la non-significativité. Ceci peut s’interpréter comme l’indication qu’exérèse totale ou non, les CH agressifs vont récidiver et décéder rapidement ; inversement l’exérèse totale permet une plus longue survie des autres CH. Il est par contre difficile de comprendre pourquoi la résection totale serait efficace sur les autres CH (du RC et de la CCC). Quoiqu’il en soit, le paramètre résection totale est comme cela est signalé dans
toutes les séries publiées, un facteur déterminant du pronostic des CH. Si l’on couple les deux derniers facteurs : protonthérapie et exérèse totale, on confirme clairement l’intérêt d’associer ces deux paramètres ; l’exérèse incomplète même associée à la protonthérapie n’obtient pas des résultats comparables (Fig. 56, courbe I). L’adjonction de protons à une exérèse incomplète n’apporte aucune amélioration significative du taux de survie globale (p = 0,19) et sans progression (p = 0,96) ; en revanche, la résection totale avec protons est supérieure à celle incomplète avec protons pour la survie globale (p = 0,012) et celle sans progression (p = 0,001). La survie globale est de 40 et 28 % en cas d’exérèse incomplète avec et sans proton et de 70 % en cas d’exérèse complète avec les mêmes valeurs à 5 et 10 ans La survie sans progression est de 30 % en cas d’exérèse incomplète (avec ou sans proton) à 5 ans et de 15 à 30 % à 10 ans alors qu’elle est de 80 % et de 60 % respectivement à 5 et 10 ans en cas d’exérèse complète.
21. Les chordomes de l’enfant (K. Beccaria, S. Puget, C. Sainte-Rose) 21.1. Revue de littérature 21.1.1. Épidémiologie Le chordome de l’enfant est une tumeur particulièrement rare puisqu’il représente moins de 1 % des tumeurs intracrâniennes dans cette tranche d’âge [303] et moins de 5 % des chordomes tous âges confondus [64,303,485,486]. L’âge moyen de survenue d’un chordome chez l’enfant se situe autour de 10 ans, le plus jeune cas décrit étant celui d’un nouveauné avec une tumeur du clivus [487]. Dans une revue de la littérature datant de 1987 sur les chordomes pédiatriques craniorachidiens (< 20 ans), l’âge moyen au diagnostic était de 8,2 ans (extrêmes : naissance–19 ans) [301]. Pour Coffin et al. [300], la majorité des cas de chordomes du sujet jeune surviendrait dans les 10 premières années de vie (83 % des cas de leur série). Benk et al. [321] rapportent un âge moyen de 12,6 ans, moins d’un tiers ayant moins de 10 ans (5/18 enfants). Dans sa revue des cas de chordomes pris en charge à la Mayo Clinic entre 1910 et 2006, Ridenour et al. [298] observent un pic d’incidence chez les sujets de moins de 25 ans situé entre 12 et 16 ans. Enfin, deux séries plus récentes de chordomes intracrâniens ont un pic d’incidence entre les deux premières décades : dans une revue de la littérature de 79 cas, Borba et al. [299] retrouve un pic d’incidence à environ 10 ans (121 mois), alors que l’âge moyen des 73 enfants traités dans la série de Hoch et al. [304] est de 9,7 ans. À partir de notre propre revue de la littérature, nous avons observé un âge moyen de 8,8 ans chez 111 enfants atteints de chordomes du clivus, de 8,6 ans chez 25 enfants atteints de chordomes vertébraux (cervicaux, thoraciques ou lombaires) et de 4,7 ans chez 20 enfants atteints de chordomes sacrococcygiens. Alors que chez l’adulte, les chordomes intracrâniens surviennent à un âge plus jeune que les chordomes sacrococcygiens [6,64,288], il semble que chez l’enfant, la tendance soit inversée et que les chordomes sacrococcygiens concernent plus fréquemment les enfants les plus jeunes. Le sex-ratio des chordomes pédiatriques est proche de 1. C’est le cas pour la revue de Sibley et al. [301] sur 74 cas toutes localisations confondues. Dans la série de Borba et al., toujours toutes localisations confondues, le sex-ratio est de 1,6 en faveur des filles. Par ailleurs, s’agissant des chordomes intracrâniens, on retrouve 58 % de patients de sexe féminin dans la série de 73 cas de Hoch et al. [304], alors que dans leur revue de la littérature, Borba et al. rapportent 54 % de garc¸ons.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
61
Tableau 22 Cas de chordomes pédiatriques extra-squelettiques. Cases of extra-skeletal paediatric chordoma. Auteur, année
Âge
Localisation
Traitement
Évolution
Durée de suivi
Jain et al. [492] Tao et al. [493] Berdal et Myhre [494] Yoneoka et al. [504] Dow et al. [80] Chang et al. [57] Figueiredo et al. [81] Horton et al. [496] Bianchi et al. [497] Jallo et al. [498] Zhou et al. [499] Sebag et al. [110] Clemons et al. [500] Stratt et Steiner. [501] Niida et al. [502] Kombogiorgas et al. [503]
NC 15 mois 10 ans 15 ans 9 ans 9 ans 18 ans 3,5 ans NC 13 ans 11 ans
Région glutéale Sinus paranasaux Ethmoïde, sinus maxillaire gauche Os temporal Cérébelleux droit Prépontique Pinéale + métastases abdominales Pré-sacré + métastases pulmonaires Pré-vertébral cervical Épidural C5-T1 Paravertébral C2-C5
NC Exérèse totale Exérèse partielle Exérèse partielle Exérèse totale Exérèse totale Aucun Chimiothérapie Exérèse totale + radiothérapie Exérèse partielle Exérèse partielle
NC RC MS NC RC RC Décès Décès RC MS MP
NC 3 ans 1 an 11,9 ans 1,2 ans 1 an – 2 mois 5 ans 3 ans 8 mois
14 ans 14 ans 5 ans 4 ans
Médiastin postéro-supérieure Pré-vertébral T3-T4 Rétroclival Rétroclival + foramens jugulaires et magnum
NC Exérèse totale Exérèse totale + radiothérapie Chimiothérapie (ifosfamide + doxorubicine)
NC NC RC NC
NC NC 1 an NC
NC : non communiqué ; RC : rémission complète ; MS : maladie stable ; MP : maladie progressive. NC: not communicated; RC: complete remission; MS: stable illness; MP: progressive illness.
21.1.2. Localisations anatomiques Contrairement à ce qu’avanc¸ait Sassin et Chutorian [488], pour qui les localisations sacrococcygiennes étaient les plus fréquentes chez l’enfant, les localisations intracrâniennes seraient majoritaires avec la répartition anatomique suivante chez les sujets de moins de 20 ans : 54 % en sphéno-occipital, 23 % sur la colonne mobile et 22 % en sacrococcygien [301]. Cette prédominance des localisations basi-crâniennes chez l’enfant est confirmée par d’autres auteurs : 100 % (12/12) dans la série de Wold et Laws [303], 50 % (6/12) pour Coffin et al. [300], et 100 % (2/2 enfants sur une série de 44 cas) pour Cummings et al. [489]. Les rares localisations au rachis mobile, 2 fois moins fréquentes que les localisations sacrées, sont essentiellement situées au niveau cervical (C2-C4), beaucoup plus rarement en lombaire ou en dorsal [490,491]. Au vu de l’ensemble des données disponibles chez l’enfant et chez l’adulte, il semblerait donc que les localisations intracrâniennes diminuent avec l’âge alors que les localisations sacrococcygiennes augmentent parallèlement. Outre ces localisations squelettiques classiques, des localisations extrasquelettiques de chordomes ont aussi été décrites chez l’enfant. Jain et al. [492] ont rapporté un cas de chordome de la région glutéale. Tao et al. [493] ont rapporté un cas de chordome des sinus paranasaux chez un enfant de 15 mois. Berdal et Myhre [494] ont rapporté également un cas de chordome de l’éthmoïde et du sinus maxillaire chez une enfant de 10 ans, sans envahissement sphénoïdal. Dans la série de chordomes de la base du crâne de Yoneoka et al. [495] est rapporté le cas d’un garc¸on de 15 ans présentant un chordome de l’os temporal opéré et radiothérapé et survivant à presque 12 ans du traitement. Il existe également 3 cas de chordomes intraduraux publiés chez l’enfant : 1 cas de chordome cérébelleux chez une fille de 9 ans [80], 1 cas de chordome prépontique chez 1 garc¸on de 9 ans [57] et 1 cas de chordome de la région pinéale chez un adolescent de 18 ans [81]. Les 2 premiers cas ont évolué favorablement à 14 et 12 mois de l’exérèse chirurgicale complète. Le troisième cas est particulier en ce sens qu’il s’agissait d’un enfant opéré et radiothérapé initialement pour un germinome de la région pinéale ; 16 ans plus tard, l’apparition d’une lésion abdominale sur le trajet d’une DVP avec récidive de la lésion primitive en région pinéale a fait réaliser une biopsie abdominale qui a conduit à corriger le diagnostic initial en faveur d’un chordome. Enfin, un certain nombre de cas ont été publiés présentant des chordomes développés en région paravertébrale ou para-clivale, sans envahissement osseux associé. Horton et al. [496] ont rapporté un cas de chordome pré-sacré métastatique et Bianchi et al. [497] un cas de chordome pré-vertébral cervical en région rétro-styloïdienne. Jallo et al. [498] ont publié un cas de chordome épidural C5-T1 avec érosion osseuse et élargissement
des foramen intervertébraux chez une enfant de 13 ans, et Zhou et al. [499] un cas de chordome C2-C5 érodant les foramens intervertébraux sans envahissement osseux évident chez une enfant de 11 ans. Sebag [110] a décrit un cas de chordome lombaire en sablier sans lyse ni envahissement osseux associé. Certains auteurs rapportent des cas de chordomes médiastinaux postérieurs : un chordome du médiastin postéro-supérieur chez une enfant de 14 ans [500] et un chordome pré-vertébral T3-T4 avec érosion vertébrale antérieure chez une enfant du même âge [501]. Deux cas de chordomes rétroclivaux sans envahissement clival objectivé à l’imagerie ou en peropératoire ont aussi été publiés. L’un chez un enfant de 5 ans est situé en arrière du clivus, sans envahissement de ce dernier ; [502]. L’autre un enfant de 4 ans avait un chordome rétroclival envahissant les foramens jugulaire et magnum et associé à des métastases vertébrale, falcorielle et pulmonaires [503] (Tableau 22). 21.1.3. Métastases Une grande variabilité d’incidence est retrouvée chez l’enfant en fonction des séries. Toutes localisations confondues, Ridenour et al. [298] et Coffin et al. [300] retrouvent respectivement 8,6 % (3/35, suivi moyen de 129 mois) et 58 % (7/12) de métastases cliniques ; dans sa revue de la littérature, Sibley et al. [301] retrouvent 23 % (17/74) de métastases chez les sujets de moins de 20 ans. Dans une série ne comprenant que des chordomes clivaux et cervicaux, Benk et al. [321] rapportent 3 cas de chordomes métastatiques sur 18, soit 17 %. Même si les chiffres semblent assez similaires à ceux retrouvés chez l’adulte, certains auteurs s’accordent à penser que les chordomes ont une plus grande tendance à métastaser chez l’enfant que chez l’adulte. Cela serait particulièrement vrai chez les enfants de moins de 5 ans par opposition au reste de la population pédiatrique [299,505,506]. Matsumoto et al. décrivent le cas d’un nourrisson de 4 mois, présentant un chordome du clivus et décédé 2 mois après le diagnostic, chez qui l’autopsie a retrouvé des emboles tumoraux dans les artères pulmonaires ainsi que deux localisations métastatiques surrénaliennes. Ils reprennent par ailleurs les 35 cas de chordomes d’enfants et adolescents de moins de 16 ans décrits dans la littérature, parmi lesquels 8 avaient moins de 5 ans. Quatre de ces 8 enfants avaient été autopsiés, et dans chaque cas (4/4), des métastases à distance avaient été retrouvées à l’autopsie : métastases pulmonaires (4/4), cardiaque (1/4) et surrénalienne (1/4). Kaneko et al. [506] rapportent le cas d’une enfant de 4 ans atteinte d’un chordome du clivus et décédée 9 mois après le diagnostic ; l’autopsie a permis de mettre en évidence de multiples métastases durales, osseuses (crâne, sternum, humérus, vertèbres),
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model
ARTICLE IN PRESS
NEUCHI-612; No. of Pages 78
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
62
Tableau 23 Incidence et délai de survenue des métastases (revue de la littérature). Incidence and delay for the occurrence of metastasis (literature review).
Intracrâniens (n = 119) Sacrococcygiens (n = 20) Rachis mobile (n = 35)
M+
M−
NP
M+ au diagnostic
M+ secondaires
25 (21 %) 11 (55 %) 10 (28,6 %)
60 (50,4 %) 7 (35 %) 11 (31,4 %)
34 (28,6 %) 2 (10 %) 14 (40 %)
6 (5 %) 5 (25 %) 1 (2,9 %)
5 (4,2 %) 3 (15 %) 3 (8,6 %)
Délai moyen (min–max) 3,2 mois (0–18 mois) 1,4 mois (0–6 mois) 4,3 mois (0–9 mois)
M+ : métastatique ; M− : non métastatique ; NP : non précisé. M+: metastatic; M−: non-metastatic; NP: not supplied.
pulmonaires bilatérales et hépatiques. En reprenant les cas de chordomes du clivus chez les enfants de moins de 5 ans publiés dans la littérature, les auteurs font remarquer que sur les 11 cas décrits, 7 enfants (soit 63 %) avaient présenté des métastases à distance, principalement pulmonaires. Enfin, Borba et al. [299], dans sa revue des chordomes intracrâniens de l’enfant, évaluent à 57,9 % le taux de métastases dans la population de moins de 5 ans, contre seulement 8,5 % chez les patients de 5 à 20 ans. On note par ailleurs que les chordomes sacrococcygiens et du rachis mobile sont plus à risque de métastaser que les chordomes intracrâniens. Dans la série de Ridenour et al. [298], 40 % des chordomes sacrococcygiens ont développé des métastases, contre 14 % des chordomes du rachis mobile et aucun chordome sphéno-occipital. Dans notre propre revue des chordomes de l’enfant, l’incidence des métastases est de 55 % pour les chordomes sacrococcygiens avec un délai moyen de survenue de 1,4 mois, 21 % pour les chordomes intracrâniens avec un délai moyen de survenue de 3,2 mois (Tableau 23). La dissémination métastatique se fait essentiellement par voie hématogène, particulièrement via les sinus duraux pour les chordomes du clivus [507], et les veines pré-sacrées pour les chordomes sacrococcygiens. Ces derniers auraient d’ailleurs une plus grande tendance à métastaser que les premiers, du fait très probablement de la richesse des plexus veineux environnants. La dissémination métastatique via le LCS a également été décrite, soit par les voies d’écoulement naturelles [265,506] ou par le biais d’une dérivation ventriculaire [81]. Sen considère que le risque de greffe métastatique sur la voie d’abord est non négligeable, même si nous n’avons pas retrouvé de cas pédiatrique clairement décrit dans la littérature. Un cas a cependant été observé dans la série de chordomes de Necker (non publié) : il s’agissait d’une enfant de 14 ans présentant un chordome s’étendant du clivus à C2. Une exérèse subtotale par voie transorale-transpalatine a initialement été réalisée nécessitant une prise de greffon graisseux abdominal pour la fermeture de la voie d’abord. Dix mois après la chirurgie, la patiente a développé une masse abdominale au niveau de la prise de greffe initiale. L’examen anatomopathologique de cette masse était en faveur d’un chordome. Les instruments utilisés lors de la première chirurgie ayant été les mêmes pour l’exérèse du chordome clival et pour la prise de greffon graisseux abdominal, cette lésion secondaire doit sans nul doute être considérée comme une greffe iatrogène de la tumeur clivale primitive. Le principal site de greffe métastatique est le poumon [299–301] ; lorsque des métastases sont retrouvées, rares sont les cas décrits où le poumon n’est pas concerné [81,265,300,508–511]. Selon Borba et al., le poumon serait concerné dans 78,5 % des cas de chordomes intracrâniens métastatiques. Les sinus duraux seraient une source non négligeable d’emboles tumoraux pulmonaires chez l’enfant [507,512]. Viennent ensuite les localisations osseuses [506,511], ganglionnaires (cervicales, inguinales, sus-claviculaires) [300,301,507,511], cutanées [506,513], hépatiques [321,506,513] et, de manière plus anecdotique cérébrales et médullaires, rénales [513], méningées [265,506], cardiaques [513,514], pleurales [301] et surrénaliennes [300,505]. Il n’est pas rare que les métastases soient déjà présentes au diagnostic de la maladie ; sinon, leur
développement survient en général dans les mois suivant le diagnostic, contrairement à ce que l’on voit généralement chez l’adulte. Ainsi, dans notre propre revue de la littérature, 25 % des patients atteints de chordomes sacrococcygiens sont décrits comme étant métastatiques lors du diagnostic de la maladie, contre 5 % pour les chordomes intracrâniens et 2,9 % pour les chordomes du rachis mobile ; lorsque les métastases sont diagnostiquées au cours de l’évolution de la maladie, elles surviennent en moyenne 1,4 mois après le diagnostic pour les chordomes sacrococcygiens, 3,2 mois pour les chordomes intracrâniens, et 4,3 mois pour les chordomes du rachis mobile (Tableau 2). On note des extrêmes pouvant aller jusqu’à 6, 9 et 18 mois pour les chordomes sacrococcygiens, du rachis mobile et intracrânien respectivement. Chambers et Schwinn [244] ont mis en évidence une relation entre l’incidence des métastases et les récurrences locales. Selon Benk et al. [321], cette relation est applicable à la population pédiatrique ; dans leur série, 3 patients ont développé des métastases, associées dans 2 cas à une récurrence locale. 21.1.4. Clinique Coffin et al. écrivaient en 1993 : Unusual clinical presentations are the rule rather than the exception in young patients. Cependant, chacune des localisations de chordomes donne lieu à une symptomatologie clinique assez caractéristique même si non spécifique, en rapport avec une invasion tumorale locale. L’atteinte des paires crâniennes est le principal mode de révélation des chordomes de la base du crâne, présente dans environ 60 % des cas [321,505]. La VIe paire crânienne est la plus fréquemment concernée [299], probablement du fait de la proximité du VI au clivus, son point d’entrée dans le sinus caverneux se situant juste au-dessous du processus clinoïde postérieur [515]. La fréquence des céphalées est d’au moins 40 % des cas [299,505], éventuellement intégrées dans un syndrome d’hypertension intracrânienne (HTIC) dans 28 % des cas [505]. Selon les mêmes auteurs, l’atteinte des voies longues avec syndrome pyramidal est de 36 % des cas. Une fois de plus il semblerait que deux sous-groupes d’âge puissent être distingués au sein de la population pédiatrique [505,516]. Les enfants de moins de 5 ans présentent en effet plus fréquemment un syndrome d’hypertension intracrânienne (72 %) ou une atteinte des voies longues (43 %) que les enfants plus âgés (12,5 % pour chaque type de symptôme), alors que le mode de présentation le plus fréquent chez les enfants de plus de 5 ans comprend la diplopie et les céphalées isolées (55 et 42 % respectivement). Certains chordomes s’étendent du clivus au rachis cervical au travers du Foramen Magnum et se présentent avec une symptomatologie très riche comprenant nerfs crâniens, atteintes des voies longues, HIC, obstruction nasopharyngée, et torticolis ([516] : 2 enfants de 3 ans ; [487] : 1 nouveau-né ; [505] : 1 enfant de 4 mois). Nolte décrit pour ces formes des extensions supérieures, inférieures, antérieures et postérieures. Ces formes se voient principalement chez les jeunes enfants ce que confirment Matsumoto et al. pour qui 75 % des chordomes avant 5 ans ont cette extension. Il n’est pas rare chez l’enfant que les chordomes sacrococcygiens se révèlent par l’apparition rapidement progressive d’une masse sous-cutanée, éventuellement ulcérée [517–519] ; en cas
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
de développement antérieur dans l’espace pré-sacré, la tumeur peut atteindre des tailles importantes avant d’être diagnostiquée, du fait de l’espace libre dans lequel elle peut se développer. Des douleurs sont très fréquemment associées, représentant parfois le symptôme principal. Il peut s’agir de douleurs périnéales ou de radiculalgies [519,520]. Les troubles digestifs et urinaires ne sont pas rares, à type de constipation ou d’incontinence anale, de troubles mictionnels ou d’incontinence urinaire. Ils ont une origine neurologique par compression et/ou envahissement des racines de la queue de cheval, mais aussi mécanique, par compression directe des voies digestives et urinaires par la masse pré-sacrée [517,521]. L’atteinte des racines de la queue de cheval peut aussi donner lieu à une anesthésie en selle et/ou à des troubles sensitifs des membres inférieurs. Au niveau du rachis mobile, la symptomatologie prédominante dépend de l’orientation du développement de la tumeur. Dans la majorité des cas, un développement postérieur de la lésion est responsable d’une compression médullaire ou des racines de la queue de cheval [106,300,485,491,522,523]. Le développement antérieur de la lésion peut être responsable de troubles respiratoires et/ou dysphagiques dans les cas de localisations cervicales ou thoraciques [524] ; Coffin et al. rapportent un cas de chordome thoracique développé en T12 révélé par une paraplégie et un hémothorax. D’une manière plus générale, les douleurs sont fréquentes, souvent insidieuses et d’intensité progressive. Leur étiologie est mixte : déplacement des tissus mous, destruction osseuse, compression radiculaire, augmentation de la mobilité de segments vertébraux devenus instables [524]. La raideur et/ou la déformation rachidienne(s) sont également rapportées par plusieurs auteurs [300,522,525,526]. On notera enfin que les traumatismes directs de la région sacrococcygienne ou vertébrale seraient d’après certains auteurs un facteur favorisant le développement des chordomes dans ces localisations ; plusieurs cas ont ainsi été décrits d’enfants développant un chordome sacrococcygien [510,520,527] ou vertébral [522] dans les semaines suivant une ou plusieurs chutes avec traumatisme postérieur. Dans la série de chordomes vertébraux et sacrococcygiens tous âges confondus de Rosenquist et al., 7 patients sur 16 avaient ainsi présenté un traumatisme dans les semaines précédant le diagnostic de la maladie [527]. Les auteurs rapprochent facilement cette observation des travaux originaux de Ribbert [18] (Section 1). 21.1.5. Anatomopathologie On retrouve chez l’enfant les mêmes formes histologiques de chordomes que chez l’adulte. Même si l’existence de certaines reste débattue [528], quatre formes principales sont classiquement décrites : classiques, chondroïdes, atypiques et dédifférenciés. Il est cependant difficile d’évaluer avec précision l’incidence de chacune des formes histologiques dans la population pédiatrique, d’une part, du fait de critères diagnostiques histologiques et de modes de description variables d’une étude à l’autre, d’autre part, du fait du peu de séries disponibles chez l’enfant. Même si certains auteurs insistent sur le fait que les chordomes de l’enfant sont caractérisés par un plus grand pléomorphisme que les chordomes de l’adulte [300,505], on peut noter cependant que dans les plus grandes séries pédiatriques, les formes « classiques » sont majoritaires : 89 % dans la série de Benk et al. [321], 58 % dans les séries de Wold et Laws [303] et de Hoch et al. [304], et 57 % dans la série de Ridenour et al. [298]. La revue de la littérature proposée par Borba et al. [299] en 1996 à propos des chordomes intracrâniens des sujets de moins de 20 ans confirme cette observation puisque les formes classiques représentent 64,6 % des 79 cas décrits ; d’après cette même revue, les formes atypiques concernent 22,4 % des cas, et les formes chondroïdes 13,5 % des cas. Les enfants de moins de 5 ans se distinguent du reste de la population pédiatrique : 35 % des sujets de moins de 5 ans présentent une forme
63
classique, et 65 % une forme atypique, alors que parmi les sujets de plus de 5 ans, 78,7 % présentent une forme classique, 4,2 % une forme atypique et 17,1 % une forme chondroïde. D’ailleurs, il est intéressant de noter que dans les séries de Wold et Laws [303] et de Benk et al. [321], au sein desquelles l’âge moyen des sujets est respectivement de 13,6 ans et 12,7 ans, ne sont décrites que des formes classiques (58 % et 89 % respectivement) et chondroïdes (42 et 11 % respectivement). À l’inverse, dans la série de Coffin et al. [300], dans laquelle l’âge moyen des patients est de 6 ans, seules des formes atypiques à contingent sarcomatoïde sont décrites (50 %, âge moyen 46 mois) en plus des formes classiques (50 %, âge moyen 89 mois). Par ailleurs, dans la série de Hoch et al. [304], on trouve des formes classiques (58 %), chondroïdes (23 %), cellulaires (11 %) et peu différenciées (8 %) au sein d’un groupe de patients dont l’âge moyen est de 9,7 ans. Il semble donc bien que l’incidence des différents types histologiques soit dépendante de l’âge du patient, avec une prédominance de formes atypiques chez les sujets les plus jeunes. 21.1.6. Traitement La prise en charge thérapeutique des chordomes repose sur une stratégie associant chirurgie et radiothérapie complémentaire ; la chimiothérapie n’a pas encore sa place en pratique courante. 21.1.6.1. Chirurgie. Comme chez l’adulte, tous les auteurs s’accordent depuis longtemps sur le fait qu’une exérèse chirurgicale la plus large possible doit être réalisée en première intention [243,303,319,321,529,530]. D’ailleurs, même si la différence n’est pas statistiquement significative, Ridenour et al. [298] observent dans leur série, une meilleure survie après exérèse totale versus exérèse partielle (p = 0,374). Étant donné le caractère agressif de ces tumeurs, l’objectif de la chirurgie doit être une exérèse aussi complète que possible, au besoin en plusieurs temps [531]. Pour ce faire, les voies d’abord sont souvent différentes d’un geste à l’autre, s’adaptant à la localisation et à l’extension tumorale. Pendant longtemps, les localisations habituelles des chordomes ont souvent obligé les chirurgiens à se contenter d’une exérèse partielle [532] du fait de la proximité de structures nerveuses (nerfs crâniens, tronc cérébral, moelle spinale, racines sacrées) ou vasculaires (carotides, tronc basilaire). Récemment, les techniques d’imagerie moderne, de neuronavigation, de microchirurgie et de l’endoscopie ont permis aux chirurgiens d’être de plus en plus agressifs et d’obtenir de meilleures exérèses que dans le passé, même si les exérèses incomplètes restent fréquentes dans les principales séries pédiatriques publiées (Tableau 24). Les voies d’abord utilisées ne diffèrent pas de celles de l’adulte avec parfois des combinaisons d’abords chirurgicaux en un ou plusieurs temps [106,526]. Une fixation rachidienne est parfois nécessaire en cas de destruction osseuse trop importante avec instabilité [106,518,524,526,527]. Pour les chordomes sacrés, la discussion porte surtout sur l’intérêt et la possibilité de réaliser une exérèse en bloc [519]. 21.1.6.2. Radiothérapie. Bien que les chordomes soient considérés comme des tumeurs relativement radiorésistantes, l’utilisation de la radiothérapie à fortes doses semble permettre un certain degré de contrôle tumoral et très tôt, la plupart des auteurs ont conseillé l’association d’une irradiation complémentaire à la chirurgie d’exérèse [64,485,533,534]. Seule la série de Wold et Laws [303] donne une idée des résultats à long terme de cette attitude thérapeutique sur une population exclusivement pédiatrique de 12 patients, d’âge moyen de 13,6 ans, présentant des chordomes intracrâniens (clivaux ou de la région sellaire). Tous les patients ont été traités par chirurgie première, radicale ou partielle ; une radiothérapie conventionnelle a été associée chez 10 d’entre eux. Le délai moyen de suivi était de 67 mois (1 à 252 mois). Au cours
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 64
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Tableau 24 Type d’exérèse (biopsie/incomplète/complète/NP : non précisé) en fonction de la localisation du chordome dans les principales séries pédiatriques de la littérature. Type of excision (biopsy/incomplete/complete/NP: not supplied) as a function of the localisation of the chordoma in the principal paediatric series reported in the literature.
Wold et Laws [303], (n = 11) Coffin et al. [300], (n = 11)
Benk et al. [321], (n = 18) Ridenour et al. [298], (n = 20)
Localisation
Biopsie
Incomplète
Complète
NP
Intracrâniens Intracrâniens Cervicaux Thoraciques Lombaires Sacrococcygiens Intracrâniens Cervicaux Intracrâniens Rachis mobile Sacrococcygiens
2 1 0 0 0 1 0 0 1 0 1
3 2 1 1 1 0 15 3 12 1 1
4 3 0 0 0 0 0 0 1 3 0
2 0 1 0 0 0 0 0 0 0 0
du suivi, deux patients sont décédés d’une progression de la maladie après 26 et 44 mois et deux autres patients de causes non liées au chordome. Tous les patients vivants lors du dernier contrôle avaient bénéficié d’une ou plusieurs chirurgies suivie(s) de radiothérapie. La chirurgie avait été radicale pour 4 d’entre eux, partielle pour 2 ; la qualité de l’exérèse n’était pas précisée pour les deux derniers. Parmi les survivants, 2 patients opérés de chordomes latéro-sellaires ont eu à distance un pan-hypopituitarisme pour l’un, une obésité et une épilepsie séquellaire pour l’autre ; les autres patients étaient décrits comme allant « bien » ou étant « améliorés ». À plus grande échelle, l’intérêt de l’association chirurgie et radiothérapie dans la population pédiatrique semble confirmé par Borba et al. [299] qui dans leur revue de la littérature des chordomes intracrâniens, affirment que l’association d’une exérèse chirurgicale, qu’elle soit partielle ou totale, suivie d’une radiothérapie (type non précisé) offre un meilleur pronostic que l’exérèse chirurgicale seule (p = 0,00446). La radiothérapie chez l’enfant en pleine croissance a cependant ses limites, du fait des complications qu’elle peut entraîner [535]. Dans ce contexte, la protonthérapie s’est imposée peu à peu comme la technique d’irradiation de référence [322,324]. Elle permet en effet l’application de hautes doses de radiations ionisantes, mais de fac¸on plus ciblée avec une réduction d’un facteur 2 à 3 de la dose délivrée aux structures voisines saines (encéphale, hypophyse, cochlée. . .) [536]. Dans les séries pédiatriques les plus récentes, la protonthérapie est d’ailleurs la technique préférentiellement utilisée, avec de bons résultats à long terme. Dans la série publiée par Hoch et al. [304], issue entre autres du Massachusetts General Hospital, 73 enfants ont été traités pour des chordomes de la base du crâne par chirurgie première, puis irradiation complémentaire systématique par protons. L’âge moyen au diagnostic était de 9,7 ans (1–18 ans). Le taux de survie globale était de 81 % avec un suivi moyen de 7,25 ans (1–21 ans). Les auteurs considèrent que le pronostic est donc meilleur que dans les séries adultes où il varie de 23 à 66 % [537,538], et est de 55 % à 5 ans dans une série de patients adultes également traités au Massachusetts General Hospital [539]. Ils expliquent cette différence notamment par une meilleure efficacité de la protonthérapie chez les sujets jeunes. Dans la série de Benk et al. [321], 18 cas de chordomes de la base du crâne et cervicaux ont été traités par une ou deux procédures chirurgicales suivies systématiquement d’une irradiation fractionnée mixte par photons et protons. Dans 8 cas, deux gestes chirurgicaux ont été réalisés avant irradiation afin de réduire au maximum le volume tumoral ; pour les 18 cas, l’exérèse chirurgicale était considérée comme incomplète au moment de l’irradiation. Les taux de survie globale et sans progression à 5 ans étaient respectivement de 68 et 63 %. Les auteurs considèrent la morbidité de la technique acceptable ; 2 patients ont présenté un déficit en hormone de croissance nécessitant une substitution, 1 patient a développé une nécrose du lobe temporal asymptomatique et 3 patients une hypoacousie unilatérale.
21.1.6.3. Chimiothérapie. Comme chez l’adulte, l’utilisation de la chimiothérapie dans la prise en charge des chordomes pédiatriques est encore anecdotique, et on dénombre seulement une vingtaine d’enfants traités par chimiothérapie dans la littérature [240,300,303,321,369,507,513,540,541]. Certains auteurs considèrent que la chimiothérapie des sarcomes peut être utilisée pour les chordomes, notamment en cas de forme histologique indifférenciée [285,513]. La molécule la plus souvent utilisée est l’ifosfamide, en association fréquente avec l’étoposide [507,541] ou la doxorubicine [369,541]. L’indication de traitement par chimiothérapie diffère selon les auteurs, mais est le plus souvent une option de dernière intention lorsque les traitements classiques (chirurgie et radiothérapie) ne sont plus possibles ou inefficaces [240,300,303,321]. À l’inverse, des enfants très jeunes ont été traités par chimiothérapie première en cas de lésions considérées comme inopérables et métastatiques d’emblée, dont le diagnostic avait été fait par biopsie [300,369,507,513,528]. Enfin autre attitude, dans la série de 6 cas de chordomes du clivus publiée par Dhall et al. [541], la chimiothérapie faisait partie intégrante du traitement de première intention. En cas de résection partielle, la chimiothérapie était indiquée comme traitement adjuvant de première intention, associée à une radiothérapie en cas de chordome indifférencié. En cas d’exérèse subtotale, seule la radiothérapie était indiquée en traitement adjuvant de première intention ; une chimiothérapie était proposée en cas de récidive évolutive. Le protocole de chimiothérapie de première ligne associait ifosfamide et étoposide. Un patient de 2 ans a eu une exérèse subtotale première d’un chordome, suivie de radiothérapie conventionnelle ; une chimiothérapie par ifosfamide et étoposide a été réalisée après récidive tumorale locale et l’enfant est vivant avec un résidu stable après 13 ans de recul. Deux enfants de 11 mois et 7 ans ont eu une exérèse partielle première de chordomes avec chimiothérapie concomitante par ifosfamide et étoposide ; tous les deux sont vivants avec un résidu tumoral stable après 9 ans de recul. Pour deux enfants de 5 et 8 ans, une exérèse partielle première de chordomes indifférenciés a été réalisée, suivie d’un traitement concomitant mixte par chimiothérapie et radiothérapie. L’un est vivant avec un résidu tumoral stable à 6 ans. Pour l’autre, du fait d’une récidive évolutive, l’enfant a été réopéré avec une chimiothérapie adjuvante par ifosfamide et doxorubicine, puis glivec et celebrex ; il a développé secondairement une leucémie aigüe myéloïde et est décédé d’un saignement intracrânien avec une maladie évolutive à un peu plus de 3 ans du diagnostic. Un adolescent de 15 ans a refusé tout traitement complémentaire après chirurgie d’exérèse partielle ; il est décédé 1,5 ans après le diagnostic. Les résultats sont encourageants puisque sur les 5 enfants ayant rec¸u un traitement complémentaire, 4 sont encore en vie avec un résidu stable lors du dernier contrôle, entre 6 et 13 ans après le diagnostic ; on note que les deux enfants traités par chirurgie et chimiothérapie
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
sans radiothérapie sont tous les deux en vie avec un résidu stable après 9 ans de recul. Dhall et al. [541] concluent que la chimiothérapie, notamment l’association ifosfamide-étoposide, peut être discutée comme traitement adjuvant en cas de résidu tumoral après chirurgie. Au vu des différents cas décrits ci-dessus, le choix de l’ifosfamide en première ligne, en association avec la doxorubicine ou l’étoposide semble intéressant et prometteur, puisque, à l’exception d’un cas, tous les sujets traités par ces associations en première ligne ont montré une réponse tumorale et sont pour la plupart encore vivants au dernier contrôle. Le patient décrit par Scimeca et al. [369] a nettement répondu cliniquement et radiologiquement à l’association ifosfamide et doxorubicine ; il est décédé secondairement après modification de la chimiothérapie du fait de la toxicité cardiaque cumulative de la doxorubicine. Enfin, le patient rapporté par Auger et al. [507] est décédé malgré l’association ifosfamide et étoposide ; outre le fait qu’il s’agissait d’une tumeur très invasive localement, il faut surtout noter que l’enfant est décédé d’une défaillance respiratoire et que de multiples emboles tumoraux pulmonaires associés à des plages d’infarctus ont été retrouvés à l’autopsie. Dans le traitement de chordomes sacrococcygiens, les résultats de la chimiothérapie ne sont pas plus probants [302,519,542]. 21.1.7. Facteurs pronostiques Il est admis que le pronostic des chordomes est globalement meilleur chez l’enfant que chez l’adulte ; c’est ce qu’avancent Wold et Laws [303] et Hoch et al. [304] qui rapportent des taux de survie de 50 et 81 % respectivement, sur des périodes de suivi allant de 1 mois à 21 ans. Cependant, cette affirmation doit être nuancée car le pronostic chez l’enfant dépend de l’âge avec une évolution plus péjorative chez les très jeunes enfants, notamment avant l’âge de 5 ans [299,300,322,505,506,543]. L’incidence des métastases au diagnostic est également très élevée dans cette tranche d’âge. En dehors de quelques cas, la plupart de ces enfants décèdent effectivement dans les 18 mois qui suivent le diagnostic malgré les traitements par chirurgie, radiothérapie et/ou chimiothérapie [300,301,369,488,505–507,511,514,516,540,544]. L’évolution plus rapide et agressive des chordomes chez les enfants en bas âge, peut entre autres s’expliquer par la plus grande fréquence des formes histologiques atypiques chez les moins de 5 ans [300,304]. Dans la série de Ridenour et al. [298], le taux de mortalité des formes atypiques et dédifférenciées est de 67 %, contre 27 % en moyenne pour les formes conventionnelles et chondroïdes. Dans la série de Hoch et al. [304], les taux de mortalité des formes conventionnelles, chondroïdes et faiblement différenciées étaient respectivement de 14, 18 et 83 % pour un suivi moyen de 7,25 ans. Dans la série de Coffin et al. [300], les 6 patients présentant des formes atypiques de chordomes sont décédés au cours du suivi, entre 3 semaines et 6 mois après le diagnostic ; 4/6 ont présenté des métastases au cours de l’évolution de leur maladie. Enfin, une revue de la littérature des chordomes intracrâniens des sujets de moins de 20 ans corrobore ces résultats puisque la mortalité était respectivement de 23,1, 37,5 et 100 % pour les formes conventionnelles, chondroïdes et atypiques. Parmi les enfants avec des formes classiques, 2 étaient encore en vie lors du dernier contrôle, l’un à 3 ans du diagnostic sans signe de maladie évolutive, l’autre à 1 an, en récidive ; quatre patients étaient décédés, à des délais de 4,5 ans, 4 ans, 2 mois et non précisé dans 1 cas. Par ailleurs, les formes chondroïdes pédiatriques ne sont pas de meilleur pronostic que les formes conventionnelles [243,303,545]. Ainsi, le type histologique n’est pas un facteur pronostique dans la série de 18 patients de Benk et al. [321] qui ne comprenait que des formes conventionnelles et chondroïdes. Cependant, dans la série de Ridenour et al. [298], le taux de mortalité des formes conventionnelles est significativement moins élevé que pour les autres formes (20 % pour les conventionnels, 33 % pour les chondroïdes) et la durée de survie
65
est significativement plus élevée pour les formes conventionnelles (119 mois contre 26 pour les formes chondroïdes). La localisation primitive du chordome semble chez l’enfant être un élément pronostique. En effet, il semble que les localisations intracrâniennes soient de meilleur pronostic que les localisations du rachis mobile, elles-mêmes de meilleur pronostic que les localisations sacrococcygiennes. Benk et al. [321] ont publié une série de 18 chordomes intracrâniens et cervicaux. Dans la limite du nombre de patients décrits, les localisations cervicales (n = 3) étaient de moins bon pronostic que les localisations intracrâniennes (n = 15). En effet, 2/3 patients avec chordomes cervicaux étaient décédés à l’issue du suivi, l’une à 6 mois du diagnostic avec une récidive locale et des métastases pulmonaires, l’autre à 7 mois du diagnostic avec des métastases pulmonaires, hépatiques et osseuses. Le troisième patient était vivant à 100 mois de recul. À l’inverse, seuls 2/15 patients avec localisations intracrâniennes sont décédés au cours du suivi, toutes les deux à 39 mois du diagnostic du fait d’une progression tumorale locale. Dans la série de Ridenour et al. [298], les 3 cas de métastases observées l’ont été chez des patients atteints de chordomes du rachis mobile (n = 1, 1/7 soit 14 % dans cette localisation), ou de chordomes sacro coccygiens (n = 2, 2/5 soit 40 % dans cette localisation) ; aucune métastase n’a été observée chez les patients atteints de chordomes sphéno-occipitaux. D’un point de vue histologique, les localisations rachidiennes étaient aussi plus agressives que les localisations intracrâniennes : 100 % des chordomes sacrococcygiens étaient atypiques (5/5), 29 % des chordomes du rachis mobile étaient dits dédifférenciés (n = 2/7 contre 5/7 conventionnels) et parmi les chordomes sphéno-occipitaux, 22 % étaient dédifférenciés ou atypiques (n = 1/23 dédifférencié et n = 4/23 atypiques, contre 3/23 chondroïdes et 15/23 conventionnels). Cela se traduisait par une mortalité variable selon les localisations : 35 % (8/23) en sphéno-occipital après un délai moyen de 68 mois, 14 % (1/7) pour le rachis mobile après un délai moyen de 40 mois (avec 2/7 perdus de vue), et 80 % (4/5) en sacro coccygien après un délai moyen de 76 mois (et 1/5 perdu de vue). Enfin, on peut citer la série de Coffin au sein de laquelle 6 enfants étaient atteints de chordomes extracrâniens : 1 cas de chordome lombaire décédé à 6 mois du diagnostic avec des métastases péritonéales, 1 cas de chordome pré-sacré décédé à 2 mois avec des métastases pulmonaires, 2 cas de chordomes thoraciques décédé à 4 ans sans métastases pour l’un, et avec des métastases multiples pour l’autre, et 2 cas de chordomes cervicaux décédés avec des métastases. À l’inverse, parmi les localisations intracrâniennes, 2 enfants étaient encore en vie à 3 ans et 1 an, les autres étant décédés à 3 semaines et 3 mois avec des métastases pour les uns, et à 6 mois et 4,5 ans du diagnostic sans métastases pour les autres. 21.2. Série Necker–Lariboisière Une analyse rétrospective de la série de chordomes pédiatriques opérés à Necker et Lariboisière durant la période 1976–2010 a été Tableau 25 Signes cliniques au diagnostic. Clinical signs at diagnosis. Signes cliniques
Nombre (%)
Céphalées Douleur rachis Raideur rachidienne Torticolis Atteinte nerf oculomoteur Atteinte nerfs mixtes Déficit moteur Syndrome cérébelleux Radiculalgie Malaise
10 (32,3) 14 (45,2) 5 (16) 7 (22,6) 9 (29) 6 (19,3) 7 (22,6) 3 (9,7) 5 (16,1) 2 (6,5)
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
Localisation
Signes au diagnostic
Histo
Exerèses (nombre)
RT (dose, CGE)
Séquelles
Statut final
Suivi
1
13,5
F
C2-C4
Chordome
1
Protons (74)
Paresthésies MSG
RC
10 ans 3 mois
2
4
M
Clivus-C2
Cervicalgies, parésie MSG, radiculalgies C5C6C7 G, torticolis Troubles de l’équilibre et de la marche
Chordome
3
Photons (34,2) + protons (34,2)
RC
10 ans 10 mois
3
5
M
Clivus-C2
Boiterie, torticolis douloureux, parésie MI et MS
C. chondroïde
3
Photons (34,2) + protons (34,2)
Raideur cervicale, hypoesthésie V2, hypoacousie G, déficit somatotrope Hémiparésie G, scoliose dorso-lombaire, déficits somatotrope et thyréotrope Raideur cervicale, XII Dt, asymétrie voile du palais Aucune NA
RC
9 ans 2 mois
MS
3 ans 7 mois
RC DcD
8 ans 4 mois 0 ans 10 mois
4
8,5
M
Clivus-C2
Raideur cervicale, AEG, voix nasillarde
Chordome
3
Photons (34,2) + protons (34,2)
5 6
10,5 11,5
F M
C2-C5 C1-C3
Chordome Chordome
2 3
Protons (74) Photons (NC)
7
11,5
F
Clivus-C2
Hémiparésie G Céphalées, torticolis, radiculalgie Céphalées, malaises
Chordome
3
Photons (34) + protons (36)
8
11
M
C2-C4
Cervicalgies
Chordome
2
9
12
M
Clivus-C2
Chordome
2
10
13
F
Clivus
Cervicalgies, XII G, voussure du palais Céphalées
Chordome
3
11
14,5
M
Clivus-C2
C. chondroïde
2
12
14,5
F
Clivus-C2
Chordome
1
13
14
M
Clivus-C2
Cervicalgies, raideur cervicale, céphalées Troubles de déglutition, dysphonie, diplopie (VI, IX, X, XII G), parésie MSG HTIC
Photons (39,6) + protons (27) Photons (39,7) + protons (28,8) Photons (34,2) + protons (36) Photons (34,2) + protons (36) Photons (55 clivus + 50 C1C2)
Chordome
2
14
16
M
Charnière
C. chondroïde
4
15 16
8 10,5
M F
Clivus-C5 Clivus
Torticolis douloureux, XII Dt Rhinolalie et apnées Céphalées, VI G
Chordome Chordome typique
4 1
Photons (46) + protons (26) Photons (45) + protons (26) Photons Protons (68)
17
5,5
M
C7-T2
Chordome
2
18
3,5
M
Clivus-C2
Chordome atypique
F
Clivus
M M
Clivus Clivus
19
20 21
14
4,5 7,5
Cornage, ADP cervicales Torticolis douloureux, VI G Céphalées, III Dt
VI bilatéral Torticolis douloureux, céphalées, syndromes cérébelleux, déficit moteur, troubles sphinctériens
XII G, retard de croissance, hypoacousie, parésie CV G XII et XI G, CBH G
MS
6 ans 11 mois
DcD
1 an 8 mois
NA
DcD
2 ans 7 mois
V1 G
RC
9 ans 6 mois
NA
DcD
4 ans 3 mois
NA
DcD
2 ans
VI, VIII G, déficit somatotrope NA
MS
7 ans 2 mois
DcD
3 ans 1 mois
MS RC
2 ans 5 mois 5 ans 4 mois
NA
VI Dt, raideur cervicale Pan-hypopituitarisme substitué Aucune
RC
0 ans 11 mois
1
NA
NA
DcD
0 ans 4 mois
Chordome
2
11 ans 10 mois
1 3
BAV G, pan-hypopituitarisme, hypoacousie Dte, NA NA
MS
Chordome atypique Chordome
Radiochir (18) + photons (37,8) + protons (33,2) NA Photons (50)
DcD DcD
0 ans 0 mois 19 ans 11 mois
ARTICLE IN PRESS
Sexe
G Model
Âge (ans)
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
CVas
NEUCHI-612; No. of Pages 78
66
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
Tableau 26 Récapitulatif de la série de Necker–Lariboisière. Summary of the Necker–Lariboisière series.
G Model
NEUCHI-612; No. of Pages 78
Âge (ans)
Sexe
Localisation
Signes au diagnostic
Histo
Exerèses (nombre)
RT (dose, CGE)
Séquelles
Statut final
Suivi
22
7
M
Clivus-C3
Chordome
4
Photons (55,8)
IX, X G
RC
3 ans 3 mois
23
13
M
Clivus
Cervicalgies et raideur cervicale Diplopie
Chordome
1
Aucune
RC
17 ans 6 mois
24
12,5
M
Clivus-C2
Chordome
3
XII Dt
MS
5 ans 8 mois
25
5,5
F
Clivus-C2
HTIC avec atrophie optique, syndromes pyramidal et cérébelleux, déficit moteur Douleurs, VI
Photons (40) + protons (20) Photons (55)
Chordome
3
NC
MS
11 ans
26 27
8 16,5
F M
Clivus Charnière
Céphalées, VI VI, XII G
Chordome Chordome
2 4
Paralysie oculomotrice NA
MS DcD
5 ans 4 mois 3 ans 9 mois
28
18
M
Clivus
V2, VI Dt
C. chondroïde
2
NC
R
1 an 4 mois
29
17,5
M
Clivus
Diplopie (VI Dt)
Chordome
1
Aucune
R
13 ans 8 mois
30
15
F
Charnière
XII Dt, hémiparésie G
Chordome
2
Photons (34) + protons (34) Radiochirurgie (40) Photons (NC) + protons (NC) Photons (36) + protons (36) Protons (45) + photons (22) Photons (60)
MS
8 ans
31
17
F
Charnière
VI, IX, X, XI, XII G, cervicalgies, masse rétro-auriculaire G, hypoesthésie C2
Chordome
3
NC
Nerfs mixtes, déficit moteur Paralysie oculomotrice, nerfs mixtes, déficit moteur, troubles sphinctériens
MS
3 ans 1 mois
ADP : adénopathies ; CGE : Cobalt Gray Equivalent ; DcD : décédé de la maladie ; Dt : droit ; G : gauche ; MS : maladie stable ; NA : non applicable ; NC : non connu ; R : rémission ; RC : rémission complète. ADP: lymphadenopathy; CGE: Cobalt Gray Equivalent; DcD: death; Dt: right; G: left; MS: stable illness; NA: not applicable; NC: unknown; R: remission; RC: complete remission.
ARTICLE IN PRESS
CVas
B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
Tableau 26 (Suite )
67
G Model NEUCHI-612; No. of Pages 78 68
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Fig. 57. Survie sans progression (A) et survie globale (B) de la série de chordomes pédiatriques. Survival without progression (A) and global survival (B) for the series of paediatric chordoma.
réalisée. Les données cliniques, radiologiques, histologiques, les traitements et résultats ont été revus à partir des dossiers des enfants. Trente et un enfants âges de 3,7 à 18 ans (médiane 12 ans), avec une prédominance de garc¸ons (20 M/11F), ont été pris en charge pour cette pathologie. Les signes cliniques présents au diagnostic sont résumés dans le Tableau 25. Les chordomes étaient localisés au niveau du clivus (n = 9), étendus du clivus au rachis cervical (n = 13), localisés à la charnière (n = 4) et situés au niveau du rachis cervical (n = 5). Aucun patient n’avait de métastase au diagnostic. La prise en charge des patients et les résultats sont résumés dans le Tableau 26.
21.2.1. Chirurgie Huit patients ont d’abord eu une biopsie de leur lésion puis une exérèse aussi complète que possible en 1 (3 patients), 2 (3 patients) ou 3 temps (2 patients). Pour les 23 autres patients, l’exérèse chirurgicale a été maximale après une chirurgie (8 patients) ou après plusieurs temps (2 pour 7 patients ; 3 pour 7 patients et 4 pour 1 patient). On note 5 exérèses complètes et 26 incomplètes avant radiothérapie. Le chordome était intradural (48,1 % des cas), extradural (44,4 % des cas) ou à la fois intra- et extradural (7,4 % des cas). Les extensions de ces tumeurs aussi bien vers l’avant qu’en direction des angles pontocerébelleux ont dans la majorité des cas conduit à combiner les approches qui ont été multiples : transorale, trans-sphénoïdale, trans-faciale, antéro-latérale, voie de l’artère vertébrale, rétrosigmoide et abords du rachis antérieur et postérieur. On note une augmentation de l’utilisation de l’endoscope ces dix dernières années. En postopératoire, 8 enfants ont eu une trachéostomie et 4 une gastrostomie. Celles-ci ont toutes été transitoires avec des médianes de temps de 75 jours pour la trachéostomie (de 7 jours à 28 mois) et de 7 mois pour la gastrostomie (de 4 à 10 mois). Un traitement orthopédique par orthèse a concerné 8 enfants et 12 ont eu une ostéosynthèse. Parmi eux, 4 enfants ont eu les deux systèmes de contention.
21.2.2. Résultats histologiques Sur le plan histologique, 25 enfants avaient un chordome classique, 4 un chordome chondroïde et 2 atypiques/peu différenciés.
21.2.3. Traitements complémentaires La radiothérapie a été faite après une exérèse maximale (en un ou plusieurs temps) dont le but était de mettre à distance la tumeur résiduelle et le tronc cérébral et les structures vasculaires de proximité, afin de minimiser les séquelles de la radiothérapie. Tous les enfants ont été irradiés sauf 2 qui sont décédés avant l’irradiation. Deux enfants ont été traités par radiochirurgie, 10 par protonthérapie, 7 par irradiation aux photons et 10 par une combinaison photons/protons. Un seul patient a eu de la chimiothérapie associée à la radiothérapie en traitement adjuvant car le diagnostic initial avait été celui de neurinome malin. 21.2.4. Devenir Avec un suivi médian de 5,7 ans, la survie globale et la survie sans progression à 15 ans sont respectivement de 63 et 54,3 % (Fig. 57A et B). Durant le suivi, 11 enfants ont eu des progressions de résidu après la radiothérapie. Six ont été réopérés et 2 enfants sont toujours vivants. Trois enfants n’ont eu aucun traitement et sont décédés après une évolution rapide de la maladie et deux ont eu de la chimiothérapie, sans efficacité. Pour l’un d’eux, la chimiothérapie a été donnée pour une évolution pluri-métastatique. On note pour un enfant l’apparition d’une greffe de chordome au niveau abdominal après prélèvement de graisse faite avec les mêmes instruments que ceux utilisés pour l’exérèse. Il a été réopéré au niveau abdominal. On comptabilise 11 décès dans cette série : 2 enfants sont décédés avant même d’avoir rec¸u de la radiothérapie, tous les deux avaient des chordomes atypiques peu différenciés (un enfant est décédé en périopératoire et le second 4 mois après le diagnostic, en cours de chimiothérapie) ; les 9 autres enfants décédés ont comme point commun d’avoir eu une récidive après l’irradiation. Le fait de récidiver après radiothérapie est un facteur de mauvais pronostic puisque seulement 2 enfants sont vivants après récidive post radiothérapie. L’une a été réopérée puis réirradiée, avec un résidu stable depuis 10 ans, l’autre a été réopérée mais le recul est inférieur à 6 mois. 21.2.5. Facteurs pronostiques Il existe une relation statistiquement significative entre le type histologique et la survie sans récidive (p < 0,001, log rank) et la survie globale (p < 0,001, log rank), le plus mauvais pronostic étant lié aux formes atypiques/peu différenciées, le meilleur pour les formes classiques et un pronostic intermédiaire pour les formes chondroïdes (Fig. 58 A et B). L’analyse de la localisation (clivus, clivus étendu et rachis) retrouve une tendance sans que celle-ci soit statistiquement significative avec un meilleur pronostique pour les
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
69
Fig. 58. Survie sans progression (A) et survie globale (B) de la série de chordomes pédiatriques en fonction du type histologique Survival without progression (A) and global survival (B) for the series of paediatric chordoma as a function of their histology.
Fig. 59. Survie sans progression (A) et survie globale (B) de la série de chordomes pédiatriques en fonction de la qualité de l’exérèse. Survival without progression (A) and global survival (B) for the series of paediatric chordoma as a function of the type of excision.
clivus et un pronostic plus péjoratif pour les rachis. De même, on note une nette différence sur la survie globale pour les patients en exérèse complète avant radiothérapie versus ceux en exérèse incomplète (Fig. 59). Cependant, la différence n’est pas statistiquement significative du fait du petit nombre de patient en exérèse complète. Le sexe et l’âge au diagnostic (inferieur ou supérieur à la médiane) ne sont pas des facteurs pronostiques dans cette série. 22. Conclusions Nos connaissances sur les chordomes ont certes beaucoup progressé mais il reste encore de nombreuses questions auxquelles nous ne savons toujours pas répondre. Les entités notochordales sont multiples et sont maintenant mieux définies. L’immunohistologie (cytokératines et brachyurie) permet de différencier ce qui est dérivé de la notochorde de ce qui ne l’est pas en particulier les chondrosarcomes et les parachordomes. L’histoire naturelle de chaque chordome n’est pas prévisible. Il existe certainement des formes de chordomes très agressifs et d’autres qui le sont beaucoup moins mais il n’existe à ce jour aucun critère permettant de les différencier et donc aucun moyen d’adapter la stratégie thérapeutique en fonction de cette agressivité. La localisation semble avoir une certaine influence sur l’évolutivité tumorale avec un meilleur pronostic des chordomes de
la base du crâne et un moins bon pour ceux de la charnière craniocervicale. L’âge a peu d’influence hormis chez les rares chordomes de l’enfant de moins de 5 ans. Si l’on exclut les formes dédifférenciées, aucun critère histologique n’a de valeur pronostique et les formes chondroides n’ont pas une évolution plus favorable que les formes conventionnelles. L’exérèse complète, voire monobloc, réalisée en première intention, reste donc certainement le facteur pronostique principal. Plusieurs interventions utilisant différentes voies d’abord peuvent s’avérer nécessaires. En cas de récidive, cette exigence sur la qualité de l’exérèse paraît moins utile à moins qu’elle ne survienne que tardivement. Une exérèse aussi complète sera généralement moins facilement réalisable et les traitements complémentaires limités. L’adjonction d’une radiothérapie sous la forme de protons semble apporter un bénéfice sur l’absence de progression tumorale et sur la survie mais cela ne paraît pas certains pour tous les chordomes ; là encore manque un paramètre d’agressivité qui permettrait d’adapter la dose et sa répartition (zones hypoxiques) à chacun des chordomes. De grands espoirs peuvent être fondés sur la biologie moléculaire et la thérapie ciblée mais nous n’en sommes qu’aux débuts des essais thérapeutiques. Il semble que là encore il faudra apprendre à moduler ces traitements systémiques en fonction de chacun des chordomes.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 70
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
Déclaration d’intérêts Les auteurs déclarent ne pas avoir de conflits d’intérêts en relation avec cet article.
Références [1] Luschka H. Die Altersveranderungen der Zwischenwirbelknorpel. Virchows Arch (Path Anat) 1859;9:311–27. [2] Klebs E. Virchows Arch Path Anat 1864;31:396 [Cité par Wright D. 1967]. [3] Linck A. Beitr Path Anat 1909;46:573 [Cité par Wright D. 1967]. [4] Stewart MJ. Malignant sacrococcygeal chordome. J Pathol Bacteriol 1922;25:40–62. [5] Fabricius-Moller J. Hosp Italstidende 1919;62:849 [Cité par Wright D. 1967]. [6] Mabrey RE. Chordomas: a study of 150 cases. Amer J Cancer 1935;25:501 [Cité par Wright D. 1967]. [7] Harvey WF, Dawson EK. Edinb Med J 1941;48:713 [cité par Wright D. 1967]. [8] Faust DB, Gilmore HR, Mudgett CS, et al. Ann intern Med 1944;21:678 [Cité par Wright D. 1967]. [9] Utne JR, Pugh DG. The roentgenologic aspects of chordoma. Am J Roentgenol Radium Ther Nucl Med 1955;74(4):593–608. [10] Muller H. Ueber das Vorkommen von Resten der Chorda dorsalis bei Menschen nach der Geburt und uber ihr Verhaltniss zu den Gallertgeschwulsten am Clivus. Zeitschrift Ration Medic 1858;2:202–29. [11] Mosgrove J. Persistence of the notochord in the human subject. J Anat 1891;25:386–9. [12] Taylor JR. Persistence of the notochordal canal in vertebrae. J Anat 1972;111(Pt 2):211–7. [13] Cotten A, Deprez X, Lejeune JP, Chastanet P, Francke JP, Clarisse J. Persistence of the notochordal canal: plain film and CT findings. Neuroradiology 1995;37(4):308–10. [14] Christopherson LR, Rabin BM, Hallam DK, Russell EJ. Persistence of the notochordal canal: MR and plain film appearance. AJNR Am J Neuroradiol 1999;20(1):33–6. [15] Schmorl G. Über Chordaneste in den Wirbelkôrper. Zbl Chir 1928;37(55):2305–10. [16] Horwitz T. Chordal ectopia and its possible relationship to chordome. Arch Pathol 1941;31:354–62. [17] Spjut HJ, Luse SA. Chordoma: an electron microscopic study. Cancer 1964;17:643–56. [18] Ribbert H. Ueber die experimentelle Erzeugung einer Ecchondrosis physaliphora. Verh Dtsch Kongr Inn Med 1895;13:455–64. [19] Congdon CC. Proliferative lesions resembling chordoma following puncture of the nucleus pulposus in rabbits. J Natl Cancer Inst 1952;12:893–907. [20] Salisbury JR, Deverell MH, Cookson MJ, Whimster WF. Three dimensional reconstruction of human embryonic notochords: clue to the pathogenesis of chordoma. J Pathol 1993;171:59–62. [21] Peacok A. Observations on the postnatal structure of the intervertebral disc in man. J Anat 1952;86:162–79. [22] Ruggeri A. Ultrastructural histochemical and autoradiographic studies on the develoing chick notochord. Zeitschrift fur Anatomie und Entwicklungsgeschichte 1972;138:20–33. [23] Choi H. Response evaluation of gastrointestinal stromal tumors. Oncologist 2008;13(Suppl. 2):4–7. [24] Choi KS, Cohn MJ, Harfe BD. Identification of nucleus pulposus precursor cells and notochordal remnants in the mouse: implications for disk degeneration and chordoma formation. Dev Dyn 2008;237(12):3953–8. [25] Cappell DF. Chordoma of the vertebral column with three new cases. J Pathol Bact 1928;31:797–814. [26] Huber GC. On the relation of the corda dorsalis to the anlage of the pharyngeal bursa or median pharyngeal recess. Anat Rec 1912;6:373–404. [27] Linck A. Anat Hefte 1911;42:605 [Cité par Wright D. 1967]. [28] Bérard L, Dunet C, Peyron A. Les chordomes de la région sacrococcygienne et leur histogenèse. Bull Assoc Fr Etud Cancer 1922;11:28–66. [29] Leroux-Robert J, De Brux J. Chordomes craniaux-cervicaux (à propos de 4 nouveaux cas). Ann Otolaryngol 1962;79:663–79. [30] Ribbert H, Steiner H. Uber die Ecchondrosis physaliphora sphenooccipitalis. Zentralbl Allg Pathol Anat 1894;5:457–61. [31] Steward M, Burrow F. Ecchordosis physaliphora spheno-occipitalis. J Neurol Psychopathol 1923;4(15):218–20. [32] Wyatt RB, Schochet Jr SS, McCormick WF. Ecchordosis physaliphora. An electron microscopic study. J Neurosurg 1971;34(5):672–7. [33] Mehnert F, Beschorner R, Küker W, Hahn U, Nägele T. Retroclival ecchordosis physaliphora: MR imaging and review of the literature. AJNR Am J Neuroradiol 2004;25(10):1851–5. [34] Stam FC, Kamphorst W. Ecchordosis physaliphora as a cause of fatal pontine hemorrhage. Eur Neurol 1982;21(2):90–3. [35] Macdonald RL, Cusimano MD, Deck JH, Gullane PJ, Dolan EJ. Cerebrospinal fluid fistula secondary to ecchordosis physaliphora. Neurosurgery 1990;26(3):515–8 [discussion 518–9]. [36] Alli A, Clark M, Mansell NJ. Cerebrospinal fluid rhinorrhea secondary to ecchordosis physaliphora. Skull Base 2008;18(6):395–9.
[37] Feng K, Qiuhang Z, Qiuyi Q, et al. Transclival cerebrospinal fluid rhinorrhea as the initial presenting symptom of a tiny intradural chordoma. J Clin Neurosci 2010;17(8):1083–5. [38] Akimoto J, Takeda H, Hashimoto T, Haraoka J, Ito H. [A surgical case of ecchordosis physaliphora]. No Shinkei Geka 1996;24(11):1021–5. [39] Toda H, Kondo A, Iwasaki K. Neuroradiological characteristics of ecchordosis physaliphora. Case report and review of the literature. J Neurosurg 1998;89(5):830–4. [40] Ng SH, Ko SF, Wan YL, Tang LM, Ho YS. Cervical ecchordosis physaliphora: CT and MR features. Br J Radiol 1998;71(843):329–31. [41] Cha ST, Jarrahy R, Yong WH, Eby T, Shahinian HK. A rare symptomatic presentation of ecchordosis physaliphora and unique endoscope-assisted surgical management. Minim Invasive Neurosurg 2002;45(1):36–40. [42] Takeyama J, Hayashi T, Shirane R. Notochordal remnant-derived mass: ecchordosis physaliphora or chordoma? Pathology 2006;38(6): 599–600. [43] Ling SS, Sader C, Robbins P, Rajan GP. A case of giant ecchordosis physaliphora: a case report and literature review. Otol Neurotol 2007;28(7):931–3. [44] Fracasso T, Brinkmann B, Paulus W. Sudden death due to subarachnoid bleeding from ecchordosis physaliphora. Int J Legal Med 2008;122(3):225–7. [45] Rotondo M, Natale M, Mirone G, Cirillo M, Conforti R, Scuotto A. A rare symptomatic presentation of ecchordosis physaliphora: neuroradiological and surgical management. J Neurol Neurosurg Psychiatry 2007;78(6):647–9. [46] Alkan O, Yildirim T, Kizilkilic¸ O, Tan M, Cekinmez M. A case of ecchordosis physaliphora presenting with an intratumoral hemorrhage. Turk Neurosurg 2009;19(3):293–6. [47] Tashiro T, Fukuda T, Inoue Y, Nemoto Y, Shakudo M, Katsuyama J, et al. Intradural chordoma: case report and review of the literature. Neuroradiology 1994;36(4):313–5. [48] Mapstone TB, Kaufman B, Ratcheson RA. Intradural chordoma without bone involvement: nuclear magnetic resonance (NMR) appearance. Case report. J Neurosurg 1983;59(3):535–7. [49] Bergmann M, Abdalla Y, Neubauer U, Schildhaus HU, Probst-Cousin S. Primary intradural chordoma: report on three cases and review of the literature. Clin Neuropathol 2010;29(3):169–76. [50] Jiagang L, Yanhui L, Xueying S, Qing M. Intradural suprasellar chondroïd chordoma. J Clin Neurosci 2010;17:402–3. [51] Jiagang L, Yanhui L, Xueying S, Qing M. Intradural suprasellar chondroid chordoma. J Clin Neurosci 2010;17(3):402–3 [Epub 2010 Jan 13]. [52] Ito E, Saito K, Nagatani T, Ishiyama J, Terada K, Yoshida M, et al. Intradural cranial chordoma. World Neurosurg 2010;73(3):194–7. [53] Ciarpaglini R, Pasquini E, Mazzatenta D, Ambrosini-Spaltro A, Sciarretta V, Frank G. Intradural clival chordoma and ecchordosis physaliphora: a challenging differential diagnosis: case report. Neurosurgery 2009;64(2):E387–8 [discussion E388]. [54] Ramiro J, Ferreras B, Pérez Calvo JM, Zafra A. Thoracic intradural chordoma. Surg Neurol 1986;26(6):571–2. [55] Vaz RM, Pereira JC, Ramos U, Cruz CR. Intradural cervical chordoma without bone involvement. Case report. J Neurosurg 1995;82(4):650–3. [56] Gelabert-González M, Pintos-Martínez E, Caparrini-Escondrillas A, MartínezRumbo R. Intradural cervical chordoma. Case report. J Neurosurg Sci 1999;43(2):159–62. [57] Chang SW, Gore PA, Nakaji P, Rekate HL. Juvenile intradural chordoma: case report. Neurosurgery 2008;62(2):E525–6. [58] Kimmell KT, Dayoub H, Stolzenberg ED, Sincoff EH. Chordoma in the lateral medullary cistern in a patient with tuberous sclerosis: a case report and review of the literature. Surg Neurol Int 2010;1:13. [59] Bhat DI, Yasha M, Rojin A, Sampath S, Shankar SK. Intradural clival chordoma: a rare pathological entity. J Neurooncol 2010;96(2):287–90. [60] Ito E, Saito K, Okada T, Nagatani T, Nagasaka T. Long-term control of clival chordoma with initial aggressive surgical resection and gamma knife radiosurgery for recurrence. Acta Neurochir (Wien) 2010;152(1):57–67, discussion 67. [61] Bergmann M, et al. Primary intradural chordoma: report on three cases and review of the literature. Clin Neuropathol 2010;29(3):169–76. [62] Kim SK, Kim YH, Park CK, Kim MA, Park SH. Intracranial intradural chordoma presenting with intraventricular hemorrhage. Clin Neurol Neurosurg 2012;114(8):1189–92. [63] Barresi V, Caffo M, Alafaci C, Granata F, Tuccari G. Intradural chordoma of the Meckel’s cave: a challenging differential diagnosis. Neuropathology 2012;32(5):577–82. [64] Dahlin DC, Maccarty CS. Chordoma. Cancer 1952;5(6):1170–8. [65] Bartolini G. [Chordoma of the clivus as a cause of cerebral hemorrhage: anatomoclinical discussion of an autopsied case]. Boll Soc Ital Biol Sper 1974;50(12):912–8. [66] Mathews W, Wilson CB. Ectopic intrasellar chordoma. Case report. J Neurosurg 1974;40(2):260–3. [67] Vaquero J, Martinez R, Rossi E, Bravo G. Chordoma. Neurosurgery 1983;13(6):737–8. [68] Yuhi F, Asakura T, Tomosugi T, Kusumoto K, Awa H, Uetsuhara KA. Case of clival chordoma without bone destruction. No Shinkei Geka 1986;14(4):547–52. [69] Wolfe 3rd JT, Scheithauer BW. “Intradural Chordoma” or “Giant Ecchordosis Physaliphora”? Report of two cases. Clin Neuropathol 1987;6(3):98–103. [70] Katayama Y, Tsubokawa T, Hirasawa T, Takahata T, Nemoto N. Intradural extraosseous chordoma in the foramen magnum region. Case report. J Neurosurg 1991;75(6):976–9 [Review].
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
[71] Hardie RC. Magnetic resonance appearance of a rare intradural chordoma. Wis Med J 1992;91(11):627–8. [72] Wanibuchi M, Uede T, Ishiguro M, Tatewaki K, Kurokawa Y, Yoshida Y. A Case of suprasellar intradural chordoma. No Shinkei Geka 1994;22(3):269–72. [73] Nishigaya K, Kaneko M, Ohashi Y, Nukui H. Intradural retroclival chordoma without bone involvement: no tumor regrowth 5 years after operation. Case report. J Neurosurg 1998;88(4):764–8. [74] Korinth M, Schönrock L, Mayfrank L. Zentralbl Neurochir 1999;60(3):146–50. [75] Danilewicz B, Danilewicz M, Czepko R, Stachura K. Intradural clivus chordoma: surgical treatment with no tumor regrowth 12 years after surgery. Przegl Lek 2000;57(3):178–80. [76] Masui K, Kawai S, Yonezawa T, Fujimoto K, Nishi N. Intradural retroclival chordoma without bone involvement – case report. Neurol Med Chir (Tokyo) 2006;46(11):552–5. [77] Roberti F, Sekhar LN, Jones RV, Wright DC. Intradural cranial chordoma: a rare presentation of an uncommon tumor. Surgical experience and review of the literature. J Neurosurg 2007;106(2):270–4. [78] Warnick RE, Raisanen J, Kaczmar Jr T, Davis RL, Prados MD. Intradural chordoma of the tentorium cerebelli. Case report. J Neurosurg 1991;74(3): 508–11. [79] Commins D, Baran GA, Molleston M, Vollmer D. Hypothalamic chordoma. Case report. J Neurosurg 1994;81(1):130–2. [80] Dow GR, Robson DK, Jaspan T, Punt JA. Intradural cerebellar chordoma in a child: a case report and review of the literature. Childs Nerv Syst 2003;19(3):188–91. [81] Figueiredo EG, Tavares WM, Welling L, Rosemberg S, Teixeira MJ, et al. Ectopic pineal chordoma. Surg Neurol Int 2011;2:145. [82] Kyriakos M, Totty WG, Lenke LG. Giant vertebral notochordal rest: a lesion distinct from chordoma: discussion of an evolving concept. Am J Surg Pathol 2003;27(3):396–406. [83] Yamaguchi T, Yamato M, Saotome K. First histologically confirmed case of a classic chordoma arising in a precursor benign notochordal lesion: differential diagnosis of benign and malignant notochordal lesions. Skeletal Radiol 2002;31(7):413–8. [84] Ulich TR, Mirra JM. Ecchordosis physaliphora vertebralis. Clin Orthop Relat Res 1982;(163):282–9. [85] Yamaguchi T, Suzuki S, Ishiiwa H, Shimizu K, Ueda Y. Benign notochordal cell tumors: a comparative histological study of benign notochordal cell tumors, classic chordomas, and notochordal vestiges of fetal intervertebral discs. Am J Surg Pathol 2004;28(6):756–61. [86] Yamaguchi T, Suzuki S, Ishiiwa H, Ueda Y. Intraosseous benign notochordal cell tumours: overlooked precursors of classic chordomas? Histopathology 2004;44(6):597–602. [87] Darby AJ, Cassar-Pullicino VN, McCall IW, Jaffray DC. Vertebral intra-osseous chordoma or giant notochordal rest? Skeletal Radiol 1999;28(6):342–6. [88] Mirra JM, Brien EW. Giant notochordal hamartoma of intraosseous origin: a newly reported benign entity to be distinguished from chordoma. Report of two cases. Skeletal Radiol 2001;30(12):698–709. [89] Haasper C, Länger F, Rosenthal H, Knobloch K, Mössinger E, Krettek C, et al. Coccydynia due to a benign notochordal cell tumor. Spine (Phila Pa 1976) 2007;32(14):E394–6. [90] Yamaguchi T, Iwata J, Sugihara S, McCarthy Jr EF, Karita M, Murakami H, et al. Distinguishing benign notochordal cell tumors from vertebral chordoma. Skeletal Radiol 2008;37(4):291–9. [91] Deshpande V, Nielsen GP, Rosenthal DI, Rosenberg AE. Intraosseous benign notochord cell tumors (BNCT): further evidence supporting a relationship to chordoma. Am J Surg Pathol 2007;31(10):1573–7. [92] Yamaguchi T, Watanabe-Ishiiwa H, Suzuki S, Igarashi Y, Ueda Y. Incipient chordoma: a report of two cases of early-stage chordoma arising from benign notochordal cell tumors. Mod Pathol 2005;18(7):1005–10. [93] Nishiguchi T, Mochizuki K, Tsujio T, Nishita T, Inoue Y. Lumbar vertebral chordoma arising from an intraosseous benign notochordal cell tumour: radiological findings and histopathological description with a good clinical outcome. Br J Radiol 2010;83(987):e49–53. [94] Götz W, Kasper M, Fischer G, Herken R. Intermediate filament typing of the human embryonic and fetal notochord. Cell Tissue Res 1995;280(2):455–62. [95] Wang TJ, Shu SH, Lin CW, Chen LF, Lin TC, Chang Chien HS, et al. Thoracic chordoma: an unusual presentation of the spinal tumor. Am J Med Sci 2008;335(3):239–41. [96] Laskowski J. Pathology of tumors. In: Kolodziejska H, editor. Zarys Onkologii. Pzwl: Varsaw; 1955. p. 91–9. [97] Dabska M. Parachordoma: a new clinicopathologic entity. Cancer 1977;40(4):1586–92. [98] Ishida T, Oda H, Oka T, Imamura T, Machinami R. Parachordoma: an ultrastructural and immunohistochemical study. Virchows Arch A Pathol Anat Histopathol 1993;422(3):239–45. [99] Van Akkooi AC, Van Geel AN, Bessems JH, Den Bakker MA. Extra-axial chordoma. J Bone Joint Surg Br 2006;88(9):1232–4. [100] Clabeaux J, Hojnowski L, Valente A. Case report: parachordoma of soft tissues of the arm. Clin Orthop Relat Res 2008;466(5):1251–6. [101] Park SY, Kim SR, Choe YH, Lee KY, Park SJ, Lee HB, et al. Extra-axial chordoma presenting as a lung mass. Respiration 2009;77(2):219–23. [102] Strano S, Ouafi L, Baud M, Alifano M. Primary chordoma of the lung. Ann Thorac Surg 2010;89(1):302–3. [103] Shibuya J, Ichinose T, Kimitsuka G. Chordoma which was found as a solitary lung tumor. Kyobu Geka 2010;63(2):138–41.
71
[104] Kikuchi Y, Yamaguchi T, Kishi H, Azuhata K, Kimizuka G, Hiroshima K, et al. Pulmonary tumor with notochordal differentiation: report of 2 cases suggestive of benign notochordal cell tumor of extraosseous origin. Am J Surg Pathol 2011;35(8):1158–64. [105] Suster S, Moran CA. Chordomas of the mediastinum: clinicopathologic, immunohistochemical, and ultrastructural study of six cases presenting as posterior mediastinal masses. Hum Pathol 1995;26(12):1354–62. [106] Huang SM, Chen CC, Chiu PC, Lai PH, Ho JT, Tseng HH. Unusual presentation of posterior mediastinal chordoma in a 2-year-old boy. J Pediatr Hematol Oncol 2003;25(9):743–6. [107] Notsute D, Maruta K, Tanaka R, Yamaguchi E, Takahashi T, Ito K, et al. A case of primary posterior mediastinal chordoma. Nihon Kokyuki Gakkai Zasshi 2009;47(2):168–74. [108] Spivach A, Zanconati F, Tirabosco R, Falconieri G. Parachordoma of the gastric serosa: report of a myxoid mimicry in an unusual location. Int J Surg Pathol 2007;15(3):307–10. [109] Difrancesco LM, Davanzo Castillo CA, Temple WJ. Extra-axial chordoma. Arch Pathol Lab Med 2006;130(12):1871–4. [110] Sebag G, Dubois J, Beniaminovitz A, Lelouch-Tubiana A, Brunelle F. Extraosseous spinal chordoma: radiographic appearance. Ajnr Am J Neuroradiol 1993;14(1):205–7. [111] Las Heras F, Pritzker KP, Colgan TJ. Chordoma arising in a mature cystic teratoma of the ovary: a case report. Pathol Res Pract 2007;203(6):467–71 [Epub 2007 Apr 6]. [112] Riopelle JL. Teratoma of the ovary, with a segment of vertebral column and remnants of notochordal tissue: report of a case. Am J Pathol 1940;16(5):625–34. [113] Abe S, Imamura T, Harasawa A, Ishida T, Unno K, Tateishi A, et al. Parachordoma with multiple metastases. J Comput Assist Tomogr 2003;27(4):634–8. [114] Kinoshita G, Yasoshima H. Case report: fatal parachordoma. J Orthop Sci 2007;12:101–6. [115] Carstens PH. Chordoid tumor: a light, electron microscopic, and immunohistochemical study. Ultrastruct Pathol 1995;19(4):291–5. [116] De Comas AM, Penfornis P, Harris MR, Meyer MS, Pochampally RR. Derivation and characterization of an extra-axial chordoma cell line (each-1) from a scapular tumor. J Bone Joint Surg Am 2010;92(5):1231–40. [117] Suzuki H, Yamashiro K, Takeda H, Nojima T, Usui M. Extra-axial soft tissue chordoma of wrist. Pathol Res Pract 2011;207(5):327–31. [118] Miettinen M, Gannon FH, Lackman R. Chordomalike soft tissue sarcoma in the leg: a light and electron microscopic and immunohistochemical study. Ultrastruct Pathol 1992;16(5):577–86. [119] Limon J, Babinska M, Denis A, Rys J, Niezabitowski A. Parachordoma: a rare sarcoma with clonal chromosomal changes. Cancer Genet Cytogenet 1998;102(1):78–80. [120] Tirabosco R, Mangham DC, Rosenberg AE, Vujovic S, Bousdras K, Pizzolitto S, et al. Brachyury expression in extra-axial skeletal and soft tissue Chordomas: a marker that distinguishes chordoma from mixed tumor/Myoepithelioma/Parachordoma in soft tissue. Am J Surg Pathol 2008;32(4):572–80. [121] Kilpatrick SE, Limon J. Mixed Tumour/Myoepithelium/Parachordoma. In: Fischer CD, Unni KK, Mertens F, editors. World Health Organization classification of tumours: pathology and genetics of tumour of soft tissue and bone. Lyon France: Iarc Press; 2002. p. 198–9. [122] Eimoto T, Hashimoto K. Vacuolated meningioma. A light and electron microscopic study. Acta Pathol Jpn 1977;27(4):557–66. [123] Dahmen HG. Studies on mucous substances in myxomatous meningiomas. Acta Neuropathol (Berl) 1979;48:235–7. [124] Connors MH. Growth and maturation arrest, hypochromic anemia and hyperglobulinemia associated with a brain tumor. West J Med 1980;133: 160–3. [125] Kepes JJ, Chen WY, Connors MH, Vogel FS. “Chordoid” meningeal tumors in young individuals with peritumoral lymphoplasmacellular infiltrates causing systemic manifestations of the castleman syndrome. A report of seven cases. Cancer 1988;62(2):391–406. [126] Couce ME, Aker FV, Scheithauer BW. Chordoid meningioma: a clinicopathologic study of 42 cases. Am J Surg Pathol 2000;24(7):899–905. [127] Epari S, Sharma MC, Sarkar C, Garg A, Gupta A, Mehta VS. Chordoid meningioma. An uncommon variant of meningioma: a clinicopathologic study of 12 cases. J Neurooncol 2006;78(3):263–9. [128] Civit T, Taillandier L, Baylac F. Chordoid meningioma. J Neurosurg 1998;89(4):686–7. [129] Kozler P, Benes V, Netuka D, Kramár F, Hrabal P, Charvát F. Chordoid meningioma: presentation of two case reports, review of the literature, and plea for data standardisation. J Neurooncol 2008;88(1):115–20. [130] Nambiar A, Pillai A, Parmar C, Panikar D. Intraventricular chordoid meningioma in a child: fever of unknown origin, clinical course, and response to treatment. J Neurosurg Pediatr 2012;10(6):478–81. [131] Wilson JL, Ellis TL, Mott RT. Chordoid meningioma of the third ventricle: a case report and review of the literature. Clin Neuropathol 2011;30(2):70–4. [132] Hayashi T, Haba R, Kushida Y, Kadota K, Katsuki N, Bando K, et al. Cytopathologic features of orbital intraosseous chordoid meningioma: report of a case and distinction from other myxoid/mucoid tumors. Diagn Cytopathol 2010;38(11):818–21. [133] Zhao SL, Li Y, Tian XY, Li Z, Huang Q, Li B. Intraparenchymal cystic chordoid meningioma: a case report and review of the literature. Neuropathology 2011;31(6):648–53.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 72
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
[134] Xi S, Zhang Y, Lin S, Liang J, Zeng J, Wu Q. Intraparenchymal chordoid meningioma: a case report and review of the literature. Int J Surg Pathol 2012;20(6):600–5. ˜ [135] Rowsell C, Sirbovan J, Rosenblum MK, Perez-Ordonez B. Primary chordoid meningioma of lung. Virchows Arch 2005;446(3):333–7. [136] Tena-Suck ML, Collado-Ortìz MA, Salinas-Lara C, García-López R, Gelista N, Rembao-Bojorquez D. Chordoid Meningioma: a report of ten cases. J Neurooncol 2010;99(1):41–8. [137] Wanschitz J, Schmidbauer M, Maier H, Rossler K, Vorkapic P, Budka H. Suprasellar Meningioma with expression of glial fibrillary acidic protein: a peculiar variant. Acta Neuropathol 1995;90:539–44. [138] Brat DJ, Scheithauer BW, Staugaitis SM, Cortez SC, Brecher K, Burger PC. Third ventricular chordoid glioma: a distinct clinicopathologic entity. J Neuropathol Exp Neurol 1998;57(3):283–90. [139] Kurian KM, Summers DM, Statham PF, Smith C, Bell JE, Ironside JW. Third ventricular chordoid glioma: clinicopathological study of two cases with evidence for a poor clinical outcome despite low-grade histological features. Neuropathol Appl Neurobiol 2005;31(4):354–61. [140] Buccoliero AM, Caldarella A, Gallina P, Di Lorenzo N, Taddei A, Taddei GL. Chordoid glioma: clinicopathologic profile and differential diagnosis of an uncommon tumor. Arch Pathol Lab Med 2004;128(11):E141–5. [141] Ricoy JR, Lobato RD, Baez B, Cabello A, Martinez MA, Rodriguez G. Suprasellar chordoid glioma. Acta Neuropathol 2000;99:699–703. [142] Pasquier B, Peoc’h M, Morrison AL, Gay E, Pasquier D, Grand S, et al. Chordoid glioma of the third ventricle - a report of two new cases, with further evidence supporting an ependymal differentiation, and review of literature. Am J Surg Path 2002;26:1330–42. [143] Yang C, Schwab JH, Schoenfeld AJ, Hornicek FJ, Wood KB, Nielsen GP, et al. A novel target for treatment of chordoma: signal transducers and activators of transcription 3. Mol Cancer Ther 2009;8(9):2597–605. [144] Yang XR, Ng D, Alcorta DA, Liebsch NJ, Sheridan E, Li S, et al. T (Brachyury) gene duplication confers major susceptibility to familial chordoma. Nat Genet 2009;41(11):1176–8. [145] Vujovic S, Henderson S, Presneau N, Odell E, Jacques TS, Tirabosco R, et al. Brachyury, a crucial regulator of notochordal development, is a novel biomarker for chordomas. J Pathol 2006;209(2):157–65. [146] Jambhekar NA, Rekhi B, Thorat K, Dikshit R, Agrawal M, Puri A. Revisiting Chordoma with brachyury, a “New Age” marker: analysis of a validation study on 51 cases. Arch Pathol Lab Med 2010;134(8):1181–7. [147] Oakley GJ, Fuhrer K, Seethala RR. Brachyury, Sox-9, and Podoplanin, new markers in the skull base chordoma vs chondrosarcoma differential: a tissue microarray-based comparative analysis. Mod Pathol 2008;21(12):1461–9. [148] Kyriakos M. Benign notochordal lesions of the axial skeleton: a review and current appraisal. Skeletal Radiol 2011;40(9):1141–52. [149] Shen J, Li CD, Yang HL, Lu J, Zou TM, Wang DL, et al. Classic chordoma coexisting with benign notochordal cell rest demonstrating different immunohistological expression patterns of Brachyury and Galectin-3. J Clin Neurosci 2011;18(1):96–9. [150] Palena C, Polev DE, Tsang KY, et al. The human T-Box mesodermal transcription factor Brachyury is a candidate target for T-Cell-mediated cancer immunotherapy. Clin Cancer Res 2007;13:2471–8. [151] Sangoi AR, Karamchandani J, Lane B, Higgins JP, Rouse RV, Brooks JD, et al. Specificity of Brachyury in the distinction of chordoma from clear cell renal cell carcinoma and germ cell tumors: a study of 305 cases. Mod Pathol 2011;24(3):425–9. [152] Hsu W, Mohyeldin A, Shah SR, Ap Rhys CM, Johnson LF, Sedora-Roman NI, et al. Generation of chordoma cell line Jhc7 and the identification of brachyury as a novel molecular target. J Neurosurg 2011;115(4):760–9. [153] Presneau N, Shalaby A, Ye H, Pillay N, Halai D, Idowu B, et al. Role of the transcription factor T (Brachyury) in the pathogenesis of sporadic chordoma: a genetic and functional-based study. J Pathol 2011;223(3):327–35. [154] Yasuda M, Bresson D, Chibbaro S, Cornelius JF, Polivka M, Feuvret L, et al. Chordomas of the skull base and cervical spine: clinical outcomes associated with a multimodal surgical resection combined with proton-beam radiation in 40 patients. Neurosurg Rev 2012;35(2):171–82 [discussion 182–3]. [155] Holton JL, Steel T, Luxsuwong M, Crockard HA, Revesz T. Skull base chordomas: correlation of tumour doubling time with age, mitosis and Ki67 proliferation index. Neuropathol Appl Neurobiol 2000;26(6):497–503. [156] Lin JW, Lu CH, Lin WC, Wu YT, Huang YJ, Shih FY, et al. A clinicopathological study of the significance of the proportion of choroid morphology in chordoid meningioma. J Clin Neurosci 2012;19(6):836–43. [157] Vanhauwaert DJ, Clement F, Van Dorpe J, Deruytter MJ. Chordoid glioma of the third ventricle. Acta Neurochir (Wien) 2008;150(11):1183–91. [158] Gupta R, Rishi A, Suri V, Sharma MC, Gupta A, Garg A, et al. Sacral myxopapillary ependymoma with extensive osteolysis. J Neurooncol 2008;86(3):349–52. [159] Lee KJ, Min BW, Seo HJ, Cho CH. Subcutaneous sacrococcygeal myxopapillary ependymoma in asian female: a case report. J Clin Med Res 2012;4(1):61–3. [160] Lauer SR, Edgar MA, Gardner JM, Sebastian A, Weiss SW. Soft tissue chordomas: a clinicopathologic analysis of 11 cases. Am J Surg Pathol 2013;37(5):719–26. [161] Rekhi B, Sable M, Jambhekar NA. Virchows histopathological, immunohistochemical and molecular spectrum of myoepithelial tumours of soft tissues. Arch 2012;461(6):687–97. [162] Erdem E, et al. Comprehensive review of intracranial chordoma. Radiographics 2003;23(4):995–1009.
[163] Meyers SP, et al. Chordomas of the skull base: MR features. AJNR Am J Neuroradiol 1992;13(6):1627–36. [164] Goel A. Chordoma and chondrosarcoma: relationship to the internal carotid artery. Acta Neurochir (Wien) 1995;133(1–2):30–5. [165] Chisholm EJ, et al. Fused CT and angiography image guided surgery for endoscopic skull base procedures: how we do it. Clin Otolaryngol 2008;33(6):625–8. [166] Hwang PY, Ho CL. Neuronavigation using an image-guided endoscopic transnasal-sphenoethmoidal approach to clival chordomas. Neurosurgery 2007;61(5 Suppl. 2):212–7 [discussion 217–8]. [167] Sze G, et al. Chordomas: MR imaging. Radiology 1988;166(1 Pt 1):187–91. [168] Ikushima I, et al. Chordomas of the skull base: dynamic MRI. J Comput Assist Tomogr 1996;20(4):547–50. [169] Mohanty PP, et al. Primary chondroid chordoma of the petrous part of the temporal bone. Clin Oncol (R Coll Radiol) 2003;15(6):365–6. [170] Ginat DT, et al. Diffusion-weighted imaging for differentiating benign from malignant skull lesions and correlation with cell density. AJR Am J Roentgenol 2012;198(6):W597–601. [171] Ahmed SK, Murata H, Draf W. Clivus chordoma: is it enough to image the primary site? Skull Base 2010;20(2):111–3. [172] Eisen MD, et al. Use of preoperative MR to predict dural, perineural, and venous sinus invasion of skull base tumors. AJNR Am J Neuroradiol 1996;17(10):1937–45. [173] Fischbein NJ, Kaplan MJ, Holliday RA, Dillon WP. Recurrence of clival chordoma along the surgical pathway. AJNR Am J Neuroradiol 2000;21(3):578–83. [174] McPherson CM, Suki D, McCutcheon IE, Gokaslan ZL, Rhines LD, Mendel E. Metastatic disease from spinal chordoma: a 10-year experience. J Neurosurg Spine 2006;5(4):277–80. [175] Curtin HD, Chavali R. Imaging of the skull base. Radiol Clin North Am 1998;36(5):801–17, v-vi. [176] Nishiguchi T, et al. Differentiating benign notochordal cell tumors from chordomas: radiographic features on MRI, CT, and tomography. AJR Am J Roentgenol 2011;196(3):644–50. [177] Almefty K, Pravdenkova S, Colli BO, Al-Mefty O, Gokden M. Chordoma and chondrosarcoma: similar, but quite different, skull base tumors. Cancer 2007;110(11):2457–67. [178] Rosenberg AE, et al. Chondrosarcoma of the base of the skull: a clinicopathologic study of 200 cases with emphasis on its distinction from chordoma. Am J Surg Pathol 1999;23(11):1370–8. [179] Yeom KW, et al. Diffusion-Weighted MRI: distinction of skull base chordoma from chondrosarcoma. AJNR Am J Neuroradiol 2013;34(5):1056–61. [180] Neves F, et al. Head and neck paragangliomas: value of contrast-enhanced 3D MR angiography. AJNR Am J Neuroradiol 2008;29(5):883–9. [181] Gupta R, Khurana N, Singh S, Meher R. Primary chordoma of the nasal cavity: a rare site of presentation. Pathology 2007;39(2):273–5. [182] Yan ZY, Yang BT, Wang ZC, Xian JF, Li M. Primary chordoma in the nasal cavity and nasopharynx: CT and MR imaging findings. Ajnr Am J Neuroradiol 2010;31(2):246–50. [183] Dwivedi RC, Ojha BK, Mishra A, Youssefi P, Thway K, Hassan MS, et al. A rare case of jugular foramen chordoma with an unusual extension. Arch Otolaryngol Head Neck Surg 2011;137(5):513–6. [184] Lipper MH, Cail WS. Chordoma of the petrous bone. South Med J 1991;84(5):629–31. [185] Gerber S, et al. Imaging of sacral tumours. Skeletal Radiol 2008;37(4):277–89. [186] Thornton E, et al. Imaging features of primary and secondary malignant tumours of the sacrum. Br J Radiol 2012;85(1011):279–86. [187] Farsad K, et al. Sacral chordoma. Radiographics 2009;29(5):1525–30. [188] Deprez FC, Van Ruyssevelt C. MRI features of sacrococcygeal chordoma. JBRBTR 2009;92(5):262. [189] Martin C, McCarthy EF. Giant cell tumor of the sacrum and spine: series of 23 cases and a review of the literature. Iowa Orthop J 2010;30:69–75. [190] Shors SM, et al. Best cases from the AFIP: myxopapillary ependymoma of the sacrum. Radiographics 2006;26(Suppl 1):S111–6. [191] Sciubba DM, et al. Chordoma of the spinal column. Neurosurg Clin N Am 2008;19(1):5–15. [192] Smolders D, Wang X, Drevelengas A, Vanhoenacker F, De Schepper AM. Value of MRI in the diagnosis of non-clival, non-sacral chordoma. Skeletal Radiol 2003;32(6):343–50 [Epub 2003 Apr 26]. [193] Sartoretti-Schefer S, et al. Lumbar vertebral chordoma: diffusion-weighted imaging findings are helpful to narrow the differential diagnosis. A case report. Clin Imaging 2013;37(1):176–9. [194] Rodallec MH, et al. Diagnostic imaging of solitary tumors of the spine: what to do and say. Radiographics 2008;28(4):1019–41. [195] Laredo JD, Morvan G, Wybier M. Imagerie ostéo-articulaire. Paris: Flammarion; 1998. [196] Alexander J, et al. Vertebral hemangioma: an important differential in the evaluation of locally aggressive spinal lesions. Spine (Phila Pa 1976) 2010;35(18):E917–20. [197] Shankar J, et al. The usefulness of CT perfusion in differentiation between neoplastic and tuberculous disease of the spine. J Neuroimaging 2009;19(2):132–8. [198] Kendall BE. Cranial chordomas. Br J Radiol 1977;50(598):687–98. [199] Casali PG, Messina A, Stacchiotti S, Tamborini E, Crippa F, Gronchi A, et al. Imatinib mesylate in chordoma. Cancer 2004;101(9):2086–97. [200] Ma XM, Blenis J. Molecular mechanisms of mTOR-mediated translational control. Nat Rev Mol Cell Biol 2009;10:307–18.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
[201] McMaster ML, Goldstein AM, Parry DM. Clinical features distinguish childhood chordoma associated with tuberous sclerosis complex (TSC) from chordoma in the general paediatric population. J Med Genet 2011;48(7):444–9. [202] Franz DN, Leonard J, Tudor C, Chuck G, Care M, Sethuraman G, et al. Rapamycin causes regression of astrocytomas in tuberous sclerosis complex. Ann Neurol 2006;59(3):490–8. [203] Ranger A, Szymczak A. Do intracranial neoplasms differ in ollier disease and maffucci syndrome? an in-depth analysis of the literature. Neurosurgery 2009;65(6):1106–13 [discussion 1113–5. Review]. [204] Liu J, Hudkins PG, Swee RG, Unni KK. Bone sarcomas associated with Ollier’s disease. Cancer 1987;59(7):1376–85. [205] Weber W, Scott RJ. Case report: familial gastric cancer and chordoma in the same family. Hered Cancer Clin Pract 2005;3(2):81–4. [206] De Jesús-Monge WE, Torres EA, Báez VM, De Jesús O, Rivera L, GonzálezKeelan C. Crohn’s disease associated to chordoma: a case report. P R Health Sci J 2004;23(3):233–6. [207] Li ZS, Wei MQ, Fu X, Cheng H, Li Q. Chordoma coexisting with rathke’s cleft cyst: case report and literature review. Neuropathology 2011;31(1):66–70. [208] Arita-Melzer O, Medina H, Borsotto G, Gamboa A, Larriva-Sahd J, Trejo G, et al. An ectopic adrenocorticotropic hormone syndrome caused by a sacrococcygeal chordoma: report of a case with a slow progression. Endocr Pract 1998;4(1):37–40. [209] Lohman BD, Sarikaya B, McKinney AM, Hadi M. Not the typical Tornwaldt’s cyst this time? A nasopharyngeal cyst associated with canalis basilaris medianus. Br J Radiol 2011;84(1005):e169–71. [210] Wright D. Nasopharyngeal and cervical chordoma–some aspects of their development and treatment. J Laryngol Otol 1967;81(12):1337–55. [211] Batsakis JG, Kittleson AC. Chordomas: otorhinolaryngologic presentation and diagnosis. Arch Otolaryngol 1963;78:168–75. [212] Richter Jr HJ, Batsakis JG, Boles R. Chordomas: nasopharyngeal presentation and atypical long survival. Ann Otol Rhinol Laryngol 1975;84(3 Pt 1):327–32. [213] Shugar JM, Som PM, Krespi YP, Arnold LM, Som ML. Primary chordoma of the maxillary sinus. Laryngoscope 1980;90(11 Pt 1):1825–30. [214] Coppens JR, Ric Harnsberger H, Finn MA, Sharma P, Couldwell WT. Oronasopharyngeal chordomas. Acta Neurochir (Wien) 2009;151(8):901–7. [215] Loughran S, Badia L, Lund V. Primary chordoma of the ethmoid sinus. J Laryngol Otol 2000;114(8):627–9. [216] Scartozzi R, Couch M. Sciubba jchondroid chordoma of the nasal septum. Arch Otolaryngol Head Neck Surg 2003;129(2):244–6. [217] Lynn-Macrae A, Haines 3rd GK, Altman KW. Primary chordoma of the lateral nasal wall: case report and review. Ear Nose Throat J 2005;84(9):593–5. [218] Kitai R, Yoshida K, Kubota T, Sato K, Handa Y, Kasahara K, et al. Clival chordoma manifesting as nasal bleeding. A case report. Neuroradiology 2005;47(5):368–71. [219] Nguyen RP, Salzman KL, Stambuk HE, Ahuja AT, Harnsberger HR. Extraosseous chordoma of the nasopharynx. Ajnr Am J Neuroradiol 2009;30(4):803–7. [220] Singh G, Nakaji P, Chen F, Garrett M, Little A, Milligan J. Spontaneous debulking of middle fossa chordoma extension after transnasal petroclival biopsy–report of a case. Minim Invasive Neurosurg 2011;54(3):135–7 [Epub 2011 Aug 23]. [221] Kaufman BA, Francel PC, Roberts RL, Argemand E, Park TS, Dehner LP. Chondroid chordoma of the lateral skull base. Pediatr Neurosurg 1995;23(3):159–65. [222] Itoh T, Harada M, Ichikawa T, Shimoyamada K, Katayama N, Tsukune Y. A case of jugular foramen chordoma with extension to the neck: CT and MR findings. Radiat Med 2000;18(1):63–5. [223] Iwasaki S, Ito K, Takai Y, Morita A, Murofushi T. Chondroid chordoma at the jugular foramen causing retrolabyrinthine lesions in both the cochlear and vestibular branches of the eighth cranial nerve. Ann Otol Rhinol Laryngol 2004;113(1):82–6. [224] Oghalai JS, Leung MK, Jackler RK, McDermott MW. Transjugular craniotomy for the management of jugular foramen tumors with intracranial extension. Otol Neurotol 2004;25(4):570–9 [discussion 579]. [225] Huang Q, Wu H, Wang ZY, Yang J, Chen L, Jia H. Diagnosis and treatment of chordoma in the jugular foramen area: three cases report. Zhonghua Er Bi Yan Hou Tou Jing Wai Ke Za Zhi 2008;43(8):577–81. [226] Takei H, Rivera A, Suzuki H, Bahrami A, Powell SZ. Jugular foramen chordoid meningioma. Pathol Int 2006;56(7):397–401. [227] Yuh WT, Flickinger FW, Barloon TJ, Montgomery WJ. MR imaging of unusual chordomas. J Comput Assist Tomogr 1988;12(1):30–5. [228] Falcioni M, Taibah A, Caruso A, et al. Clival chordoma mimicking a trigeminal schwannoma. Otol Neurotol 2001;22(5):706–7. [229] Lu CY, Chai CY, Chiang IC. Chordoma mimicking the trigeminal schwannoma: a case report. Clin Imaging 2004;28(3):187–90. [230] Roche PH, Mercier P, Fournier HD. Temporopolar epidural transcavernous transpetrous approach. Technique and indications. Neurochirurgie 2007;53(1):23–31. [231] Bhadra AK, Casey AT. Familial chordoma. A report of two cases. J Bone Joint Surg Br 2006;88(5):634–6. [232] Miozzo M, Dalprà L, Riva P, Volontà M, Macciardi F, Pericotti S, et al. A tumor suppressor locus in familial and sporadic chordoma maps to 1p36. Int J Cancer 2000;87(1):68–72. [233] Kelley MJ, Korczak JF, Sheridan E, Yang X, Goldstein AM, Parry DM. Familial chordoma, a tumor of notochordal remnants, is linked to chromosome 7q33. Am J Hum Genet 2001;69(2):454–60.
73
[234] Stepanek J, Cataldo SA, Ebersold MJ, Lindor NM, Jenkins RB, Unni K, et al. Familial Chordoma with probable autosomal dominant inheritance. Am J Med Genet 1998;75(3):335–6. [235] Yang XR, Beerman M, Bergen AW, Parry DM, Sheridan E, Liebsch NJ, et al. Corroboration of a familial chordoma locus on chromosome 7q and evidence of genetic heterogeneity using single nucleotide polymorphisms (Snps). Int J Cancer 2005;116(3):487–91. [236] Kispert A, Herrmann BG. Immunohistochemical analysis of the Brachyury protein in wild-type and mutant mouse embryos. Dev Biol 1994;161(1):179–93. [237] Foote RF, Ablin G, Hall WMW. Chordoma in siblings. California Med 1958;88:383–6. [238] Enin IP. Chordoma of the nasopharynx in two members of a family. Vestn Otoinolaringol 1964;26:88–90. [239] Kerr WA, Allen KL, Haynes DR, Sellars SL. Letter: familial nasopharyngeal chordoma. S Afr Med J 1975;49(39):1584. [240] Chetty R, Levin CV, Kalan MR. Chordoma: a 20-year clinicopathologic review of the experience at Groote Schuur hospital, Cape Town. J Surg Oncol 1991;46(4):261–4. [241] Dalprà L, Malgara R, Miozzo M, Riva P, Volonte M, Larizza L, et al. First cytogenetic study of a recurrent familial chordoma of the clivus. Int J Cancer 1999;81(1):24–30. [242] Korczak JF, Kelley MJ, Allikian KA, Shah AA, Goldstein AM, Parry DM. Genomic screening for linkage in a family with autosomal dominant chordoma. Am J Hum Genet 1997;61(A400). [243] Heffelfinger MJ, Dahlin DC, Maccarty CS, Beabout JW. Chordomas and cartilaginous tumors at the skull base. Cancer 1973;32(2):410–20. [244] Chambers PW, Schwinn CP. Chordoma. A clinicopathologic study of metastasis. Am J Clin Pathol 1979;72(5):765–76. [245] Bergh P, Kindblom LG, Gunterberg B, Remotti F, Ryd W, Meis-Kindblom JM. Prognostic factors in chordoma of the sacrum and mobile spine: a study of 39 patients. Cancer 2000;88(9):2122–34. [246] Markwalder TM, Markwalder RV, Robert JL, Krneta A. Metastatic chordoma. Surg Neurol 1979;12(6):473–8. [247] Kamel MH, Lim C, Kelleher M, Aquilina K, Keohane C, Kaar G. Intracranial metastasis from a sacrococcygeal chordoma. Case report. J Neurosurg 2005;102(4):730–2. [248] Collins G.R., Essary L, Strauss J, Hino P, Cockerell CJ. Incidentally discovered distant cutaneous metastasis of sacral chordoma: a case with variation in s100 protein expression (compared to the primary tumor) and review of the literature. J Cutan Pathol 2012;39(6):637–43. [249] York JE, Kaczaraj A, Abi-Said D, Fuller GN, Skibber JM, Janjan NA, et al. Sacral chordoma: 40-year experience at a major cancer center. Neurosurgery 1999;44(1):74–9 [discussion 79–80]. [250] Kanthan R, Senger JL. Fine-needle aspiration cytology with histological correlation of chordoma metastatic to the lung: a diagnostic dilemma. Diagn Cytopathol 2011;39(12):927–32. [251] Azarpira N, Soluki S, Sepidbakht S, Mardani R. Humerus metastasis from a sacrococcygeal chordoma: a case report. J Med Case Rep 2010;4(1): 165. [252] Loehn B, Walvekar Rr, Harton A, Nuss D. Mandibular metastasis from a skull base chordoma: report of a case with review of literature. Skull Base 2009;19(5):363–8. [253] Zemmoura I, Ben Ismail M, Travers N, Jan M, Franc¸ois P. Maxillary surgical seeding of a clival chordoma. Br J Neurosurg 2012;26(1):102–3. [254] Rubin AI, Bagel J, Niedt G. Chordoma Cutis. J Am Acad Dermatol 2005;52(5 Suppl. 1):S105–8. [255] Dahlin DC. Bone tumours: general aspects and data on 6221 cases. 3rd Springfield: Charles C Thomas; 1978. [256] Chopra S, Frank SJ, Gu M. Cytologic diagnosis of chordoma in a peritoneal effusion: a case report. Acta Cytol 2010;54(3):341–4. [257] Oda Y, Takada R, Koitabashi K, Kurasawa T, Inoue T, Suzuki H, et al. Ohmiya Kisolated cardiac metastasis from sacral chordoma. Jpn Circ J 2000;64(8):627–30. [258] Delank KS, Kriegsmann J, Drees P, Eckardt A, Eysel P. Metastasizing chordoma of the lumbar spine. Eur Spine J 2002;11(2):167–71. [259] Zukerberg LR, Young RH. Chordoma metastatic to the ovary. Arch Pathol Lab Med 1990;114(2):208–10. [260] Tot T. Metastatic chordoma of the breast: an extremely rare lesion mimicking mucinous cancer. Apmis 2006;114(10):726–9. [261] Arnautovic´ KI, Al-Mefty O. Surgical seeding of chordomas. J Neurosurg 2001;95(5):798–803. [262] Fagundes MA, Hug EB, Liebsch NJ, Daly W, Efird J, Munzenrider JE, et al. Radiation therapy for chordomas of the base of skull and cervical spine: patterns of failure and outcome after relapse. Int J Radiat Oncol Biol Phys 1995;33(3):579–84. [263] Holzner H. Unusual metastasis of chordoma. Zentralbl Allg Pathol 1954;92(1–2):12–8. [264] Stough DR, Hartzog JT, Fisher RG. Unusual intradural spinal metastasis of a cranial chordoma. Case report. J Neurosurg 1971;34(4):560–2. [265] Plese JP, Borges JM, Nudelman M, Lefèvre AB, Sallum J. Unusual subarachnoid metastasis of an intracranial chordoma in infancy. Childs Brain 1978;4(4):251–6. [266] Marigil MA, Pardo-Mindan FJ, Joly M. Diagnosis of chordoma by cytologic examination of cerebrospinal fluid. Am J Clin Pathol 1983;80(3): 402–4.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 74
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
[267] Raffel C, Wright DC, Gutin PH, Wilson CB. Cranial chordomas: clinical presentation and results of operative and radiation therapy in twenty-six patients. Neurosurgery 1985;17(5):703–10. [268] Krol G, Sze G, Arbit E, Marcove R, Sundaresan N. Intradural metastases of chordoma. AJNR Am J Neuroradiol 1989;10(1):193–5. [269] Forsyth PA, Cascino TL, Shaw EG, Scheithauer BW, O’Fallon JR, Dozier JC, et al. Intracranial chordomas: a clinicopathological and prognostic study of 51 cases. J Neurosurg 1993;78(5):741–7. [270] Asano S, Kawahara N, Kirino T. Intradural spinal seeding of a clival chordoma. Acta Neurochir (Wien) 2003;145(7):599–603. [271] Champeaux K, San-Galli F, Eimer S, Liguoro D. Chordoma radicular metastasis following cerebrospinal fluid dissemination. Neurochirurgie 2008;54(1):41–5. [272] Martin MP, Olson S. Intradural drop metastasis of a clival chordoma. J Clin Neurosci 2009;16(8):1105–7. [273] Hanna SA, Tirabosco R, Amin A, Pollock RC, Skinner JA, Cannon SR, et al. Dedifferentiated chordoma: a report of four cases arising ‘de novo’. J Bone Joint Surg Br 2008;90(5):652–6. [274] Meis JM, Raymond AK, Evans HL, Charles RE, Giraldo AA. “Dedifferentiated” chordoma. A clinicopathologic and immunohistochemical study of three cases. Am J Surg Pathol 1987;11(7):516–25. [275] Dahlin DC. Chordoma. In: Dahlin’s bone tumors. General aspects and data on 11 087 cases. 5th Philadelphia: Lippincott-Raven; 1996. p. 291–306. [276] Morimitsu Y, Aoki T, Yokoyama K, Hashimoto H. Sarcomatoid chordoma: chordoma with a massive malignant spindle-cell component. Skeletal Radiol 2000;29(12):721–5. [277] Ikeda H, Honjo J, Sakurai H, Mitsuhashi N, Fukuda T, Niibe H. Dedifferentiated chordoma arising in irradiated sacral chordoma. Radiat Med 1997;15(2):109–11. [278] Hruban RH, May M, Marcove RC, Huvos AG. Lumbo-sacral chordoma with high-grade malignant cartilaginous and spindle cell components. Am J Surg Pathol 1990;14(4):384–9 [Review]. [279] Halpern J, Kopolovic J, Catane R. Malignant fibrous histiocytoma developing in irradiated sacral chordoma. Cancer 1984;53(12):2661–2. [280] Choi YJ, Kim TS. Malignant fibrous histiocytoma in chordoma– immunohistochemical evidence of transformation from chordoma to malignant fibrous histiocytoma. Yonsei Med J 1994;35(2):239–43. [281] Fukuda T, Aihara T, Ban S, Nakajima T, Machinami R. Sacrococcygeal chordoma with a malignant spindle cell component. A report of two autopsy cases with a review of the literature. Acta Pathol Jpn 1992;42(6):448–53. [282] Bisceglia M, D’Angelo VA, Guglielmi G, Dor DB, Pasquinelli G. Dedifferentiated chordoma of the thoracic spine with rhabdomyosarcomatous differentiation. Report of a case and review of the literature. Ann Diagn Pathol 2007;11(4):262–73. [283] MacSweeney F, Darby A, Saifuddin A. Dedifferentiated chondrosarcoma of the appendicular skeleton: MRI-pathological correlation. Skeletal Radiol 2003;32:671–8. [284] Saifuddin A, Mann BS, Mahroof S, et al. Dedifferentiated chondrosarcoma: use of MRI to guide needle biopsy. Clin Radiol 2004;59:268–72. [285] Fleming GF, Heimann PS, Stephens JK, Simon MA, Ferguson MK, Benjamin RS, et al. Dedifferentiated chordoma. Response to aggressive chemotherapy in two cases. Cancer 1993;72(3):714–8. [286] Mcmaster ML, Goldstein AM, Bromley CM, Ishibe N, Parry DM. Chordoma: incidence and survival patterns in the United States, 1973–1995. Cancer Causes Control 2001;12(1):1–11. [287] Dorfman HD, Czerniak B. Bone cancers. Cancer 1995;75(1 Suppl.):203–10. [288] Eriksson B, Gunterberg B, Kindblom LG. Chordoma. A clinicopathologic and prognostic study of a Swedish national series. Acta Orthop Scand 1981;52(1):49–58. [289] Mukherjee D, Chaichana KL, Adogwa O, Gokaslan Z, Aaronson O, Cheng JS, et al. Association of extent of local tumor invasion and survival in patients with malignant primary osseous spinal neoplasms from the surveillance, epidemiology, and end results (Seer) database. World Neurosurg 2011;76(6):580–5. [290] Mukherjee D, Chaichana KL, Gokaslan ZL, Aaronson O, Cheng JS, Mcgirt MJ. Survival of patients with malignant primary osseous spinal neoplasms: results from the surveillance, epidemiology, and end results (Seer) database from 1973 to 2003. J Neurosurg Spine 2011;14(2):143–50. [291] Healey JH, Lane JM. Chordoma: a critical review of diagnosis and treatment. Orthop Clin North Am 1989;20(3):417–26. [292] Gagliardi F, Boari N, Riva P, Mortini P. Current therapeutic options and novel molecular markers in skull base chordomas. Neurosurg Rev 2012;35(1):1–13 [discussion 13–4]. [293] Samii A, Gerganov Vm, Herold C, Hayashi N, Naka T, Mirzayan Mj, et al. Chordomas of the skull base: surgical management and outcome. J Neurosurg 2007;107(2):319–24. [294] Fuentes JM, Benezech J. Strategy of the surgical treatment of primary tumors of the spine. Neurochirurgie 1989;35(5):323–7, 352. [295] Kelley SP, Ashford RU, Rao AS, Dickson RA. Primary bone tumours of the spine: a 42-year survey from the Leeds regional bone tumour registry. Eur Spine J 2007;16(3):405–9. [296] Paavolainen P, Teppo L. Chordoma in Finland. Acta Orthop Scand 1976;47(1):46–51. [297] O’Neill P, Bell BA, Miller JD, Jacobson I, Guthrie W. Fifty years of experience with chordomas in southeast Scotland. Neurosurgery 1985;16(2): 166–70.
[298] Ridenour 3rd RV, Ahrens WA, Folpe AL, Miller DV. Clinical and histopathologic features of chordomas in children and young adults. Pediatr Dev Pathol 2010;13(1):9–17. [299] Borba LA, Al-Mefty O, Mrak RE, Suen J. Cranial chordomas in children and adolescents. J Neurosurg 1996;84(4):584–91 [Review]. [300] Coffin CM, Swanson PE, Wick MR, Dehner LP. Chordoma in childhood and adolescence. A clinicopathologic analysis of 12 cases. Arch Pathol Lab Med 1993;117(9):927–33. [301] Sibley RK, Day DL, Dehner LP, Trueworthy RC. Metastasizing chordoma in early childhood: a pathological and immunohistochemical study with review of the literature. Pediatr Pathol 1987;7(3):287–301. [302] Iwasa Y, Nakashima Y, Okajima H, Morishita S. Sacral chordoma in early childhood: clinicopathological and immunohistochemical study. Pediatr Dev Pathol 1998;1(5):420–6. [303] Wold LE, Laws Jr ER. Cranial chordomas in children and young adults. J Neurosurg 1983;59(6):1043–7. [304] Hoch BL, Nielsen GP, Liebsch NJ, Rosenberg AE. Base of skull chordomas in children and adolescents: a clinicopathologic study of 73 cases. Am J Surg Pathol 2006;30(7):811–8. [305] Walcott BP, Nahed BV, Mohyeldin A, Coumans J-V, Kahle KT, Ferreira MJ. Chordoma: current concepts, management, and future directions. Lancet Oncol 2012;13:e69–76. [306] Brada M, Pijls-Johannesma M, De Ruysscher D. Proton therapy in clinical practice: current clinical evidence. J Clin Oncol Off J Am Soc Clin Oncol 2007;25:965–70. [307] Schulz-Ertner D, Karger CP, Feuerhake A, Nikoghosyan A, Combs SE, Jäkel O, et al. Effectiveness of carbon ion radiotherapy in the treatment of skull-base chordomas. Int J Radiat Oncol Biol Phys 2007;68(2):449–57 [Epub 2007 Mar 23]. [308] Roy A, Chakrabarty A. Sacral and skull base chordoma: metastases or second primary? Br J Neurosurg 2000;14:597–8. [309] Watkins L, Khudados ES, Kaleoglu M, Revesz T, Sacares P, Crockard HA. Skull base chordomas: a review of 38 patients, 1958–88. Br J Neurosurg 1993;7:241–8. [310] Menezes AH, Gantz BJ, Traynelis VC, McCulloch TM. Cranial base chordomas. Clin Neurosurg 1997;44:491–509. [311] Noël G, Feuvret L, Calugaru V, Dhermain F, Mammar H, Haie-Méder C, et al. Chordomas of the base of the skull and upper cervical spine. One hundred patients irradiated by a 3D conformal technique combining photon and proton beams. Acta Oncol 2005;44(7):700–8. [312] Ares C, Hug EB, Lomax AJ, Bolsi A, Timmermann B, Rutz HP, et al. Effectiveness and safety of spot scanning proton radiation therapy for chordomas and chondrosarcomas of the skull base: first long-term report. Int J Radiat Oncol Biol Phys 2009;75:1111–8. [313] Carpentier A, Polivka M, Blanquet A, Lot G, George B. Suboccipital and cervical chordomas: the value of aggressive treatment at first presentation of the disease. J Neurosurg 2002;97(5):1070–7. [314] Magrini SM, Papi MG, Marletta F, Tomaselli S, Cellai E, Mungai V, et al. Chordoma-natural history, treatment and prognosis. The Florence Radiotherapy Department experience (1956–1990) and a critical review of the literature. Acta Oncol Stockh Swed 1992;31:847–51. [315] Romero J, Cardenes H, la Torre A, Valcarcel F, Magallon R, Regueiro C, et al. Chordoma: results of radiation therapy in eighteen patients. Radiother Oncol J Eur Soc Ther Radiol Oncol 1993;29:27–32. [316] Catton C, O’Sullivan B, Bell R, Laperriere N, Cummings B, Fornasier V, et al. Chordoma: long-term follow-up after radical photon irradiation. Radiother Oncol 1996;41:67–72. [317] Zorlu F, Gürkaynak M, Yildiz F, Oge K, Atahan IL. Conventional external radiotherapy in the management of clivus chordomas with overt residual disease. Neurol Sci Off J Ital Neurol Soc Ital Soc Clin Neurophysiol 2000;21:203–7. [318] Orecchia R, Zurlo A, Loasses A, Krengli M, Tosi G, Zurrida S, et al. Particle beam therapy (hadrontherapy): basis for interest and clinical experience. Eur J Cancer Oxf Engl 1990 1998;34:459–68. [319] Berson AM, Castro JR, Petti P, Phillips TL, Gauger GE, Gutin P, et al. Charged particle irradiation of chordoma and chondrosarcoma of the base of skull and cervical spine: The Lawrence Berkeley laboratory experience. Int J Radiat Oncol Biol Phys 1988;15(3):559–65. [320] Austin-Seymour M, Munzenrider J, Goitein M, Verhey L, Urie M, Gentry R, et al. Fractionated proton radiation therapy of chordoma and low-grade chondrosarcoma of the base of the skull. J Neurosurg 1989;70:13–7. [321] Benk V, Liebsch NJ, Munzenrider JE, Efird J, McManus P, Suit H. Base of skull and cervical spine chordomas in children treated by high-dose irradiation. Int J Radiat Oncol Biol Phys 1995;31(3):577–81. [322] Hug EB, Loredo LN, Slater JD, DeVries A, Grove RI, Schaefer RA, et al. Proton radiation therapy for chordomas and chondrosarcomas of the skull base. J Neurosurg 1999;91(3):432–9. [323] Munzenrider JE, Liebsch NJ. Proton therapy for tumors of the skull base. Strahlenther Onkol Organ Dtsch Röntgengesellschaft Al 1999;175(Suppl. 2):57–63. [324] Igaki H, Koichi T, Toshiyuki O, Shinji S, Kenji K, Masaharu H, et al. Clinical results of proton beam therapy for skull base chordoma. Int J Radiat Oncol Biol Phys 2004;60(4):1120–6. [325] Fuji H, Nakasu Y, Ishida Y, Horiguchi S, Mitsuya K, Kashiwagi H, et al. Feasibility of proton beam therapy for chordoma and chondrosarcoma of the skull base. Skull Base Off J North Am Skull Base Soc Al 2011;21:201–6. [326] Rombi B, Ares C, Hug EB, Schneider R, Goitein G, Staab A, et al. Spot-scanning proton radiation therapy for pediatric chordoma and chondrosarcoma:
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
[327]
[328]
[329]
[330]
[331]
[332]
[333]
[334]
[335]
[336]
[337]
[338]
[339]
[340] [341]
[342]
[343]
[344]
[345]
[346] [347]
[348] [349]
[350]
[351]
[352] [353]
clinical outcome of 26 patients treated at Paul Scherrer institute. Int J Radiat Oncol Biol Phys 2013;86:578–84. Santoni R, Liebsch N, Finkelstein DM, Hug E, Hanssens P, Goitein M, et al. Temporal lobe (TL) damage following surgery and high-dose photon and proton irradiation in 96 patients affected by chordomas and chondrosarcomas of the base of the skull. Int J Radiat Oncol Biol Phys 1998;41:59–68. Glosser G, McManus P, Munzenrider J, Austin-Seymour M, Fullerton B, Adams J, et al. Neuropsychological function in adults after high dose fractionated radiation therapy of skull base tumors. Int J Radiat Oncol Biol Phys 1997;38:231–9. Pehlivan B, Ares C, Lomax AJ, Stadelmann O, Goitein G, Timmermann B, et al. Temporal lobe toxicity analysis after proton radiation therapy for skull base tumors. Int J Radiat Oncol Biol Phys 2012;83:1432–40. Debus J, Hug EB, Liebsch NJ, O’Farrel D, Finkelstein D, Efird J, et al. Brainstem tolerance to conformal radiotherapy of skull base tumors. Int J Radiat Oncol Biol Phys 1997;39:967–75. Marucci L, Niemierko A, Liebsch NJ, Aboubaker F, Liu MCC, Munzenrider JE. Spinal cord tolerance to high-dose fractionated 3D conformal proton-photon irradiation as evaluated by equivalent uniform dose and dose volume histogram analysis. Int J Radiat Oncol Biol Phys 2004;59:551–5. Pai HH, Thornton A, Katznelson L, Finkelstein DM, Adams JA, Fullerton BC, et al. Hypothalamic/pituitary function following high-dose conformal radiotherapy to the base of skull: demonstration of a dose-effect relationship using dose-volume histogram analysis. Int J Radiat Oncol Biol Phys 2001;49:1079–92. Habrand IL, Austin-Seymour M, Birnbaum S, Wray S, Carroll R, Munzenrider J, et al. Neurovisual outcome following proton radiation therapy. Int J Radiat Oncol Biol Phys 1989;16:1601–6. Urie MM, Fullerton B, Tatsuzaki H, Birnbaum S, Suit HD, Convery K, et al. A dose response analysis of injury to cranial nerves and/or nuclei following proton beam radiation therapy. Int J Radiat Oncol Biol Phys 1992;23:27–39. Muthukumar N, Kondziolka D, Lunsford LD, Flickinger JC. Stereotactic radiosurgery for chordoma and chondrosarcoma: further experiences. Int J Radiat Oncol Biol Phys 1998;41:387–92. Pamir MN, Kilic¸ T, Türe U, Ozek MM. Multimodality management of 26 skull-base chordomas with 4-year mean follow-up: experience at a single institution. Acta Neurochir (Wien) 2004;146(4):343–54 [discusion 354]. Feigl GC, Bundschuh O, Gharabaghi A, Safavi-Abassi S, El Shawarby A, Samii M, et al. Evaluation of a new concept for the management of skull base chordomas and chondrosarcomas. J Neurosurg 2005;102(Suppl.):165–70. Krishnan S, Foote RL, Brown PD, Pollock BE, Link MJ, Garces YI. Radiosurgery for cranial base chordomas and chondrosarcomas. Neurosurgery 2005;56(4):777–84 [discussion 777–84]. Martin JJ, Niranjan A, Kondziolka D, Flickinger JC, Lozanne KA, Lunsford LD. Radiosurgery for chordomas and chondrosarcomas of the skull base. J Neurosurg 2007;107:758–64. Liu A-L, Wang Z-C, Sun S-B, Wang M-H, Luo B, Liu P. Gamma knife radiosurgery for residual skull base chordomas. Neurol Res 2008;30:557–61. Henderson FC, McCool K, Seigle J, Jean W, Harter W, Gagnon GJ. Treatment of chordomas with CyberKnife: Georgetown university experience and treatment recommendations. Neurosurgery 2009;64:A44–53. Jiang B, Veeravagu A, Lee M, Harsh GR, Lieberson RE, Bhatti I, et al. Management of intracranial and extracranial chordomas with CyberKnife stereotactic radiosurgery. J Clin Neurosci Off J Neurosurg Soc Australas 2012;19:1101–6. Hauptman JS, Barkhoudarian G, Safaee M, Gorgulho A, Tenn S, Agazaryan N, et al. Challenges in linear accelerator radiotherapy for chordomas and chondrosarcomas of the skull base: focus on complications. Int J Radiat Oncol Biol Phys 2012;83:542–51. Debus J, Schulz-Ertner D, Schad L, Essig M, Rhein B, Thillmann CO, et al. Stereotactic fractionated radiotherapy for chordomas and chondrosarcomas of the skull base. Int J Radiat Oncol Biol Phys 2000;47(3):591–6. Scheil S, Bruderlein S, Liehr T, Starke H, Herms J, Schulte M, et al. Genomewide analysis of sixteen chordomas by comparative genomic hybridization and cytogenetics of the first human chordoma cell line, U-CH1. Genes Chromosomes Cancer 2001;32:203–11. Brandal P, Bjerkehagen B, Danielsen H, Heim S. Chromosome 7 abnormalities are common in chordomas. Cancer Genet Cytogenet 2005;160:15–21. Hallor KH, Staaf J, Jönsson G, Heidenblad M, Vult von Steyern F, Bauer HC, et al. Frequent deletion of the CDKN2A locus in chordoma: analysis of chromosomal imbalances using array comparative genomic hybridisation. Br J Cancer 2008;98(2):434–42. Larizza L, Mortini P, Riva P. Update on the cytogenetics and molecular genetics of chordoma. Hered Cancer Clin Pract 2005;3(1):29–41. Almefty KK, Pravdenkova S, Sawyer J, Al-Mefty O. Impact of cytogenetic abnormalities on the management of skull base chordomas. J Neurosurg 2009;110(4):715–24. Stacchiotti S, Marrari A, Tamborini E, Palassini E, Virdis E, Messina A, et al. Response to imatinib plus sirolimus in advanced chordoma. Ann Oncol 2009;20(11):1886–94. Schwab J, Antonescu C, Boland P, Healey J, Rosenberg A, Nielsen P, et al. Combination of PI3K/mTOR inhibition demonstrates efficacy in human chordoma. Anticancer Res 2009;29(6):1867–71. Krause DS, Van Etten RA. Tyrosine kinases as targets for cancer therapy. N Engl J Med 2005;353(2):172–87. Duffaud F, Le Cesne A. Imatinib in the treatment of solid tumours. Target Oncol 2009;4(1):45–56.
75
[354] Casali PG, Stacchiotti S, Sangalli C, Olmi P, Gronchi A. Chordoma. Curr Opin Oncol 2007;19(4):367–70 [Review]. [355] Stacchiotti S, Longhi A, Ferraresi V, Grignani G, Comandone A, Stupp R, et al. Phase II study of imatinib in advanced chordoma. J Clin Oncol 2012;30(9):914–20. [356] Hof H, Welzel T, Debus J. Effectiveness of cetuximab/gefitinib in the therapy of a sacral chordoma. Onkologie 2006;29(12):572–4. [357] Lindén O, Stenberg L, Kjellén E. Regression of cervical spinal cord compression in a patient with chordoma following treatment with cetuximab and gefitinib. Acta Oncol 2009;48(1):158–9. [358] Singhal N, Kotasek D, Parnis FX. Response to erlotinib in a patient with treatment refractory chordoma. Anticancer Drugs 2009;20(10):953–5. [359] Naka T, Iwamoto Y, Shinohara N, Ushijima M, Chuman H, Tsuneyoshi M. Expression of c-met proto-oncogene product (c-MET) in benign and malignant bone tumors. Mod Pathol 1997;10:832–8. [360] Weinberger PM, Yu Z, Kowalski D, Joe J, Manger P, Psyrri A, et al. Differential expression of epidermal growth factor receptor, c-Met, and HER2/neu in chordoma compared with 17 other malignancies. Arch Otolaryngol Head Neck Surg 2005;131(8):707–11. [361] Li Y, Guessous F, Zhang Y, Dipierro C, Kefas B, Johnson E, et al. MicroRNA-34a inhibits glioblastoma growth by targeting multiple oncogenes. Cancer Res 2009;69(19):7569–76 [Epub 2009 Sep 22]. [362] Presneau N, Shalaby A, Idowu B, Gikas P, Cannon SR, Gout I, et al. Potential therapeutic targets for chordoma: PI3K/AKT/TSC1/TSC2/mTOR pathway. Br J Cancer 2009;100(9):1406–14. [363] Han S, Polizzano C, Nielsen GP, Hornicek FJ, Rosenberg AE, Ramesh V. Aberrant hyperactivation of akt and Mammalian target of rapamycin complex 1 signaling in sporadic chordomas. Clin Cancer Res 2009;15(6):1940–6. [364] Faivre S, Kroemer G, Raymond E, et al. Current development of mTOR inhibitors as anticancer agents. Nat Rev Drug Discov 2006;5(8):671–88. [365] Rao RD, Mladek AC, Lamont JD, Goble JM, Erlichman C, James CD, et al. Disruption of parallel and converging signaling pathways contributes to the synergistic antitumor effects of simultaneous mTOR and EGFR inhibition in GBM cells. Neoplasia 2005;7(10):921–9. [366] Goudar RK, Shi Q, Hjelmeland MD, Keir ST, McLendon RE, Wikstrand CJ, et al. Combination therapy of inhibitors of epidermal growth factor receptor/vascular endothelial growth factor receptor 2 (AEE788) and the mammalian target of rapamycin (RAD001) offers improved glioblastoma tumor growth inhibition. Mol Cancer Ther 2005;4(1):101–12. [367] Lal B, Goodwin CR, Sang Y, Foss CA, Cornet K, Muzamil S, et al. EGFRvIII and cMet pathway inhibitors synergize against PTEN-null/EGFRvIII+ glioblastoma xenografts. Mol Cancer Ther 2009;8(7):1751–60. [368] Azzarelli A, Quagliuolo V, Cerasoli S, Zucali R, Bignami P, Mazzaferro V, et al. Chordoma: natural history and treatment results in 33 cases. J Surg Oncol 1988;37(3):185–91. [369] Scimeca PG, James-Herry AG, Black KS, Kahn E, Weinblatt ME. Chemotherapeutic treatment of malignant chordoma in children. J Pediatr Hematol Oncol 1996;18(2):237–40. [370] Al-Rahawan MM, Siebert JD, Mitchell CS, Smith SD. Durable complete response to chemotherapy in an infant with a clival chordoma. Pediatr Blood Cancer 2012;59(2):323–5. [371] Bayrak OF, Aydemir E, Gulluoglu S, Sahin F, Sevli S, Yalvac ME, et al. The effects of chemotherapeutic agents on differentiated chordoma cells. J Neurosurg Spine 2011;15(6):620–4. [372] Guiu S, Guiu B, Feutray S, Chauffert B. Direct intratumoral chemotherapy with carboplatin and epinephrine in a recurrent cervical chordoma: case report. Neurosurgery 2009;65(3):E629–30 [discussion E630]. [373] Guan JY, He XF, Chen Y, Zeng QL, Mei QL, Li YH. Percutaneous intratumoral injection with pingyangmycin lipiodol emulsion for the treatment of recurrent sacrococcygeal chordomas. J Vasc Interv Radiol 2011;22(8):1216–20. [374] Karakousis CP, Park JJ, Fleminger R, Friedman M. Chordomas: diagnosis and management. Am Surg 1981;47(11):497–501. [375] Schönegger K, Gelpi E, Prayer D, Dieckmann K, Matula C, Hassler M, et al. Recurrent and metastatic clivus chordoma: systemic palliative therapy retards disease progression. Anticancer Drugs 2005;16(10):1139–43. [376] Chugh R, Dunn R, Zalupski MM, Biermann JS, Sondak VK, Mace JR, et al. Phase II study of 9-nitro-camptothecin in patients with advanced chordoma or soft tissue sarcoma. J Clin Oncol 2005;23(15):3597–604. [377] Ji Z, Long H, Hu Y, Qiu X, Chen X, Li Z, et al. Expression of MDR1, HIF-1␣ and MRP1 in sacral chordoma and chordoma cell line CM-319. J Exp Clin Cancer Res 2010;29:158. [378] Mirra JM, Nelson SD, Della Rocca C, Mertens F. World Health Organization classification of tumours. In: Mertens F, editor. Pathol Genet Tumours Soft Tissue Bone. 2002. p. 315–7. [379] Tamborini E, Virdis E, Negri T, Orsenigo M, Brich S, Conca E, et al. Analysis of receptor tyrosine kinases (RTKs) and downstream pathways in chordomas. Neuro-oncology 2010;12(8):776–89. [380] Dewaele B, Maggiani F, Floris G, Ampe M, Vanspauwen V, Wozniak A, et al. Frequent activation of EGFR in advanced chordomas. Clin Sarcoma Res 2011;1:4. [381] Shalaby A, Presneau N, Ye H, Halai D, Berisha F, Idowu B, et al. The role of epidermal growth factor receptor in chordoma pathogenesis: a potential therapeutic target. J Pathol 2011;223(3):336–46. [382] Mitsuhashi T, Sasano WM, Ono HM. The expression of insulin like growthfactor 1 (IGF1), IGF1 receptor and transforming growth factor-beta in chordoma. Modern Pathol 2006 [cité 28 déc 2012].
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 76
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
[383] Chung CH, Ely K, McGavran L, Varella-Garcia M, Parker J, Parker N, et al. Increased epidermal growth factor receptor gene copy number is associated with poor prognosis in head and neck squamous cell carcinomas. J Clin Oncol 2006;24(25):4170–6. [384] Nieto Y, Nawaz F, Jones RB, Shpall EJ, Nawaz S. Prognostic significance of overexpression and phosphorylation of epidermal growth factor receptor (EGFR) and the presence of truncated EGFRvIII in locoregionally advanced breast cancer. J Clin Oncol 2007;25(28):4405–13. [385] Selvaggi G, Novello S, Torri V, Leonardo E, De Giuli P, Borasio P, et al. Epidermal growth factor receptor overexpression correlates with a poor prognosis in completely resected non-small-cell lung cancer. Ann Oncol 2004;15(1):28–32. [386] Spano J-P, Lagorce C, Atlan D, Milano G, Domont J, Benamouzig R, et al. Impact of EGFR expression on colorectal cancer patient prognosis and survival. Ann Oncol 2005;16(1):102–8. [387] Schlegel J, Merdes A, Stumm G, Albert FK, Forsting M, Hynes N, et al. Amplification of the epidermal-growth-factor-receptor gene correlates with different growth behaviour in human glioblastoma. Int J Cancer 1994;56(1):72–7. [388] Sommer J, Itani DM, Homlar KC, Keedy VL, Halpern JL, Holt GE, et al. Methylthioadenosine phosphorylase and activated insulin-like growth factor-1 receptor/insulin receptor: potential therapeutic targets in chordoma. J Pathol 2010;220(5):608–17. [389] Rikhof B, De Jong S, Suurmeijer AJH, Meijer C, Van der Graaf WTA. The insulinlike growth factor system and sarcomas. J Pathol 2009;217(4):469–82. [390] Scheipl S, Froehlich EV, Leithner A, Beham A, Quehenberger F, Mokry M, et al. Does insulin-like growth factor 1 receptor (IGF-1R) targeting provide new treatment options for chordomas? A retrospective clinical and immunohistochemical study. Histopathology 2012;60(6):999–1003. [391] Corso S, Comoglio PM, Giordano S. Cancer therapy: can the challenge be MET? Trends Mol Med 2005;11(6):284–92. [392] Kuniyasu H, Yasui W, Yokozaki H, Akagi M, Akama Y, Kitahara K, et al. Frequent loss of heterozygosity of the long arm of chromosome 7 is closely associated with progression of human gastric carcinomas. Int J Cancer 1994;59(5):597–600. [393] Naka T, Boltze C, Samii A, Samii M, Herold C, Ostertag H, et al. Expression of c-MET, low-molecular-weight cytokeratin, matrix metalloproteinases-1 and -2 in spinal chordoma. Histopathology 2009;54(5):607–13. [394] Naka T, Kuester D, Boltze C, Scheil-Bertram S, Samii A, Herold C, et al. Expression of hepatocyte growth factor and c-MET in skull base chordoma. Cancer 2008;112(1):104–10. [395] Burger PC, Makek M, Kleihues P. Tissue polypeptide antigen staining of the chordoma and notochordal remnants. Acta Neuropathol 1986;70(3–4):269–72. [396] Buleje SJ, Yábar BA, Guevara-Fujita M, Fujita R. [Molecular and genetic features of gastrointestinal stromal tumors (gist)]. Rev Gastroenterol Peru 2012;32(4):394–9. [397] Tamborini E, Miselli F, Negri T, Lagonigro MS, Staurengo S, Dagrada GP, et al. Molecular and biochemical analyses of platelet-derived growth factor receptor (PDGFR) B, PDGFRA, and KIT receptors in chordomas. Clin Cancer Res 2006;12(23):6920–8. [398] Demetri GD, Elias AD. Results of single-agent and combination chemotherapy for advanced soft tissue sarcomas. Implications for decision making in the clinic. Hematol Oncol Clin North Am 1995;9(4):765–85. [399] Schmelzle T, Hall MN. TOR a central controller of cell growth. Cell 2000;103(2):253–62. [400] Atkins MB, Hidalgo M, Stadler WM, Logan TF, Dutcher JP, Hudes GR, et al. Randomized phase II study of multiple dose levels of CCI-779, a novel mammalian target of rapamycin kinase inhibitor, in patients with advanced refractory renal cell carcinoma. J Clin Oncol 2004;22(5):909–18. [401] Launay SG, Chetaille B, Medina F, Perrot D, Nazarian S, Guiramand J, et al. Efficacy of epidermal growth factor receptor targeting in advanced chordoma: case report and literature review. BMC Cancer 2011;11(1):423. [402] Rhomberg W, Eiter H, Böhler F, Dertinger S. Combined radiotherapy and razoxane in the treatment of chondrosarcomas and chordomas. Anticancer Res 2006;26(3B):2407–11. [403] Di Maio S, Temkin N, Ramanathan D, Sekhar LN. Current comprehensive management of cranial base chordomas: 10-year meta-analysis of observational studies. J Neurosurg 2011;115(6):1094–105. [404] Nikoghosyan AV, Karapanagiotou-Schenkel I, Münter MW, Jensen AD, Combs SE, Debus J. Randomised trial of proton vs. Carbon ion radiation therapy in patients with chordoma of the skull base, clinical phase III study HIT-1-Study. BMC Cancer 2010;10:607. [405] Jian BJ, Bloch OG, Yang I, Han SJ, Aranda D, Tihan T, et al. Adjuvant radiation therapy and chondroid chordoma subtype are associated with a lower tumor recurrence rate of cranial chordoma. J Neurooncol 2010;98(1):101–8. [406] Jawad MU, Scully SP. Surgery significantly improves survival in patients with chordoma. Spine (Phila Pa 1976) 2010;35(1):117–23. [407] Di Maio S, Rostomily R, Sekhar LN. Current surgical outcomes for cranial base chordomas: cohort study of 95 patients. Neurosurgery 2012;70(6):1355–60 [discussion 1360]. [408] Wu Z, Zhang J, Zhang L, Jia G, Tang J, Wang L, et al. Prognostic factors for longterm outcome of patients with surgical resection of skull base chordomas106 cases review in one institution. Neurosurg Rev 2010;33(4):451–6. [409] Sen C, Triana AI, Berglind N, Godbold J, Shrivastava RK. Clival chordomas: clinical management, results, and complications in 71 patients. J Neurosurg 2010;113(5):1059–71.
[410] Takahashi S, Kawase T, Yoshida K, Hasegawa A, Mizoe JE. Skull base chordomas: efficacy of surgery followed by carbon ion radiotherapy. Acta Neurochir (Wien) 2009;151(7):759–69. [411] Tzortzidis F, Elahi F, Wright D, Natarajan SK, Sekhar LN. Patient outcome at long-term follow-up after aggressive microsurgical resection of cranial base chordomas. Neurosurgery 2006;59(2):230–7 [discussion 230–7]. [412] Pallini R, Maira G, Pierconti F, Falchetti ML, Alvino E, Cimino-Reale G, et al. Chordoma of the skull base: predictors of tumor recurrence. J Neurosurg 2003;98(4):812–22. [413] Jeanrot C, Vinh TS, Anract P, De Pinieux G, Ouaknine M, Forest M, et al. Sacral chordoma: retrospective review of 11 surgically treated cases. Rev Chir Orthop Reparatrice Appar Mot 2000;86(7):684–93. [414] Fuchs B, Dickey ID, Yaszemski MJ, Inwards CY, Sim FH. Operative management of sacral chordoma. J Bone Joint Surg Am 2005;87(10):2211–6. [415] Hsieh PC, Xu R, Sciubba DM, McGirt MJ, Nelson C, Witham TF, et al. Longterm clinical outcomes following en bloc resections for sacral chordomas and chondrosarcomas: a series of twenty consecutive patients. Spine (Phila Pa 1976) 2009;34(20):2233–9. [416] Ruggieri P, Angelini A, Ussia G, Montalti M, Mercuri M. Surgical margins and local control in resection of sacral chordomas. Clin Orthop Relat Res 2010;468(11):2939–47. [417] Clarke MJ, Dasenbrock H, Bydon A, Sciubba DM, McGirt MJ, Hsieh PC, et al. Posterior-only approach for en bloc sacrectomy: clinical outcomes in 36 consecutive patients. Neurosurgery 2012;71(2):357–64, discussion 364. [418] Sciubba DM, Cheng JJ, Petteys RJ, Weber KL, Frassica DA, Gokaslan ZL. Chordoma of the sacrum and vertebral bodies. J Am Acad Orthop Surg 2009;17(11):708–17 [Review]. [419] Moojen WA, Vleggeert-Lankamp CL, Krol AD, Dijkstra SP. Long-term results: adjuvant radiotherapy in en bloc resection of sacrococcygeal chordoma is advisable. Spine (Phila Pa 1976) 2011;36(10):E656–61. [420] Samson IR, Springfield DS, Suit HD, Mankin HJ. Operative treatment of sacrococcygeal chordoma. A review of twenty-one cases. J Bone Joint Surg Am 1993;75(10):1476–84. [421] Biagini R, Ruggieri P, Mercuri M, Capanna R, Briccoli A, Perin S, et al. Neurologic deficit after resection of the sacrum. Chir Organi Mov 1997;82(4):357–72 [Review]. [422] Stener B, Gunterberg B. High amputation of the sacrum for extirpation of tumors. Principles and technique. Spine (Phila Pa 1976) 1978;3(4):351–66. [423] Bommer KK, Ramzy I, Mody D. Fine-needle aspiration biopsy in the diagnosis and management of bone lesions: a study of 450 cases. Cancer 1997;81(3):148–56. [424] McLoughlin GS, Sciubba DM, Suk I, Witham T, Bydon A, Gokaslan ZL, et al. En bloc total sacrectomy performed in a single stage through a posterior approach. Neurosurgery 2008;63(1 Suppl. 1):ONS115–20. [425] Tomita K, Tsuchiya H. Total sacrectomy and reconstruction for huge sacral tumors. Spine (Phila Pa 1976) 1990;15(11):1223–7. [426] Doita M, Harada T, Iguchi T, Sumi M, Sha H, Yoshiya S, et al. Total sacrectomy and reconstruction for sacral tumors. Spine (Phila Pa 1976) 2003;28(15):E296–301. [427] Gallia GL, Haque R, Garonzik I, Witham TF, Khavkin YA, Wolinsky JP, et al. Spinal pelvic reconstruction after total sacrectomy for en bloc resection of a giant sacral chordoma. Technical note. J Neurosurg Spine 2005;3(6): 501–6. [428] Fourney DR, Rhines LD, Hentschel SJ, Skibber JM, Wolinsky JP, Weber KL, et al. En bloc resection of primary sacral tumors: classification of surgical approaches and outcome. J Neurosurg Spine 2005;3(2):111–22. [429] Okaji RY, Silveira Jr JM, Nakano MK, Kiuti LT, Maiorano MC. Sacral chordoma en-bloc resection and lumbar-iliac stabilization. Arq Neuropsiquiatr 2008;66(2B):400–1. [430] Xue-Song L, Chao Y, Kai-Yong Y, Si-Qing H, Heng Z. Surgical excision of extensive sacrococcygeal chordomas assisted by occlusion of the abdominal aorta. J Neurosurg Spine 2010;12(5):490–6. [431] Yang H, Zhu L, Ebraheim NA, Liu J, Shapiro A, Castillo S, et al. Surgical treatment of sacral chordomas combined with transcatheter arterial embolization. J Spinal Disord Tech 2010;23(1):47–52. [432] Yang HL, Chen KW, Wang GL, Lu J, Ji YM, Liu JY, et al. Pre-operative transarterial embolization for treatment of primary sacral tumors. J Clin Neurosci 2010;17(10):1280–5. [433] Stacchiotti S, Casali PG, Lo Vullo S, Mariani L, Palassini E, Mercuri M, et al. Chordoma of the mobile spine and sacrum: a retrospective analysis of a series of patients surgically treated at two referral centers. Ann Surg Oncol 2010;17(1):211–9. [434] Cheng EY, Ozerdemoglu RA, Transfeldt EE, Thompson Jr RC. Lumbosacral chordoma. Prognostic factors and treatment. Spine (Phila Pa 1976) 1999;24(16):1639. [435] Baratti D, Gronchi A, Pennacchioli E, Lozza L, Colecchia M, Fiore M, et al. Chordoma: natural history and results in 28 patients treated at a single institution. Ann Surg Oncol 2003;10(3):291–6. [436] Zhou H, Chen CB, Lan J, Liu C, Liu XG, Jiang L, et al. Differential proteomic profiling of chordomas and analysis of prognostic factors. J Surg Oncol 2010;102(7):720–7. [437] Choi D, Melcher R, Harms J, Crockard A. Outcome of 132 operations in 97 patients with chordomas of the craniocervical junction and upper cervical spine. Neurosurgery 2010;66(1):59–65 [discussion 65]. [438] Carpentier A, Blanquet A, George B. Suboccipital and cervical chordomas: radical resection with vertebral artery control. Neurosurg Focus 2001;10(3).
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
[439] Bjornsson J, Wold LE, Ebersold MJ, Laws ER. Chordoma of the mobile spine. A clinicopathologic analysis of 40 patients. Cancer 1993;71(3):735–40. [440] Sundaresan N, Galicich JH, Chu FC, Huvos AG. Spinal chordomas. J Neurosurg 1979;50(3):312–9. [441] Wang Y, Xiao J, Wu Z, Huang Q, Huang W, Zhu Q, et al. Primary chordomas of the cervical spine: a consecutive series of 14 surgically managed cases. J Neurosurg Spine 2012;17(4):292–9, http://dx.doi.org/10.3171/2012.7.SPINE12175. [442] Barrenechea IJ, Perin NI, Triana A, Lesser J, Costantino P, Sen C. Surgical management of chordomas of the cervical spine. J Neurosurg Spine 2007;6(5):398–406. [443] Klekamp J, Samii M. Spinal chordomas–results of treatment over a 17-year period. Acta Neurochir (Wien) 1996;138(5):514–9. [444] Murali R, Rovit RL, Benjamin MV. Chordoma of the cervical spine. Neurosurgery 1981;9(3):253–6. [445] Boriani S, Bandiera S, Biagini R, Bacchini P, Boriani L, Cappuccio M, et al. Chordoma of the mobile spine: fifty years of experience. Spine (Phila Pa 1976) 2006;31(4):493–503. [446] Fontes R, O’Toole JE. Chordoma of the thoracic spine in an 89-year-old. Eur Spine J 2012;21(Suppl. 4):S428–32, doi:10.1007/s00586-011-1980-6, [Epub 2011 Aug 25]. [447] Wellinger C. Spinal chordoma. I. Review of the literature since 1960. Rev Rhum Mal Osteoartic 1975;42(2):109–16 [Review. French. No abstract available]. [448] Wellinger C. Spinal chordoma. II. Review of the literature since 1960. Rev Rhum Mal Osteoartic 1975;42(3):195–204 [French. No abstract available]. [449] Wellinger C. Spinal chrodoma – III. Review of the literature since 1960. Rev Rhum Mal Osteoartic 1975;42(4):287–95 [French]. [450] Leman P, Cohadon F, Cohadon S. Vertebral chordomas. J Chir (Paris) 1965;89(4):485–500. [451] de Bruïne FT, Kroon HM. Spinal chordoma: radiologic features in 14 cases. AJR Am J Roentgenol 1988;150(4):861–3. [452] Fujita T, Kawahara N, Matsumoto T, Tomita K. Chordoma in the cervical spine managed with en bloc excision. Spine (Phila Pa 1976) 1999;24(17): 1848–51. [453] Mazel CH, Grunenwald D, Laudrin P, Marmorat JL. Radical excision in the management of thoracic and cervicothoracic tumors involving the spine: results in a series of 36 cases. Spine (Phila Pa 1976) 2003;28(8):782–92 [discussion 792. Review]. [454] Rhines LD, Fourney DR, Siadati A, Suk I, Gokaslan ZL. En bloc resection of multilevel cervical chordoma with C-2 involvement. Case report and description of operative technique. J Neurosurg Spine 2005;2(2):199–205. [455] Bailey CS, Fisher CG, Boyd MC, Dvorak MF. En bloc marginal excision of a multilevel cervical chordoma. Case report. J Neurosurg Spine 2006;4(5): 409–14. [456] Leitner Y, Shabat S, Boriani L, Boriani S. En bloc resection of a C4 chordoma: surgical technique. Eur Spine J 2007;16(12):2238–42 [Epub 2007 Aug 23]. [457] Cloyd JM, Chou D, Deviren V, Ames CP. En bloc resection of primary tumors of the cervical spine: report of two cases and systematic review of the literature. Spine J 2009;9(11):928–35 [Epub 2009 Aug 28. Review]. [458] Chou D, Acosta Jr F, Cloyd JM, Ames CP. Parasagittal osteotomy for en bloc resection of multilevel cervical chordomas. J Neurosurg Spine 2009;10(5):397–403. [459] Hsieh PC, Gallia GL, Sciubba DM, Bydon A, Marco RA, Rhines L, et al. En bloc excisions of chordomas in the cervical spine: review of five consecutive cases with more than 4-year follow-up. Spine (Phila Pa 1976) 2011;36(24):E1581–7. [460] Vassal F, Dumas B, Nuti C. Margin-free, en bloc resection of a multilevel cervical chordoma with C-2 involvement: case report with 2-year follow-up and description of operative technique. Br J Neurosurg 2012;26(6):929–31, doi:10.3109/02688697.2012.685785, [Epub 2012 May 21]. [461] Massimiliano V, Giulio M. Six level cervico-thoracic circumferential reconstruction: report of the second case of the literature. Acta Neurochir Suppl 2011;108:187–90. [462] Hsu KY, Zucherman JF, Mortensen N, Johnston JO, Gartland J. Follow-up evaluation of resected lumbar vertebral chordoma over 11 years: a case report. Spine (Phila Pa 1976) 2000;25(19):2537–40. [463] Abe E, Sato K, Tazawa H, Murai H, Okada K, Shimada Y, et al. Total spondylectomy for primary tumor of the thoracolumbar spine. Spinal Cord 2000;38(3):146–52. [464] Bosma JJ, Pigott TJ, Pennie BH, Jaffray DC. En bloc removal of the lower lumbar vertebral body for chordoma. Report of two cases. J Neurosurg 2001;94(Suppl. 2):284–91. [465] Biagini R, Casadei R, Boriani S, Erba F, Sturale C, Mascari C, et al. En bloc vertebrectomy and dural resection for chordoma: a case report. Spine (Phila Pa 1976) 2003;28(18):E368–72. [466] Guo C, Yan Z, Zhang J, Jiang C, Dong J, Jiang X, et al. Modified total en bloc spondylectomy in thoracic vertebra tumour. Eur Spine J 2011;20(4): 655–60. [467] Sivabalan P, Li J, Mobbs RJ. Extensive lumbar chordoma unique reconstructive approach. Eur Spine J 2011;20(Suppl. 2):S336–42 [Epub 2011 Apr 10]. [468] Clarke MJ, Hsu W, Suk I, McCarthy E, Black 3rd JH, Sciubba DM, et al. Threelevel en bloc spondylectomy for chordoma. Neurosurgery 2011;68(2 Suppl. Operative):325–33 [discussion 333]. [469] Wakao N, Imagama S, Ito Z, Ando K, Hirano K, Tauchi R, et al. Total en bloc spondylectomy for L2 chordoma: a case report. Nagoya J Med Sci 2011;73(3–4):197–203.
77
[470] Chadha M, Agarwal A, Wadhwa N. Chondroid chordoma of the L5 spinous process and lamina: a case report. Eur Spine J 2005;14(8):803–6 [Epub 2005 May 14]. [471] Kamal MF, Farah GR, Malkawi HM, Khammash HM. Tumores rari et inusitati. Chordoma in a lumbar vertebral transverse process: a case report and review of the literature. Clin Oncol 1984;10(2):167–72. [472] Enneking WF, Spanier SS, Goodman MA. A system for the surgical staging of musculoskeletal sarcoma. Clin Orthop Relat Res 2003;415:4–18. [473] Buraczewski J, Rudowski W. Chordoma of the thoracic spine appearing as a mediastinal tumor. J Thorac Surg 1957;34:75–84. [474] Levowitz BS, Khan MY, Rand E, Hurwitz A. Thoracic vertebral chordoma presenting as a posterior mediastinal tumor. Ann Thorac Surg 1966;2(1):75–81. [475] Schwarz SS, Fisher 3rd WS, Pulliam MW, Weinstein ZR. Thoracic chordoma in a patient with paraparesis and ivory vertebral body. Neurosurgery 1985;16(1):100–2. [476] Cotler HB, Cotler JM, Cohn HE, Israel HI, Gartland JJ. Intrathoracic chordoma presenting as a posterior superior mediastinal tumor. Spine (Phila Pa 1976) 1983;8(7):781–6. [477] Ahrendt MN, Wesselhoeft CW. Chordoma presenting as a posterior mediastinal mass in a pediatric patient. J Pediatr Surg 1992;27(12):1515–8. [478] Taki S, Kakuda K, Kakuma K, Yamashita R, Kosugi M, Annen Y. Posterior mediastinal chordoma: MR imaging findings. AJR Am J Roentgenol 1996;166(1):26–7. [479] Murphy JM, Wallis F, Toland J, Toner M, Wilson GF. CT and MRI appearances of a thoracic chordoma. Eur Radiol 1998;8(9):1677–9. [480] Topsakal C, Bulut S, Erol FS, Ozercan I, Yildirim H. Chordoma of the thoracic spine–case report. Neurol Med Chir (Tokyo) 2002;42(4):175–80. [481] Delgado R, Bonatelli Ade P, Stávale JN. Thoracic chordoma. Arq Neuropsiquiatr 2008;66(2B):405–7. [482] Wang WL, Abramson JH, Ganguly A, Rosenberg AE. The surgical pathology of notochordal remnants in adult intervertebral disks: a report of 3 cases. Am J Surg Pathol 2008;32(8):1123–9. [483] Cho HY, Lee M, Takei H, Dancer J, Ro JY, Zhai QJ. Immunohistochemical comparison of chordoma with chondrosarcoma, myxopapillary ependymoma, and chordoid meningioma. Appl Immunohistochem Mol Morphol 2009;17(2):131–8. [484] Radl R, Leithner A, Kastner N, Bodo K, Nader A, Windhager R. Disappearance of a cervical spine chordoma after nonoperative treatment. A case report. J Bone Joint Surg Am 2005;87(8):1822–7. [485] Higinbotham NL, Philipps RF, Farr HW, Hutsu HO. Chordoma. Thirty-five years study at Memorial Hospital. Cancer 1967;20:1841–50. [486] Rich TA, Schiller A, Suit HD, Mankin HJ. Clinical and pathologic review of 48 cases of chordoma. Cancer 1985;56(1):182–7. [487] Probst EN, Zanella FE, Vortmeyer AO. Congenital clivus chordoma. AJNR Am J Neuroradiol 1993;14(3):537–9. [488] Sassin JF, Chutorian AM. Intracranial chordoma in children. Arch Neurol 1967;17(1):89–93. [489] Cummings BJ, Hodson DI, Bush RS. Chordoma: the results of megavoltage radiation therapy. Int J Radiat Oncol Biol Phys 1983;9(5):633–42. [490] Proyard G, Dony H. Chordoma of the cervical spine. Acta Chir Belg 1965;64:132–9. [491] Occhipinti E, Mastrostefano R, Pompili A, Carapella CM, Caroli F, Riccio A. Spinal chordomas in infancy. Report of a case and analysis of the literature. Childs Brain 1981;8(3):198–206. [492] Jain SP, Agrawal PK, Jain S, Pandey UC, Samuel KC, Sinha N. Chordoma presenting in the gluteal region in the child. Report of a rare case. Indian J Cancer 1981;18(2):160–2. [493] Tao Z-Z, Chen S-M, Liu J-F, Huang X-L, Zhou L. Paranasal sinuses chordoma in pediatric patient: a case report and literature review. Int J Pediatr Otorhinolaryngol 2005;69(10):1415–8. [494] Berdal P, Myhre E. Cranial chordomas involving the paranasal sinuses. J Laryngol Otol 1964;78:906–19. [495] Yoneoka Y, Tsumanuma I, Fukuda M, Tamura T, Morii K, Tanaka R, et al. Cranial base chordoma – long-term outcome and review of the literature. Acta Neurochir 2008;150(8):773–8. [496] Horton KM, Levey MS, Owl-Smith FA, Azizkhan RG, Schiebler ML. Metastasizing chordoma in early childhood: report of a case at 1,5 T. Magn Reson Imaging 1989;7(6):689–91. [497] Bianchi PM, Marsella P, Masi R, Andriani G, Tucci FM, Partipilo P, et al. Cervical chordoma in childhood: clinical statistical contribution. Int J Pediatr Otorhinolaryngol 1989;18(1):39–45. [498] Jallo J, Nathan D, Bierbrauer K, Farber E. Chordoma: a case report. Surg Neurol 1997;48(1):46–8. [499] Zhou, Hua, Zhongjun Liu, Cuiling Liu, Qingjun Ma, Xiaoguang Liu, et al. Cervical chordoma in childhood without typical vertebral bony destruction: case report and review of the literature. Spine 2009;34(14):E493–7. [500] Clemons RL, Blank RH, Hutcheson JB, Ruffolo EH. Chordoma presenting as a posterior mediastinal mass. A choristoma. J Thorac Cardiovasc Surg 1972;63(6):922–4. [501] Stratt B, Steiner RM. The radiologic findings in posterior mediastinal chordoma. Skeletal Radiol 1980;5(3):171–3. [502] Niida H, Tanaka R, Tamura T, Takeuchi S. Clival chordoma in early childhood without bone involvement. Childs Nerv Syst 1994;10(8):533–5. [503] Kombogiorgas D, St George EJ, Chapman S, English M, Solanki GA. Infantile clivus chordoma without clivus involvement: case report and review of the literature. Childs Nerv Syst 2006;22(10):1369–74.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003
G Model NEUCHI-612; No. of Pages 78 78
ARTICLE IN PRESS B. George et al. / Neurochirurgie xxx (2014) xxx–xxx
[504] Yoneoka Y, Tsumanuma I, Fukuda M, Tamura T, Morii K, Tanaka R, et al. Cranial base Chordoma – long term outcome and review of the literature. Acta Neurochir 2008;150(8):773–8. [505] Matsumoto J, Towbin RB, Ball Jr WS. Cranial chordomas in infancy and childhood. A report of two cases and review of the literature. Pediatric Radiology 1989;20(1–2):28–32. [506] Kaneko Y, Sato Y, Iwaki T, Shin RW, Tateishi J, Fukui M. Chordoma in early childhood: a clinicopathological study. Neurosurgery 1991;29(3):442–6. ˜ [507] Auger M, Raney B, Callender D, Eifel P, Ordónez NG. Metastatic intracranial chordoma in a child with massive pulmonary tumor emboli. Pediatr Pathol 1994;14(5):763–70. [508] Argaud R, Lestrade A. Sur la précocité de certains chordomes sacrococcygiens. Bull Acad Med 1926;95:375–7. [509] Worthy TS. Sacrococcygeal chordoma – two cases with unusual features. Clin Radiol 1965;16(4):412–3. [510] Garofalo E, Minerva A, Baltieri G. Sacrococcygeal chordoma in a 19-month-old boy. Minerva Pediatr 1976;28(31):1909–14. [511] Nakamura Y, Becker LE, Marks A. S100 protein in human chordoma and human and rabbit notochord. Arch Pathol Lab Med 1983;107(3):118–20. [512] Emery JL. Pulmonary embolus in children. Arch Dis Child 1962;37:591–5. [513] Lountzis NI, Hogarty MD, Kim HJ, Junkins-Hopkins JM. Cutaneous metastatic chordoma with concomitant tuberous sclerosis. J Am Acad Dermatol 2006;55(2 Suppl.):S6–10. [514] Schneegans E, Mandigas M. Hydrocephalie non communicante due à un chordome malin. Bull Soc Pediatr 1938;36:535–8. [515] Larson 3rd TC, Houser OW, Laws Jr ER. Imaging of cranial chordomas. Mayo clinic proceedings. Mayo Clinic 1987;62(10):886–93. [516] Nolte K. Malignant intracranial chordoma and sarcoma of the clivus in infancy. Pediatr Radiol 1979;8(1):1–6. [517] Richards AT, Stricke L, Spitz L. Sacrococcygeal chordomas in children. J Pediatr Surg 1973;8(6):911–4. [518] Cable DG, Moir C. Pediatric sacrococcygeal chordomas: a rare tumor to be differentiated from sacrococcygeal teratoma. J Pediatr Surg 1997;32(5):759–61. [519] Al-Adra D, Bennett A, Gill R, Lees G. Pediatric metastatic sacrococcygeal chordoma treated with surgery. Eur J Pediatr Surg 2011;21(3):196–8. [520] Kozlowski K, Barylak A, Campbell J, Hoeffel JD, Beluffi G, Masel J, et al. Primary sacral bone tumours in children (report of 16 cases with a short literature review). Australas Radiol 1990;34(2):142–9. [521] Shinmura Y, Katsutoshi M, Shuhei Y, Yoshihiro T. Sacrococcygeal chordoma in infancy showing an aggressive clinical course: an autopsy case report. Pathol Int 2003;53(7):473–7. [522] Ellis VH. Notochordal tumor of cauda equina in a child of 8 years. Br J Surg 1935;23:25–30. [523] Congdon CC. Benign and malignant chordomas; a clinico-anatomical study of twenty-two cases. Am J Pathol 1952;28(5):793–821. [524] Choi, Gwi Hyun, Moon-Sool Yang, Do Heum Yoon, Hyun Chyul Shin, Keung Nyun Kim, et al. Pediatric cervical chordoma: report of two cases and a review of the current literature. Child’s Nervous System 2010;26(6):835–40. [525] Windeyer BW. Chordoma. Proc Royal Soc Med 1959;52:1088–100. [526] Killampalli VV, Dominic P, Alistair JS. Preadolescent presentation of a lumbar chordoma: results of vertebrectomy and fibula strut graft reconstruction at 8 years. Eur Spine J 2006;15(Suppl. 5):621–5. [527] Rosenqvist H, Saltzman GF. Sacrococcygeal and vertebral chordomas and their treatment. Acta Radiol 1959;52:177–93. [528] Brooks JJ, LiVolsi VA, Trojanowski JQ. Does chondroid chordoma exist? Acta Neuropathologica 1987;72(3):229–35. [529] Amendola BE, Amendola MA, Oliver E, McClatchey KD. Chordoma: role of radiation therapy. Radiology 1986;158(3):839–43. [530] Taylor RE, Eldridge PR, Errington RD, Jones B, Punt J, Spooner D. Proton therapy for base of skull chordoma: a report of the Royal College of Radiologists. Clin Oncol 2000;12:75–9. [531] Menezes AH. Craniovertebral junction neoplasms in the pediatric population. Childs Nerv Syst 2008;24(10):1173–86. [532] Krayenbühl H, Yasargil MG. Cranial chordomas. Prog Neurol Surg 1975;6:380. [533] Tewfik HH, McGinnis WL, Nordstrom DG, Latourette HB. Chordoma: evaluation of clinical behavior and treatment modalities. Int J Radiat Oncol Biol Phys 1977;2(9–10):959–62. [534] Reddy EK, Mansfield CM, Hartman GV. Chordoma. Int J Radiat Oncol Biol Phys 1981;7(12):1709–11. [535] Habrand JL, Bondiau PY, Dupuis O, Lévy-Piedbois C, Marin JL, Oberlin O. Late effects of radiotherapy in children. Cancer Radiother 1997;1(6):810–6. [536] Habrand JL, Bolle S, Datchary J, Alapetite C, Petras S, Helfre S, et al. Proton beam therapy in pediatric radiotherapy. Cancer radiothérapie 2009;13(6–7):550–5. [537] O’Connell JX, Renard LG, Liebsch NJ, Efird JT, Munzenrider JE, Rosenberg AE. Base of skull chordoma. A correlative study of histologic and clinical features of 62 cases. Cancer 1994;74(8):2261–7. [538] Mitchell A, Scheithauer BW, Unni KK, Forsyth PJ, Wold LE, McGivney DJ. Chordoma and chondroid neoplasms of the spheno-occiput. An immunohistochemical study of 41 cases with prognostic and nosologic implications. Cancer 1993;72(10):2943–9. [539] Nielsen GP, Rosenberg AE, Liebsch NJ. Chordomas of the base of skull in children and adolescents: a clinicopathologic study of 35 cases. Mod Pathol 1996;9(11A).
[540] Brooks M, Kleefield J, O’Reilly GV, Haykal HA, MacLeod M. Thoracic chordoma with unusual radiographic features. Comput Radiol 1987;11(2):85–90. [541] Dhall G, Traverso M, Finlay JL, Shane L, Gonzalez-Gomez I, Jubran R. The role of chemotherapy in pediatric clival chordomas. J Neurooncol 2011;103(3):657–62. [542] Nix WL, Steuber CP, Hawkins EP, Stenback WA, Pokorny WJ, Fernbach DJ. Sacrococcygeal chordoma in a neonate with multiple anomalies. J Pediatr 1978;93(6):995–8. [543] Yadav YR, Kak VK, Khosla VK, Khandelwal N, Radotra BD. Cranial chordoma in the first decade. Clin Neurol Neurosurg 1992;94(3):241–6. [544] Sen CN, Sekhar LN, Schramm VL, Janecka IP. Chordoma and chondrosarcoma of the cranial base: an 8-year experience. Neurosurgery 1989;25(6):931–40. [545] Derome PJ, Visot A, Monteil JP, Maestro JL. Management of cranial chordomas in tumors of the cranial base. Diagnosis and treatment. New-York: Futura; 1987. p. 607–22. [549] Boriani S, Weinstein JN, Biagini R. Primary bone tumors of the spine. Terminology and surgical staging. Spine (Phila Pa 1976) 1997;22(9):1036–44 [Review]. [550] Casali PG. Adding cisplatin (CDDP) to imatinib (IM) re-establishes tumor response following secondary resistance to IM in advanced chordoma; 2012. Casali et al., 25 (18 Supplement): 10038 – ASCO Meeting Abstracts [Internet]. Disponible sur: http://meeting.ascopubs.org/cgi/content/abstract/25/ 18 suppl/10038 [551] De Comas AM, Deavers MT, Raymond AK, Madewell JE, Lewis VO. Intraneural parachordoma of the arm with regional metastases. Skeletal Radiol 2011;40(7):943–6. [560] Makek M, Leu HJ. Malignant fibrous histiocytoma arising in a recurrent chordoma: case report and electron microscopic findings. Virchows Arch A Pathol Anat Histol 1982;397(3):241–50. [565] Virchow R. Untersuchungen ueber die Entwicklung des Schaedelgrundes im gesunden und krankhaften Zustande und uber den Einfluss derselben auf Schadelform, Gesichtsbildung und Gehirnban. Berlin: G. Reimer; 1857. p. 47. [566] Zarghouni M, Vandergriff C, Layton KF, Mcgowan JB, Coimbra C, Bhakti A, et al. Chordoid glioma of the third ventricle. Proc (Bayl Univ Med Cent) 2012;25(3):285–6. [567] Buckingham M, Bajard L, Chang T, Daubas P, Hadchouel J, Meilhac S, et al. The formation of skeletal muscle: from somite to limb. J Anat 2003;202:59–68. [568] Lalam R, Cassar-Pullicino VN, McClure J, Singh J. Entrapped intralesional marrow: a hitherto undescribed imaging feature of benign notochordal cell tumour. Skeletal Radiol 2012;41:B725–31. [569] Barry JJ, Jian BJ, Sughrue ME, Kane AJ, Mills SA, Tihan T, et al. The next step: innovative molecular targeted therapies for treatment of intracranial chordoma patients. Neurosurgery 2011;68(1):231–40 [discussion 240–1. Review]. [570] Trikha V, Gupta V, Kumar R. Increased uptake in Tc-99m MDP scan of sacral chordoma: an unusual presentation. Clin Nucl Med 2004;29(9):562–3. [571] Rossleigh MA, Smith J, Yeh SD. Scintigraphic features of primary sacral tumors. J Nucl Med 1986;27(5):627–30. [572] Origitano TC, Karesh SM, Henkin RE, Halama JR, Reichman OH. Photodynamic therapy for intracranial neoplasms: investigations of photosensitizer uptake and distribution using indium-111 Photofrin-II single photon emission computed tomography scans in humans with intracranial neoplasms. Neurosurgery 1993;32(3):357–63 [discussion 363–4]. [573] Di Girolamo S, Ottaviani F, Floris R, Bruno E, Napolitano B, Schillaci O. Indium111 pentetreotide single photon emission computed tomography (In111 pentetreotide SPECT): a new technique to evaluate somatostatin receptors in chordomas. J Laryngol Otol 2005;119(5):405–8. [574] Higuchi T, Taki J, Sumiya H, Kinuya S, Bunko H, Nonomura A, et al. Intense 201 Tl uptake in giant-cell tumour of bone. Nucl Med Commun 2002;23(6):595–9. [575] Suga K, Tanaka N, Nakanishi T, Utsumi H, Yamada N. Bone and gallium scintigraphy in sacral chordoma. Report of four cases. Clin Nucl Med 1992;17(3):206–12. [576] Miyazawa N, Ishigame K, Kato S, Satoh Y, Shinohara T. Thoracic chordoma: review and role of FDG-PET. J Neurosurg Sci 2008;52(4):117–21. [577] Park SA, Kim HS. F-18 FDG PET/CT evaluation of sacrococcygeal chordoma. Clin Nucl Med 2008;33(12):906–8. [578] Ferraresi V, Nuzzo C, Zoccali C, Marandino F, Vidiri A, Salducca N, et al. Chordoma: clinical characteristics, management and prognosis of a case series of 25 patients. BMC Cancer 2010;10:22, http://dx.doi.org/10.1186/1471-2407-10-22. [579] Zhang H, Yoshikawa K, Tamura K, Sagou K, Tian M, Suhara T, et al. Carbon11-methionine positron emission tomography imaging of chordoma. Skeletal Radiol 2004;33(9):524–30. [580] Mammar H, Kerrou K, Nataf V, Pontvert D, Clemenceau S, Lot G, et al. Positron emission tomography/computed tomography imaging of residual skull base chordoma before radiotherapy using fluoromisonidazole and fluorodeoxyglucose: potential consequences for dose painting. Int J Radiat Oncol Biol Phys 2012;84(3):681–7. [581] Jackson RJ, Gokaslan ZL. Spinal-pelvic fixation in patients with lumbosacral neoplasms. J Neurosurg 2000;92(1 Suppl):61–70.
Pour citer cet article : George B, et al. Les chordomes. Neurochirurgie (2014), http://dx.doi.org/10.1016/j.neuchi.2014.02.003